
- •1. Основные понятия технической термодинамики
- •2. Параметры состояния рабочего тела, единицы измерения.
- •3. Внутренняя энергия и энтальпия.
- •4. Работа изменения объема рабочего тела.
- •5. Первый закон термодинамики.
- •6. Уравнение состояния идеальных газов
- •7. Основные законы идеальных газов.
- •8. Смеси идеальных газов
- •9. Теплоёмкость идеальных газов
- •Теплоемкости с и ср
- •10. Основные процессы изменения состояния идеальных газов.
- •Адиабатный процесс
- •11. Термодинамическая обратимость процессов
- •12. Оценка эффективности циклов.
- •13. Основные формулировки второго закона термодинамики
- •14. Цикл Карно
- •15.Энтропия и ее изменение энтропии в необратимых процессах
- •16. Физический смысл энтропии.
- •17. Аналитическое выражение второго закона термодинамики
- •18.Водяной пар. Основные понятия
- •19. Парообразование в – диаграмме
- •20.Влажный пар и его параметры
- •22.Влажный воздух. Основные определения
- •24.Термодинамический анализ работы компрессора, многоступенчатое сжатие в компрессорах.
- •25.Термодинамический цикл двс, цикл Отто.
- •26.Термодинамический цикл двс, цикл Дизеля.
- •27.Цикл воздушно холодильной установки.
- •28.Цикл парокомпрессионной холодильной установки.
- •29.Цикл теплового насоса.
- •30.Основные способы передачи тепловой энергии.
- •31.Основные положения теплопроводности. Температурное поле и градиент.
- •32.Тепловой поток. Плотность. Закон Фурье.
- •33.Дифиринциальное уравнение теплопроводности.
- •34.Условее однозначности для процессов теплопроводности.
- •35.Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 1-го рода.
- •36. Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 3-его рода.
- •37.Стационарная теплопроводность однослойной и многослойной трубы 1-ого рода.
- •39.Пути интенсификации теплопередачи.
- •41.Дифферинциальные уравнения конвективного теплообмена: уравнения теплоотдачи, энергии, движения, неразрывности.
- •43.Условия подобия физических процессов.
- •44.Теплоотдача плоской поверхностью.
- •46.Теплоотдача при движении жидкости в трубах.
- •47.Теплоотдача при поперечном омывании.
- •48.Теплоотдача при свободном движении жидкости.
- •49.Общее представление о процессе кипения. Кризисы кипения.
- •50.Теплоотдача при плёночной и капельной конденсации.
- •51. Тепловое излучение. Основные понятия и определения
- •52. Основные законы теплового излучения.
- •53. Теплообмен излучения между параллельными пластинами и при наличии экрана
- •54.Теплообмен излучением между телами произвольно расположенными в пространстве. Угловые коэффициенты и их свойства
- •55. Классификация теплообменников
- •56. Основные положения теплоотсчёта рекуперативных аппаратов
5. Первый закон термодинамики.
Энергия изолированной термодинамической системы остается неизменной, независимо от того, какие процессы в ней протекают.
Для тепломеханических
процессов это означает, что если в
тепловом двигателе совершается прямой
цикл, то сообщенное в этом цикле рабочему
телу тепло
![]() должно быть в точности равно совершаемой
им работе
должно быть в точности равно совершаемой
им работе
![]() .
Если бы оказалось, что
.
Если бы оказалось, что
![]() ,
то можно было бы создать так называемый
вечный двигатель первого рода, т.е.
двигатель, совершающий работу без
затраты внешней энергии. Равным образом,
если бы оказалось, что
,
то можно было бы создать так называемый
вечный двигатель первого рода, т.е.
двигатель, совершающий работу без
затраты внешней энергии. Равным образом,
если бы оказалось, что
![]() ,
то имело бы место бесследное исчезновение
энергии, равной
,
то имело бы место бесследное исчезновение
энергии, равной
![]() .
Оба предположения противоречат первому
закону термодинамики, а из этого следует,
что в данном случае
.
Оба предположения противоречат первому
закону термодинамики, а из этого следует,
что в данном случае
![]() .
.
Рассмотрим теперь
произвольный незамкнутый процесс 1–2.
в общем случае для этого процесса
![]() ,
поэтому уравнение
баланса энергии,
выражающее неизменность общего запаса
ее в термодинамически изолированной
системе принимает вид:
,
поэтому уравнение
баланса энергии,
выражающее неизменность общего запаса
ее в термодинамически изолированной
системе принимает вид:
![]()
В развернутой форме аналитическое выражение первого закона термодинамики для процесса 1–2 принимает вид:
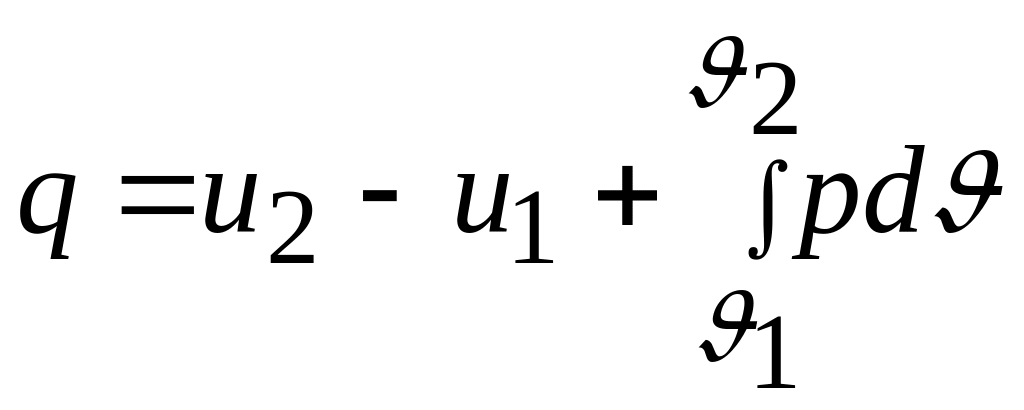
а в дифференциальной форме
![]()
В этом выражении вместо внутренней энергии u может быть введена энтальпия i.
 .
.
Интеграл –
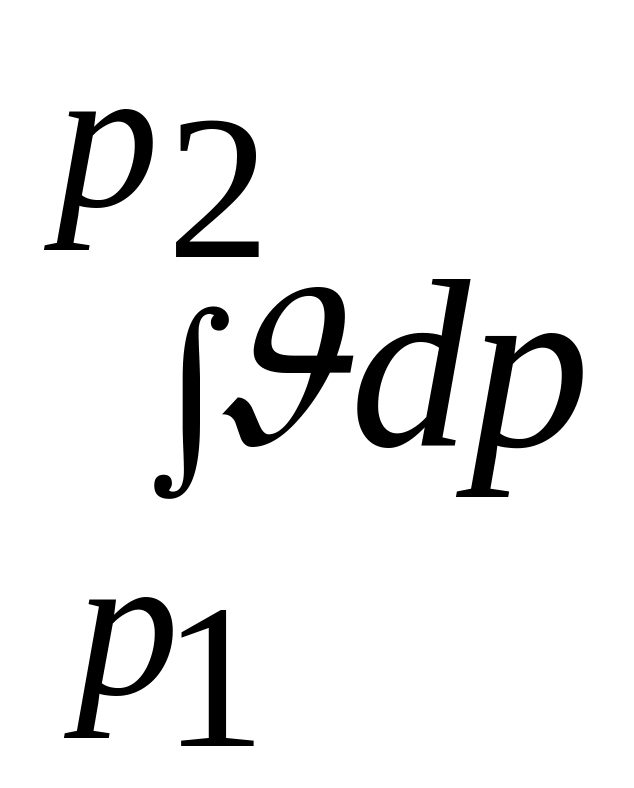 ,
как энтальпия, представляет собой в
общем случае чисто математическую
величину и приобретает конкретное
физическое содержание лишь при
рассмотрении процессов, протекающих в
потоке рабочего тела.
,
как энтальпия, представляет собой в
общем случае чисто математическую
величину и приобретает конкретное
физическое содержание лишь при
рассмотрении процессов, протекающих в
потоке рабочего тела.
6. Уравнение состояния идеальных газов
Основное уравнение кинетической теории газов, или уравнение Клаузиуса:
![]() ,
,
где р – давление газа; n – число молекул; m – масса молекул; – средняя скорость молекул.
Из этого уравнения получаем:
![]() .
.
Обозначив число молекул в одном килограмме газа через z, имеем:
![]()
и тогда
![]() .
.
Написав это уравнение для двух произвольных состояний газа:
![]() и
и
![]()
и разделив первое равенство на второе, а затем, объединив параметры, относящиеся к одному и тому же состоянию, находим:
![]()
Поскольку состояния газа были приняты произвольно, очевидно, что величина
![]()
имеет одно и то же значение для любого состояния газа. Она называется газовой постоянной и имеет размерность:
![]() .
.
Таким образом, термические параметры идеального газа в любом его состоянии связаны зависимостью
![]() ,
,
которая представляет собой термическое уравнение состояния идеального газа.
Впервые эта зависимость была получена Клапейроном и поэтому часто называется уравнением Клапейрона.
Умножая обе части
равенства на массу газа М
и учитывая, что
![]() ,
где V
– полный объем этого газа, получаем
уравнение
состояния произвольного количества
идеального газа:
,
где V
– полный объем этого газа, получаем
уравнение
состояния произвольного количества
идеального газа:
![]() .
.
7. Основные законы идеальных газов.
Полагая
![]() получаем, что
получаем, что
![]()
т.е. при постоянном объеме давление газа изменяется прямо пропорционально его абсолютной температуре. Это положение называется законом Шарля.
Полагая что
![]() ,
получаем:
,
получаем:
![]()
т.е. при постоянном давлении объем газа изменяется прямо пропорционально его абсолютной температуре. Это положение называется законом Гей –Люссака.
Полагая
![]() ,
получаем:
,
получаем:
![]()
т.е. при постоянной температуре объем газа изменяется обратно пропорционально давлению. Это положение называется законом Бойля – Мариотта.
Если разные газы, молекулы которых имеют равную массу, имеют одинаковую температуру, то средние кинетические энергии молекул их равны. Если же у этих газов одинаковы и давления, то у них равны и количества молекул в единице объема, поскольку
![]() ,
,
а после сокращения
![]() .
.
Отсюда следует, что разные газы, находящиеся при одинаковых давлениях и температурах занимающие одинаковые объемы, содержат одинаковое число молекул. Это положение называется законом Авогадро.
Из закона Авогадро вытекает, что при одинаковых давлениях и температурах плотности газов пропорциональны их молекулярным массам, т.е.
![]()
