
- •1. Основные понятия технической термодинамики
- •2. Параметры состояния рабочего тела, единицы измерения.
- •3. Внутренняя энергия и энтальпия.
- •4. Работа изменения объема рабочего тела.
- •5. Первый закон термодинамики.
- •6. Уравнение состояния идеальных газов
- •7. Основные законы идеальных газов.
- •8. Смеси идеальных газов
- •9. Теплоёмкость идеальных газов
- •Теплоемкости с и ср
- •10. Основные процессы изменения состояния идеальных газов.
- •Адиабатный процесс
- •11. Термодинамическая обратимость процессов
- •12. Оценка эффективности циклов.
- •13. Основные формулировки второго закона термодинамики
- •14. Цикл Карно
- •15.Энтропия и ее изменение энтропии в необратимых процессах
- •16. Физический смысл энтропии.
- •17. Аналитическое выражение второго закона термодинамики
- •18.Водяной пар. Основные понятия
- •19. Парообразование в – диаграмме
- •20.Влажный пар и его параметры
- •22.Влажный воздух. Основные определения
- •24.Термодинамический анализ работы компрессора, многоступенчатое сжатие в компрессорах.
- •25.Термодинамический цикл двс, цикл Отто.
- •26.Термодинамический цикл двс, цикл Дизеля.
- •27.Цикл воздушно холодильной установки.
- •28.Цикл парокомпрессионной холодильной установки.
- •29.Цикл теплового насоса.
- •30.Основные способы передачи тепловой энергии.
- •31.Основные положения теплопроводности. Температурное поле и градиент.
- •32.Тепловой поток. Плотность. Закон Фурье.
- •33.Дифиринциальное уравнение теплопроводности.
- •34.Условее однозначности для процессов теплопроводности.
- •35.Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 1-го рода.
- •36. Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 3-его рода.
- •37.Стационарная теплопроводность однослойной и многослойной трубы 1-ого рода.
- •39.Пути интенсификации теплопередачи.
- •41.Дифферинциальные уравнения конвективного теплообмена: уравнения теплоотдачи, энергии, движения, неразрывности.
- •43.Условия подобия физических процессов.
- •44.Теплоотдача плоской поверхностью.
- •46.Теплоотдача при движении жидкости в трубах.
- •47.Теплоотдача при поперечном омывании.
- •48.Теплоотдача при свободном движении жидкости.
- •49.Общее представление о процессе кипения. Кризисы кипения.
- •50.Теплоотдача при плёночной и капельной конденсации.
- •51. Тепловое излучение. Основные понятия и определения
- •52. Основные законы теплового излучения.
- •53. Теплообмен излучения между параллельными пластинами и при наличии экрана
- •54.Теплообмен излучением между телами произвольно расположенными в пространстве. Угловые коэффициенты и их свойства
- •55. Классификация теплообменников
- •56. Основные положения теплоотсчёта рекуперативных аппаратов
8. Смеси идеальных газов
Если несколько газов, не взаимодействующих химически, поместить в общий сосуд, то благодаря хаотическому движению молекул, каждый из них равномерно распределится по всему объему сосуда и образуется газовая смесь.
Если обозначить концентрацию газа, т.е. количество молекул газа в единице объема через n, то согласно сказанному
![]() ,
,
т.е. концентрация газовой смеси равна сумме концентраций всех ее компонентов.
Поэтому для всей смеси в целом основное уравнение кинетической теории газов
![]() ,
,
где
![]() –
средняя кинетическая энергия молекул
для всей смеси в целом, может быть
представлено в виде формулы
–
средняя кинетическая энергия молекул
для всей смеси в целом, может быть
представлено в виде формулы
![]() .
.
Учитывая, что все компоненты находятся при одной и той же температуре, имеем:
![]()
Каждое из слагаемых правой части представляет собой то давление, которое имел бы соответствующий компонент, если бы он один находился во всем объеме смеси при той же температуре, что и смесь. Такое давление называется парциальным давлением компонента.
Таким образом, давление газовой смеси равно сумме парциальных давлений ее компонентов, т.е.
![]() .
.
Это положение называется законом Дальтона.
На основании закона Дальтона
![]()
Газовая смесь характеризуется своим мольным, объемным или массовым составом.
Мольный
состав
задается мольными долями компонентов
![]() ,
,
![]() .
.
Объемный
состав
задается объемными долями компонентов
![]() ,
,
![]() .
.
Массовый
состав
задается массовыми долями компонентов,
![]() ,
,
![]() .
.
Чтобы к газовой смеси можно было применить уравнение состояния идеальных газов, следует знать ее газовую постоянную Rсм.
![]()
Если заданы объемные доли компонентов:
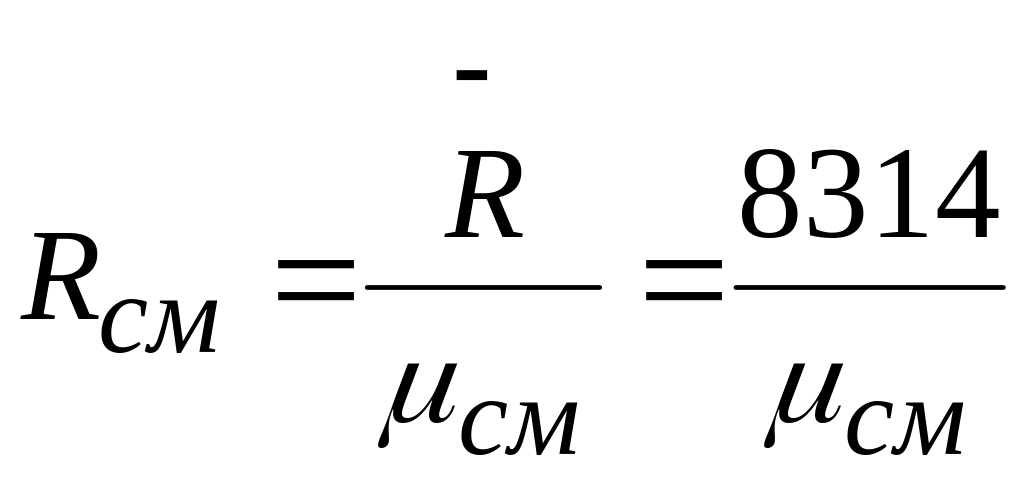 ,
Дж/(кгград)
,
Дж/(кгград)
где см
– вычисляется по формуле
![]()
9. Теплоёмкость идеальных газов
Теплоемкостью
тела есть
количество тепла, потребное для повышения
его температуры на один градус.
Теплоемкость, отнесенная к единице
количества вещества, является его
удельной теплоемкостью. Применительно
к газам в технической термодинамике
различают массовую
теплоемкость
с,
кДж/(кг·град), объемную
теплоемкость
с/
, кДж/(м3град)
и мольную
теплоемкость![]() ,
кДж/(кмольград).
Между собой эти теплоемкости связаны
очевидными соотношениями:
,
кДж/(кмольград).
Между собой эти теплоемкости связаны
очевидными соотношениями:
![]()
где
![]() –
удельный объем при нормальных условиях.
–
удельный объем при нормальных условиях.
Понятие теплоемкости имеет смысл лишь в том случае, когда задан характер процесса, в котором газу сообщается тепло.
![]() ,
,
О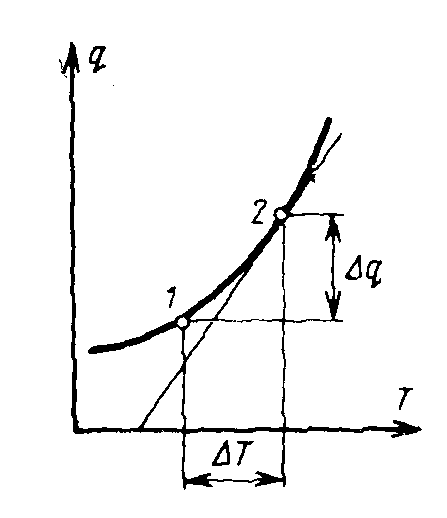 чевидно,
что на различных участках кривой одному
и тому же изменению температуры
соответствуют различные количества
подведенного тепла, поэтому и значения
теплоемкости на этих участках будут
различными. В связи с этим приходится
ввести понятие о теплоемкости, средней
в заданном интервале температур от Т1
до Т2
чевидно,
что на различных участках кривой одному
и тому же изменению температуры
соответствуют различные количества
подведенного тепла, поэтому и значения
теплоемкости на этих участках будут
различными. В связи с этим приходится
ввести понятие о теплоемкости, средней
в заданном интервале температур от Т1
до Т2
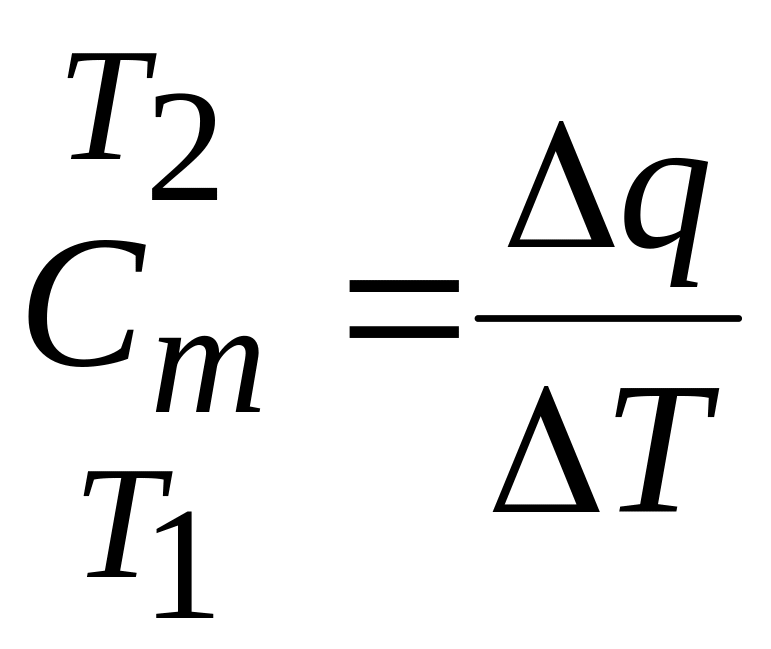
Беспредельно уменьшая рассматриваемый температурный интервал, получаем значение истинной теплоемкости при заданной температуре:
![]() .
.
Таким образом, истинная теплоемкость при данной температуре представляет собой предел, к которому стремится теплоемкость, средняя для прилегающего температурного интервала, когда этот интервал стремится к нулю.
