
- •Лекция №1 Основные понятия физики и химии полимеров
- •Лекция №2 Синтез полимеров. Основные понятия, термодинамика синтеза. Радикальная полимеризация; способы инициирования, кинетика и механизм реакции.
- •Кинетика и механизм радикальной полимеризации
- •Лекция №3 Влияние на скорость полимеризации концентрации мономера [м] и концентрации инициатора [і]; температуры и давления процесса. Гель-эффект. Ингибиторы радикальной полимеризации.
- •Влияние температуры и давления на скорость полимеризации
- •Гель-эффект
- •Ингибиторы радикальной полимеризации
- •Лекция №4 Ионная полимеризация. Катионная полимеризация: инициирование протонными кислотами и кислотами Льюиса. Сокатализатор и его функции; рост цепи обрыва и передачи цепи. Кинетика процесса.
- •Катализаторы анионной полимеризации
- •Лекция №6 Анионно-координационная полимеризация: полимеризация диенов, полимеризация на комплексных катализаторах Циглера-Натта на п-аллильных комплексах; получение стереорегулярных полимеров.
- •Лекция №7 Сополимеризация, ее значение как способа модификации полимеров. Типы сополимеризации: идеальная, блоксополимеризация, привитая. Состав сополимера. Закономерности процесса сополимеризации.
- •Состав сополимера.
- •Закономерности протекания сополимеризации.
- •Полимеризация в растворе.
- •Полимеризация в эмульсии.
- •Полимеризация в суспензии.
- •Лекция №9 Поликонденсация Типы реакций поликонденсации. Мономеры. Элементарные стадии процесса. Равновесная и неравновесная поликонденсация. Поликонденсационное равновесие; факторы определяющие его.
- •Элементарные стадии процесса поликонденсации
- •Поликонденсационное равновесие и факторы, определяющие его.
- •Побочные процессы при поликонденсации.
- •Поликонденсация в растворе
- •Твердофазная поликонденсация
- •На границе жидкость-жидкость
- •«Неравновесная поликонденсация: на границе раздела ж-г, эмульсионная. Реакция полиприсоединения. Ступенчатая полимеризация, её специфика ».
- •Эмульсионная поликонденсация
- •Ступенчатая поликонденсация
- •Лекция №12 Полимеранологичных превращения как способ химической модификации полимеров. Реакции внутримолекулярного отщепления и циклизации.
- •Процессы структурирования (сшивания) полимеров. Типы сеток и их параметры. Структурирование с участием функциональных групп полимеров, отвердителя.
- •Лекция №14 Радиационное и пероксидное сшивание. Структурирование с учетом винильных мономеров взаимопроникающие сетки.
- •Лекция №15 Процессы деструкции полимеров Физическая, химическая, биологическая, механическая, фотохимическая и радиационная деструкция
- •Лекция №16 Термическая деструкция, термостойкие полимеры, окисление полимеров кислородом воздуха и азотом. Термоокислительная деструкция важнейших промышленных полимеров
- •Лекция №23 Деформация полимеров Упругая, высокопластичная,. Пластическая, вынужденная высокопластичность, физическое состояние полимеров :стеклообразное, высокоэластичное, вязкотекучее
- •Лекция №24 Стеклообразное состояние полимеров. Структурное и механическое; зависимость температуры стеклования от химического строения полимера, молекулярной массы и гибкости макромолекулы.
- •Лекция №26 Высокоэластичное состояние полимера. Температурная область, влияние длительности действия силы и частоты деформации, молекулярной массы, полярности полимера и сшивки макромолекул
- •Лекция №27 Вязкотекучее состояние полимера. Влияние температуры, продолжительности; внешних воздействий, гидростатического давления, критической молекулярной массы.
- •1.Молекулярная масса
- •2.Разветвлённость макромол-лы
- •3.Температура
- •Лекция № 28 Пластификация полимеров. Фазовые равновесия в системе полимер-пластификатор. Пластификаторы и смягчители.
- •Лекция № 29 Кристаллизация полимеров, скорость кристаллизации, плавление кристаллов, влияние напряжения на кристаллизацию, влияние структуры, пластификации и наполнения на кристаллизацию.
- •Лекция № 30 Ориентированное состояние полимеров Ориентационная вытяжка и направленная полимеризация. Структура ориентированных полимеров
- •Лекция № 31 Растворы полимеров. Истинные растворы полимеров, ограниченное и неограниченное набухание, свойства растворов полимеров.
Лекция №2 Синтез полимеров. Основные понятия, термодинамика синтеза. Радикальная полимеризация; способы инициирования, кинетика и механизм реакции.
1.-Синтез полимеров, основные понятия термодинамического синтеза
2.-Радикальная полимеризация, способы инициирования
3.-Кинетика и механизм реакций
Полимеры получают синтезом из низкомолекулярных соединений мономеров 2-мя способами:
-полимеризация
-поликонденсация
При полимеризации макромолекулы образуются в результатете раскрытия ненасыщенных связей или циклов мономеров. При этом химический состав мономеров и повтор. Звена цепи одинаково. При поликонденсации мономеры соединяются в результате реакции концевых функциональных групп. Из реакции полимеризации наиболее распространена полимеризация мономеров, содержащие С=С связи. Полимеризация- это цепная реакция, в ходе которой молекулы мономеров последовательно присоединяются к активному центру, расположенному на конце растущей цепи в зависимости от природы активного центра различают радикальную и ионную полимеризацию.
Для цепных реакций существует понятие длины кинетической цепи равной числу химических актов, возбужденных одной исходной активной частицей (напр. R).
Развитие кинетической цепи сопровождается ростом материальной цепи, т.е. макромолекулы.
Длина кинетической цепи может быть равна длине материальной, может быть как больше так и меньше.
Процесс полимеризации может быть обратим (т.е. деполимеризация), а также протекать по цепному механизму.
Полимеризация полимеров возможна при условии:

∆G-изменение свободной энтальпии Гиббса при превращении мономера в полимер.
При полимеризации мономеров с кратными связями ∆H<0, ∆S<0, что означает термодинамическую возможность полимеризации при температуре меньше некоторых предельных температур.
Т.к. ∆G<0
имеет место при ∆H>T∆S,
то


При Т>Тп и ∆G>0 полимеризация термодинамические невозможна и возможна только деполимеризация.
При Т=Тп и ∆G=0 в системе устанавливается равновесие.
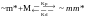
* - активный центр.
Kp – константа роста, Кd – константа деполимеризации. m*, mm* - растущая и деполимеризующая акт.
Это справедливо если при полимеризации цепи концентрация мономера и полимера не меняется. Например: при гетерогенной полимеризации в массе.
Более распространенной является гомогенная полимеризация в растворе или массе, когда концентрация мономера изменяется в процессе. В этом случае предельная температура связана с равновесными концентрациями мономера. При этом:
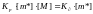
 -
концентрация активных цепей.
-
концентрация активных цепей.
 - концентрация мономера.
- концентрация мономера.
Из этого уравнения получают выражение, связывающее константу равновесия реакции Кравн с равновесной концентрацией мономера [M]:

Применяя к этому уравнению уравнение изотермы реакции получают:

Учитывая что при равновесии изменение энергии Гиббса равно нулю получаем:

Выразив
в этом уравнении
 ,
через равновесную концентрацию мономера
получаем уравнение связывающее предельную
равновесную температуру и равновесную
концентрацию мономера:
,
через равновесную концентрацию мономера
получаем уравнение связывающее предельную
равновесную температуру и равновесную
концентрацию мономера:
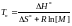
Предельная температура указывающаяся в справочниках обычно относится к равновесной концентрации мономера.
Теплота полимеризации через энергии химических связей:
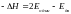
 - энергия одинарной связи.
- энергия одинарной связи.
 - энергия двойной связи.
- энергия двойной связи.
Для производных этилена:
 отсюда полимеризация таких мономеров
процесс экзотермический.
отсюда полимеризация таких мономеров
процесс экзотермический.
Мономер |
|
|
Этилен |
94,3 |
624 |
Стирол |
75,8 |
670 |
Метилметакрилат |
55,3 |
470 |
Тепловой эффект полимеризации мономеров с двойной углеродной связью зависит от количества заместителей у атома углерода соединенных двойной связью. Это объясняется эффектом сопряжения заместителя с двойной связью, снижающую энергию ее разрыва. Введение второго заместителя еще больше снижает теплоту полимеризации.
При поликонденсации на ряду с образованием линейных макромолекул могут образовываться циклы в результате взаимодействия концевых функциональных групп растущей цепи. Обычно образование циклов нежелательно. Следовательно, одной из задач термодинамики поликонденсации является предсказание условий, позволяющих к минимуму образование циклов.
Обозначают
равновесную концентрацию продукта
способного к циклизации [Mn].
Тогда
 - константа равновесия обратной реакции
циклизации может быть выражена уравнением:
- константа равновесия обратной реакции
циклизации может быть выражена уравнением:
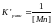
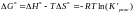
Наиболее вероятно образование пяти и шестичленных циклов, т.к. они наиболее устойчивы и образуются с выделением теплоты. В этом случае энергия Гиббса циклизации минимальна, а максимальна. Следовательно, циклизация опасна в самом начале процесса циклизации.
Некоторую вероятность имеет образование циклов с числом углеродных атомов 20. В этом случае изменение энтальпии и энтропии больше нуля, следовательно образование таких циклов становится более вероятным при повышении температуры.
Образование циклов с числом углеродных атомов больше двадцати т.к. концам молекул трудно найти друг друга в пространстве.
Т.к. равновесие реакции циклизации не зависит от концентрации, то с разбавлением реакционной смеси увеличивается вероятность образования циклов по сравнению с линейной поликонденсацией.
Радикальная полимеризация
Р. П. инициируется свободно R-активными частицами, имеющими неспаренный ē свободные радикалы могут возникнуть в результате воздействия на систему физических факторов или чисто химическим путём - при гемолитическом распаде соединений С.
относительно невысокая энергия связи или в результате окислительно-восстановительных процессов.
Из физических способов инициирование наиболее часто применяется:
-фотохимическое
-термическое
-радиохимическое
Фотохимическое- R образование при облучении мономера УФ светом λ<400нм по общей схеме:
М+hυ→М*→*R1+*R2
М*-возбужденная молекула мономера.
Если мономер не поглощает свет в этом спектре, то для образования радикала к нему добавляют фотосенсибимизатор (ż)- это соединение, передающее Евозб молекуле, непосредственно не поглощающий свет
Ż+ hυ→Ż*
Ż*+М→ Ż+М*→*R1+*R2
Скорость фотоинициирования примерно равна корню квадрата из интенсивности облучения и концентрация Ż.
Термическое инициирование- становится заметным при Т>1000С и обусловлена термическим распадом случайных примесей.
Установлено, что скорость термического инициирования приблизительно равна концентраций квадрата мономера, т.е. эта реакция бимолекулярная.
Радиохимическое излучение – молекулы мономера, или примесей под давлением радиоативного излучения предварительно ионизируются, теряя её, и лишь в результате дальнейших превращений образуется радикал.
М+излучение→М++ē→М*→*R1+*R2
М*-возбуждённая молекула полимера, образованная при рекомбинации катиона и ē
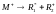
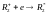
Евозб может превысить Е разрыва химических связей и возбуждённая молекула диссоциирует на радикалы.
Химическое инициирование - осуществляется радикалами, которые образуются при гомолитическом распаде специально вводимых соединений со слабыми ковалентными свойствами, обычно пероксидами (азосоединения)
Пероксиды применяются при Т=90-1000, диазосоединения при Т=40-700
Если процесс проводить при низких температурах используют окислительно-восстановительные системы, типичная система (реактив Фентона):
Н2О2+Fe2+→HO-+H.O+Fe3+
Радикалы, образующиеся при распаде инициаторов могут рекомбинировать за короткое время, когда они в «клетке», образованные молекулами мономера и растворителя, т.е. радикалы не успели разойтись – эффект клетки или первичная реация.
Например: при распаде пероксидабензоила образуются бензоатные и фенильные радикалы,

Оба радикала могут присоединяться к молекулам мономера, инициирование полимеризации, но на ряду с этим участвуют в побочных реакциях:
2С6H5COO* (C6H5CO)2 + CO2
С6H5COO* + С6H5* = С6H5COOС6H5
2 С6H5* = С6H5-С6H5
Отношение числа радикалов инициирующих полимеризацию к общему числу радикалов образующихся при распаде инициатора называется эффективность инициирования (f), она часто заметно меньше единицы (чаще 0,5-0,8).

 кДж/моль
кДж/моль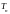 ,
К
,
К