
- •4.Константа электролитической диссоциации слабых электролитов. Закон разведения Оствальда.
- •5. Константа диссоциации воды. Ионное произведение воды. Водородный показатель рН.
- •6. Активность и коэффициент активности электролита. Средние ионные активности и коэффициенты активности. Средняя ионная моляльность, средний стехиометрический коэффициент.
- •7.Зависимость среднего ионного коэффнциента активности электролита от концентрации раствора и валентности ионов электролита. Ионная сила. Закон ионной силы.
- •8.Электролитическая теория сильных электролитов Дебая-Гюккеля, ионная атмосфера. Предельный закон Дебая-Гюккеля.
- •9.Удельная э/п р-ра,ее экс.Определение по сопротивл. Р-ра.Ед.Измер.В си.
- •12. Подвижность ионов.Ур-ние,связ. Подвижность(э/п)ионов при бескон.Разб.С пред.Эквив.Э/п р-ра(з-н Кольрауша).Опред.Степени дис.Слаб.Электрол.По э/п р-ра.
- •15.Кондуктометрия(кондукт.Титрование),опред.Растворимости и пр труднораствор.Соед,опред.РН р-ра.
- •16.Понятие о межфазной разности потенц.И строение двойного электр.Слоя на границе Ме-р-р.Нулевой р-р,потенц.Нулевого заряда.
- •17.Электр.Потенциал.Станд.Вод.Электрод.Зав-ть велич.Электр.Потенц.От прир.Электр.И от акт.Потенц.-опред.Ионов.Ур-ние Нернста.
- •18.Гальванический элемент. Процессы, протекающие на отрицательных и положительных электродах элемента. Правила записи гальванического элемента и электродных реакций.
- •31.Кинетика необратимых реакций третьего порядка
- •32.Кинетика Необратимые реакции n-ого порядка
- •34.Методы определения порядка реакции
- •37.Кинетика параллельных реакций первого порядка
- •1.Предмет электрохимии. Проводники первого и второго рода. Определение понятия электролит.
- •2.Основные положения теории электролитической диссоциации.Причины электролитической диссоциации электролитов при их растворении.
- •3.Сильные и слабые электролиты. Степень диссоциации, изотонический коэффициент.Уравнение связывающее степень диссоц. С изотон. Коэф.
- •46. Гетерогенный катализ
- •47.Мультиплетная теория гетерогенного катализа.
- •49.Цепные реакции.
1.Предмет электрохимии. Проводники первого и второго рода. Определение понятия электролит.
Электрохимия – раздел физической химии, изучающий связь между химическими процессами и электрическими явлениями. Электролиты – это вещества, которые в растворе и в расплаве диссоциируют на ионы и проводят электрический ток
проводники второго рода – вещества, обладающие ионной проводимостью (электролиты).проводники первого рода – вещества, обладающие электронной проводимостью.
2.Основные положения теории электролитической диссоциации.Причины электролитической диссоциации электролитов при их растворении.
Молекулы электролита подвергаются в растворах диссоциации на катионы и анионы.Диссоциация может быть полной или частичной. она характеризуется степенью диссоциации α. По способности к диссоциации электролиты были разделены на слабые и сильные.сильные электролиты - вещества, полностью диссоциирующие в растворе (α ≈ 1)электролиты - вещества, диссоциирующие в растворе лишь частично ( α < 1).
Согласно теории диссоциации Аррениуса взаимодействие между ионами отсутствует (как в идеальном газе). На самом деле молекулы, образовавшиеся при диссоциации, и ионы находятся в равновесии между собой. Процесс диссоциации обратим. Причина диссоциации ‑ это взаимодействие растворенного вещества с молекулами растворителя
3.Сильные и слабые электролиты. Степень диссоциации, изотонический коэффициент.Уравнение связывающее степень диссоц. с изотон. коэф.
сильные электролиты - вещества, полностью диссоциирующие в растворе (α ≈ 1).слабые электролиты - вещества, диссоциирующие в растворе лишь частично ( α < 1).
Степень
диссоциации
– это отношение числа частиц (молекул),
растворившихся на ионы к числу
растворенных частиц (молекул). α ≤ 1
зависит от концентрации электролита
и температуры
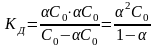 -
закон разведения Оствальда Изотонический
коэффициент (
i
) - это отношение числа всех частиц в
растворе к числу растворенных частиц.
i
≥ 1
-
закон разведения Оствальда Изотонический
коэффициент (
i
) - это отношение числа всех частиц в
растворе к числу растворенных частиц.
i
≥ 1
изотонический
коэффициент показывает, во сколько раз
суммарная эффективная концентрация
недиссоциированных молекул и ионов в
растворе больше начальной концентрации
молекул до диссоциации. С ростом
концентрации коэффициент
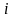 уменьшается.
уменьшается.
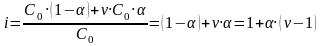
4.Константа электролитической диссоциации слабых электролитов. Закон разведения Оствальда.
Рассмотрим равновесие диссоциации слабого бинарного электролита, например,
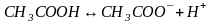 Пусть
С0
- начальная концентрация СН3СООН,
тогда
Пусть
С0
- начальная концентрация СН3СООН,
тогда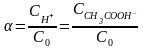 ,
,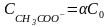 ,
,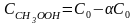 .Запишем
константу диссоциации
.(1)Выражение
(1) называют законом
разведения Оствальда
для
бинарных электролитов.
Для
более сложных электролитов выражение
для КД,
будет иметь иной вид.Как любая константа
равновесия, константа диссоциации
зависит от температуры, поэтому сила
электролита меняется с изменением
температуры.
.Запишем
константу диссоциации
.(1)Выражение
(1) называют законом
разведения Оствальда
для
бинарных электролитов.
Для
более сложных электролитов выражение
для КД,
будет иметь иной вид.Как любая константа
равновесия, константа диссоциации
зависит от температуры, поэтому сила
электролита меняется с изменением
температуры.
5. Константа диссоциации воды. Ионное произведение воды. Водородный показатель рН.
Вода, является слабым электролитом, и в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH- или H2O ↔ H+ + OH-
Константу диссоциации воды можно вычислить по формуле:
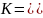 ,
где:
,
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде - величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л. При 25 °C константа диссоциации воды K равна 1,8×10−16моль/л.
Т.к.
для воды α<<1 и [H2O]
практически постоянна, то получаем
выражение для ионного
произведения воды: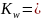
Kw – константа, зависящая от температуры.
Логарифм концентрации ионов водорода, взятый с обратным знаком, называется pH раствора (водородный показатель):
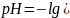
6. Активность и коэффициент активности электролита. Средние ионные активности и коэффициенты активности. Средняя ионная моляльность, средний стехиометрический коэффициент.
Активность можно рассматривать как формальную концентрацию, при которой раствор ведет себя как идеальный.
ai = ci·fi — активность i-го иона в растворе,
fi – коэффициент активности.
Величина коэффициента активности характеризует степень отклонения свойств реальных растворов электролитов от идеальных растворов. По смыслу fi это работа по переносу иона из идеального раствора в реальный.
Нельзя
принципиально найти экспериментально
активности отдельных ионов, т.к. нужно
было бы иметь дело с раствором из одного
вида ионов. Поэтому было введено понятие
средней
ионной активности
(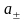 ),
представляющей собой среднее
геометрическое из активности отдельных
ионов:
),
представляющей собой среднее
геометрическое из активности отдельных
ионов:
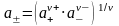 , где
, где
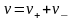
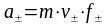 Средний
ионный коэффициент активности
(
Средний
ионный коэффициент активности
(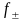 ),
связывающий активность с концентрацией
(a=f∙m),
определяется выражением, аналогичным
выражению для средней ионной активности
),
связывающий активность с концентрацией
(a=f∙m),
определяется выражением, аналогичным
выражению для средней ионной активности
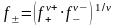
Аналогично средний ионный стехиометрический коэффициент определяется из выражения
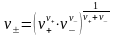
Средняя
ионная моляльность
(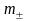 )
определяется как
)
определяется как
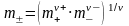
7.Зависимость среднего ионного коэффнциента активности электролита от концентрации раствора и валентности ионов электролита. Ионная сила. Закон ионной силы.

Средний
ионный коэффициент активности зависит
от концентрации
раствора. В области предельно разбавленных
растворов электролитов эта зависимость
имеет линейный характер в координатах
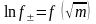 .
.
П рисутствие
в растворе других солей изменяет
коэффициент активности данной соли и
тем сильнее, чем больше заряд добавляемых
ионов. Суммарное действие всех ионов
в растворе выражается через ионную
силу
раствора
рисутствие
в растворе других солей изменяет
коэффициент активности данной соли и
тем сильнее, чем больше заряд добавляемых
ионов. Суммарное действие всех ионов
в растворе выражается через ионную
силу
раствора
 ,
,
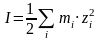
, (24)
где mi – концентрация i-ого иона; zi – заряд i-ого иона.
Для растворов сильных электролитов выполняется закон ионной силы: в растворах с одинаковой ионной силой средние коэффициенты активности ионов равны.
