
- •4.Константа электролитической диссоциации слабых электролитов. Закон разведения Оствальда.
- •5. Константа диссоциации воды. Ионное произведение воды. Водородный показатель рН.
- •6. Активность и коэффициент активности электролита. Средние ионные активности и коэффициенты активности. Средняя ионная моляльность, средний стехиометрический коэффициент.
- •7.Зависимость среднего ионного коэффнциента активности электролита от концентрации раствора и валентности ионов электролита. Ионная сила. Закон ионной силы.
- •8.Электролитическая теория сильных электролитов Дебая-Гюккеля, ионная атмосфера. Предельный закон Дебая-Гюккеля.
- •9.Удельная э/п р-ра,ее экс.Определение по сопротивл. Р-ра.Ед.Измер.В си.
- •12. Подвижность ионов.Ур-ние,связ. Подвижность(э/п)ионов при бескон.Разб.С пред.Эквив.Э/п р-ра(з-н Кольрауша).Опред.Степени дис.Слаб.Электрол.По э/п р-ра.
- •15.Кондуктометрия(кондукт.Титрование),опред.Растворимости и пр труднораствор.Соед,опред.РН р-ра.
- •16.Понятие о межфазной разности потенц.И строение двойного электр.Слоя на границе Ме-р-р.Нулевой р-р,потенц.Нулевого заряда.
- •17.Электр.Потенциал.Станд.Вод.Электрод.Зав-ть велич.Электр.Потенц.От прир.Электр.И от акт.Потенц.-опред.Ионов.Ур-ние Нернста.
- •18.Гальванический элемент. Процессы, протекающие на отрицательных и положительных электродах элемента. Правила записи гальванического элемента и электродных реакций.
- •31.Кинетика необратимых реакций третьего порядка
- •32.Кинетика Необратимые реакции n-ого порядка
- •34.Методы определения порядка реакции
- •37.Кинетика параллельных реакций первого порядка
- •1.Предмет электрохимии. Проводники первого и второго рода. Определение понятия электролит.
- •2.Основные положения теории электролитической диссоциации.Причины электролитической диссоциации электролитов при их растворении.
- •3.Сильные и слабые электролиты. Степень диссоциации, изотонический коэффициент.Уравнение связывающее степень диссоц. С изотон. Коэф.
- •46. Гетерогенный катализ
- •47.Мультиплетная теория гетерогенного катализа.
- •49.Цепные реакции.
15.Кондуктометрия(кондукт.Титрование),опред.Растворимости и пр труднораствор.Соед,опред.РН р-ра.
Кондуктометрия (от англ. conductivity — электропроводность и метрия) — совокупность электрохимических методов анализа, основанных на измерении электропроводности растворов.Кондуктометрия применяется для определения концентрации растворов солей, кислот, оснований.Кондуктометрический анализ основан на изменении концентрации вещества или химического состава среды в межэлектродном пространстве; он не связан с потенциалом электрода, который обычно близок к равновесному значению.Классификация кондуктометрических методов анализа: прямая кондуктометрия, низкочастотнаое титрование; высокочастотное титрование. Растворимостью электролита (S) называется его концентрация в насыщенном растворе (моль/л), а произведением растворимости (ПР) – произведение активностей катиона и аниона труднорастворимой соли.
Насыщенный
раствор труднорастворимой соли является
очень разбавленным раствором (α → 1
и λ → λ∞).
Тогда для такого раствора можно считать,
что эквивалентная электропроводность
численно равна λ∞. 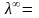 (
æ 1000) / C,
где
(
æ 1000) / C,
где
Найдя значение λ∞ по табличным данным, и измерив удельную электропроводность раствора, можно вычислить концентрацию насыщенного раствора (в моль-экв/л),C = (æ·1000) / λ∞,
Затем перейдя от нормальной концентрации С к молярной концентрации СM можно вычислить растворимость (S) соли.
Поскольку
удельная электропроводность растворов
труднорастворимых веществ (æр-ра)
часто соизмерима с электропроводностью
растворителя (воды) (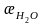 ),
то она определяется из выражения:
),
то она определяется из выражения:
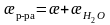 ,
bгде
æ –удельная
электропроводность соли
,
bгде
æ –удельная
электропроводность соли
Для
труднорастворимых солей активности
катиона и аниона практически совпадают
с их концентрациями,
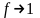 поэтому ПР =
поэтому ПР =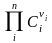
где i – стехиометрический коэффициент иона в уравнении диссоциации;
n – число видов ионов, на которые диссоциирует электролит;
Ci
– концентрация иона, связанная с
молярной концентрацией электролита
СМ
соотношением
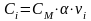 .
.
Так как = 1, то
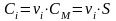 ,
,
и
произведение растворимости будет: 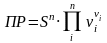 .
.
Так,
для труднорастворимого (бинарного)
одно–одновалентного электролита,
диссоцииирующего по схеме
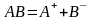
Получим
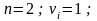
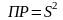 (моль/л)2.
(моль/л)2.
16.Понятие о межфазной разности потенц.И строение двойного электр.Слоя на границе Ме-р-р.Нулевой р-р,потенц.Нулевого заряда.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентировании полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.Механизм образования ДЭС:Двойной электрический слой возникает при контакте двух фаз, из которых хотя бы одна является жидкой. Стремление системы понизить поверхностную энергию приводит к тому, что частицы на поверхности раздела фаз ориентируются особым образом. Вследствие этого контактирующие фазы приобретают заряды противоположного знака, но равной величины, что приводит к образованию двойного электрического слоя. Можно выделить три механизма образования ДЭС:Переход ионов или электронов из одной фазы в другую (поверхностная ионизация). Примером может служить диссоциация поверхностных функциональных групп, принадлежащих одной из фаз (как правило, твердой). Для определения знака заряда поверхности используется правило Фаянса — Панета.Преимущественная адсорбция в межфазном слое ионов одного знака.Ориентирование полярных молекул в поверхностном слое. По этому механизму ДЭС образуется в случае, если вещества, составляющие фазы системы не могут обмениваться зарядами. Для определения знака заряда поверхности используют правило Кёна, гласящее, что из двух соприкасающихся фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость. ПОТЕНЦИАЛ НУЛЕВОГО ЗАРЯДА (ПНЗ), потенциал электрода, заряд пов-сти которого Q равен нулю. При этом величина Q определяется как кол-во электричества, которое необходимо сообщить электроду при увеличении площади его пов-сти на единицу для того, чтобы потенциал электрода Е оставался постоянным. Если все подводимое к электроду электричество затрачивается только на заряжение двойного электрического слоя. электрод наз. идеально поляризуемым. В этом случае величина Q оказывается тождественной плотности заряда металлич. обкладки двойного электрич. слоя. Примером может служить Hg-электрод в водном растворе Na2SO4 в интервале Е от 0,4 до —1,6В (нормальный водородный электрод).
