
- •4.Константа электролитической диссоциации слабых электролитов. Закон разведения Оствальда.
- •5. Константа диссоциации воды. Ионное произведение воды. Водородный показатель рН.
- •6. Активность и коэффициент активности электролита. Средние ионные активности и коэффициенты активности. Средняя ионная моляльность, средний стехиометрический коэффициент.
- •7.Зависимость среднего ионного коэффнциента активности электролита от концентрации раствора и валентности ионов электролита. Ионная сила. Закон ионной силы.
- •8.Электролитическая теория сильных электролитов Дебая-Гюккеля, ионная атмосфера. Предельный закон Дебая-Гюккеля.
- •9.Удельная э/п р-ра,ее экс.Определение по сопротивл. Р-ра.Ед.Измер.В си.
- •12. Подвижность ионов.Ур-ние,связ. Подвижность(э/п)ионов при бескон.Разб.С пред.Эквив.Э/п р-ра(з-н Кольрауша).Опред.Степени дис.Слаб.Электрол.По э/п р-ра.
- •15.Кондуктометрия(кондукт.Титрование),опред.Растворимости и пр труднораствор.Соед,опред.РН р-ра.
- •16.Понятие о межфазной разности потенц.И строение двойного электр.Слоя на границе Ме-р-р.Нулевой р-р,потенц.Нулевого заряда.
- •17.Электр.Потенциал.Станд.Вод.Электрод.Зав-ть велич.Электр.Потенц.От прир.Электр.И от акт.Потенц.-опред.Ионов.Ур-ние Нернста.
- •18.Гальванический элемент. Процессы, протекающие на отрицательных и положительных электродах элемента. Правила записи гальванического элемента и электродных реакций.
- •31.Кинетика необратимых реакций третьего порядка
- •32.Кинетика Необратимые реакции n-ого порядка
- •34.Методы определения порядка реакции
- •37.Кинетика параллельных реакций первого порядка
- •1.Предмет электрохимии. Проводники первого и второго рода. Определение понятия электролит.
- •2.Основные положения теории электролитической диссоциации.Причины электролитической диссоциации электролитов при их растворении.
- •3.Сильные и слабые электролиты. Степень диссоциации, изотонический коэффициент.Уравнение связывающее степень диссоц. С изотон. Коэф.
- •46. Гетерогенный катализ
- •47.Мультиплетная теория гетерогенного катализа.
- •49.Цепные реакции.
37.Кинетика параллельных реакций первого порядка
Параллельные реакции.
Параллельными называют реакции, в которых одни и те же исходные вещества реагируют одновременно в двух или более направлениях.
В простейшем случае это реакции типа
В
 А
А
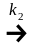 С.
С.
Обе реакции являются необратимыми реакциями первого порядка. Суммарная скорость расходования вещества А равна
 = w1
+ w2
= k1CA
+ k2CA
= (k1
+ k2)CA, (17)
= w1
+ w2
= k1CA
+ k2CA
= (k1
+ k2)CA, (17)
где w1 и w2 скорости превращения вещества А в вещества В и С, соответственно.
После интегрирования уравнения получаем
 .(1) (18)
.(1) (18)
По уравнению можно рассчитать сумму констант (k1 + k2). Чтобы разделить эту сумму на отдельные составляющие, необходимо использовать еще одно уравнение, дающее отношение констант в некоторый момент времени t. Очевидно, что в любой момент времени
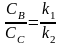 ,(2) (19)
,(2) (19)
где CB и CC текущие концентрации веществ В и С. Решая систему уравнений 1 и 2, можно найти значения констант скорости по отдельности.
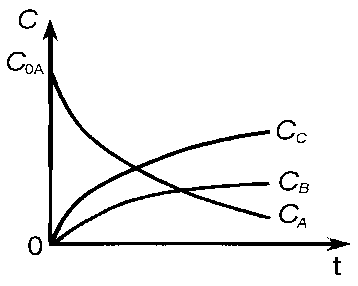
Кинетические кривые для рассматриваемого случая показаны на рис. 7.
25.Потенциометрия
— метод определения различных
физико-химических величин, основанный
на измерении электродвижущих сил (ЭДС)
обратимых гальванических
элементов.Потенциометрическое титрование
основано на определении точки
эквивалентности по результатам
потенциометрических измерений.Вблизи
точки эквивалентности происходит
резкое изменение (скачок) потенциала
индикаторного электрода.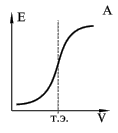 Для
потенциометрического титрования
собирают цепь из индикаторного электрода
в анализируемом растворе и электрода
сравнения. В качестве электродов
сравнения чаще всего применяют
каломельный или хлорсеребряный.Водородный
электрод, платиновая пластинка,
электролитически покрытая платиновой
чернью, погружённая в раствор кислоты
с определённой концентрацией ионов
водорода Н+ и омываемая током газообразного
водородаРt, Н2 / Н+.В основе теории
стеклянного электрода лежит представление
о том, что стекло - это ионообменник,
который может вступать в ионообменное
взаимодействие с раствором.Хингидронный
электрод, относящийся к классу
окислительно-восстановительных
электродов (см. ниже), представляет
собой платиновую проволоку, опущенную
в сосуд с исследуемым раствором, в
который предварительно помещают
избыточное количество хингидрона
С6Н4О2·С6Н4(ОН)2 – соединения хинона
С6Н4О2 и гидрохинона С6Н4(ОН)2, способных
к взаимопревращению в равновесном
окислительно-восстановительном
процессе, в котором участвуют ионы
водорода:С6Н4О2 + 2Н+ + 2е- ––> С6Н4(ОН)2
Для
потенциометрического титрования
собирают цепь из индикаторного электрода
в анализируемом растворе и электрода
сравнения. В качестве электродов
сравнения чаще всего применяют
каломельный или хлорсеребряный.Водородный
электрод, платиновая пластинка,
электролитически покрытая платиновой
чернью, погружённая в раствор кислоты
с определённой концентрацией ионов
водорода Н+ и омываемая током газообразного
водородаРt, Н2 / Н+.В основе теории
стеклянного электрода лежит представление
о том, что стекло - это ионообменник,
который может вступать в ионообменное
взаимодействие с раствором.Хингидронный
электрод, относящийся к классу
окислительно-восстановительных
электродов (см. ниже), представляет
собой платиновую проволоку, опущенную
в сосуд с исследуемым раствором, в
который предварительно помещают
избыточное количество хингидрона
С6Н4О2·С6Н4(ОН)2 – соединения хинона
С6Н4О2 и гидрохинона С6Н4(ОН)2, способных
к взаимопревращению в равновесном
окислительно-восстановительном
процессе, в котором участвуют ионы
водорода:С6Н4О2 + 2Н+ + 2е- ––> С6Н4(ОН)2
26. Предмет химической кинетики
Химическая кинетика - раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений. Для исследования химических процессов обычно применяют два метода: термодинамический и кинетический.Иногда термодинамически реакция возможна, но вместе с тем эта реакция протекает бесконечно медленно, и тогда с точки зрения практики можно сказать, что она невозможна. Поэтому необходимо изучать кинетику химических реакций. Химическая термодинамика не изучает скорости реакции, а для химической кинетики именно они являются предметом исследования.
27.Скоростью
реакции по данному веществу iназывается
изменение числа молей i-го вещества в
единице объема за единицу времени: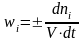 Согласно
основному
постулату химической кинетики
скорость реакции в каждый момент времени
пропорциональна произведению текущих
концентраций
реагирующих веществ, возведенных в
некоторую степень.
Согласно
основному
постулату химической кинетики
скорость реакции в каждый момент времени
пропорциональна произведению текущих
концентраций
реагирующих веществ, возведенных в
некоторую степень. где
n1
порядок реакции по веществу А,
где
n1
порядок реакции по веществу А,
n2 порядок реакции по веществу В,
k константа скорости реакции, не зависящая от концентрации реагирующих веществ.
Физический смысл константы скорости состоит в том, что она численно равна скорости химической реакции при единичных концентрациях всех реагирующих веществ (например, CA = CB = 1 моль/л).
Порядок реакции по веществу определяется как показатель степени n, в которой концентрация этого вещества входит в выражение для скорости реакции, полученное опытным путем.
Общий порядок реакции равен сумме порядков по веществам,
т.е. n = n1 + n2.Под молекулярностью реакции понимается число частиц, участвующих в элементарной стадии реакции.
В отличие от порядка реакции, это теоретическое понятие. Молекулярность реакции всегда целое число (1,2 или 3) (а порядок реакции может быть целым, дробным или даже отрицательным). Молекулярность больше 3 не встречается.
28. Для реакций нулевого порядка (n = 0) скорость реакции постоянна и не зависит от концентрации исходных веществ. Например, для реакцииАB
в
соответствии с основным постулатом
химической кинетики можно записать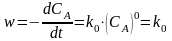 .
.
где СA текущая концентрация вещества А.
Разделим переменные в уравнении
dCA = k0dt,
и проинтегрируем
последнее уравнение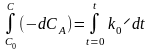 .
.
Здесь С0 начальная концентрация веществаА в начальный момент времени t = 0, С концентрация А в момент времени t (текущая концентрация А).
Результирующее уравнение, описывающее зависимость концентрации веществаА от времени, будет иметь вид:
С = С0 k0 t,
или
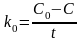 .
.
Единицы измерения k0 [концентрация·время‑1].
