
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Реакционная способность алкенов
Алкены – ненасыщеные углеводороды, содержащие одну двойную связь. Названия алкенов строятся от названий соответствующих алканов с изменением суффикса –ан на –ен (этен, пропен) и указанием положения двойной связи. Например,
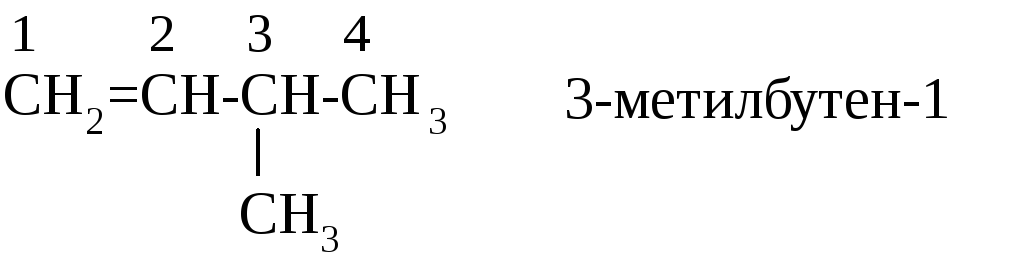
Рассмотрим электронное строение молекулы этена.
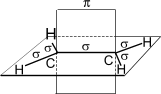
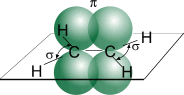
Атомы углерода в этене sp2-гибридизованы. С-С σ-связь образована за счёт осевого перекрывания гибридных орбиталей. C-H σ-связь образована за счёт осевого перекрывания гибридной орбитали углерода и s-орбитали водорода. σ-Связи расположены в одной плоскости под углом 120о. π-Связь образована за счёт бокового перекрывания негибридных pz-орбиталей в плоскости, перпендикулярной плоскости σ-связей. Длина C=C-связи 0,134 нм.
Для алкенов характерна структурная изомерия (по положению двойной связи, изомерия цепи), а также пространственная (геометрическая, или цис,транс-изомерия). Пространственные изомеры (стереоизомеры) имеют одинаковый состав, одинаковый порядок связывания атомов в молекулах, но различное расположение атомов или атомных групп в пространстве.
Например, бутен-2 существует в виде двух стереоизомеров:
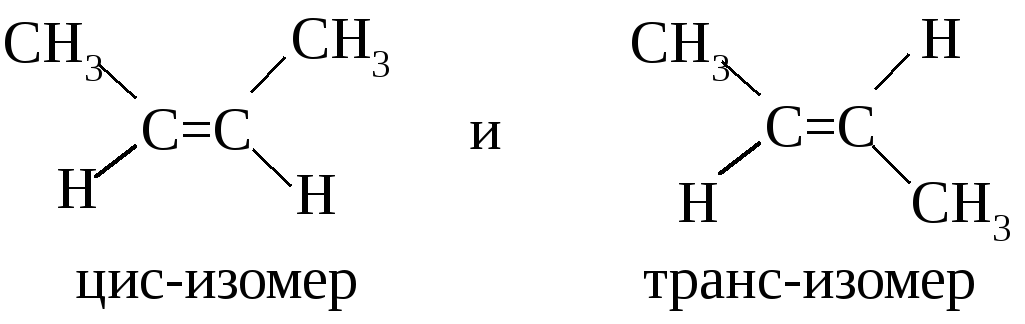
В цис-изомере метильные группы расположены по одну сторону от плоскости двойной связи, в транс-изомере – по разные. Цис- и транс-изомеры не могут превратиться друг в друга самопроизвольно, т.к. вращение вокруг двойной связи невозможно без разрыва π-связи.
Обратите внимание на то, что геометрическая изомерия возможна лишь в том случае, когда у углерода при двойной связи есть два различных заместителя. Так, например, бутен-1 не может существовать в виде геометрических изомеров.
Химические свойства алкенов
А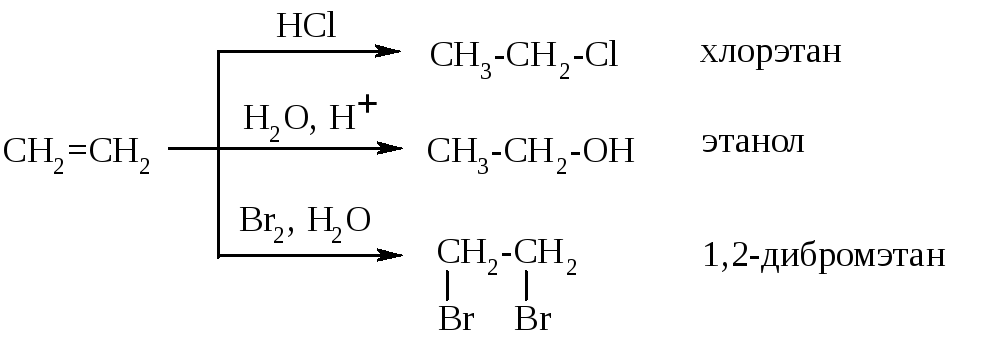 лкены
проявляют способность к реакциям
присоединения с разрывом π-связей, т.к.
π-связь не столь прочная, как σ-связь.
За счёт электронов π-связи в молекулах
алкенов имеется область повышенной
электронной плотности, следовательно,
они подвергаются атаке электрофильных
реагентов. Итак, для алкенов характерны
реакции электрофильного
присоединения (AE).
Примерами реакций являются гидрохлорирование,
гидратация, бромирование:
лкены
проявляют способность к реакциям
присоединения с разрывом π-связей, т.к.
π-связь не столь прочная, как σ-связь.
За счёт электронов π-связи в молекулах
алкенов имеется область повышенной
электронной плотности, следовательно,
они подвергаются атаке электрофильных
реагентов. Итак, для алкенов характерны
реакции электрофильного
присоединения (AE).
Примерами реакций являются гидрохлорирование,
гидратация, бромирование:
Общий механизм реакций электрофильного присоединения
Л![]() юбой
полярный реагент в принципе может быть
представлен как результат взаимодействия
электрофила
E+
и нуклеофила Nu-:
юбой
полярный реагент в принципе может быть
представлен как результат взаимодействия
электрофила
E+
и нуклеофила Nu-:
Н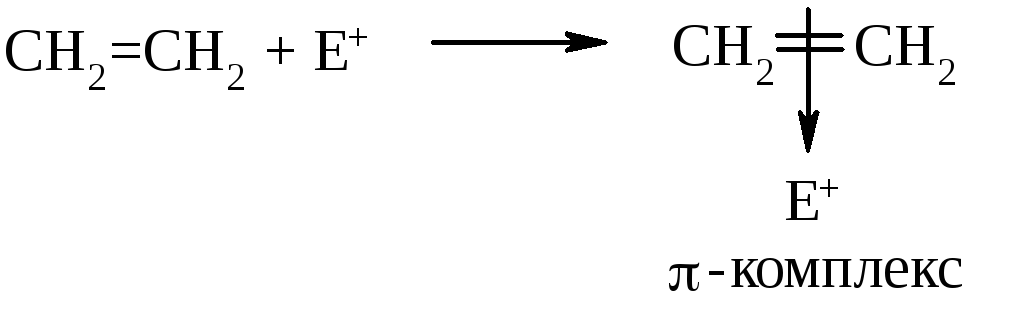 а
первой стадии реакции электрофил
подходит к электронному облаку π-связи
и они притягиваются друг к другу.
Образуется так называемый π-комплекс:
а
первой стадии реакции электрофил
подходит к электронному облаку π-связи
и они притягиваются друг к другу.
Образуется так называемый π-комплекс:
Затем электрофил образует новую σ-связь с одним из атомов углерода. Для этого он использует оба электрона бывшей π-связи. Образуется так называемый σ-комплекс, или карбкатион:
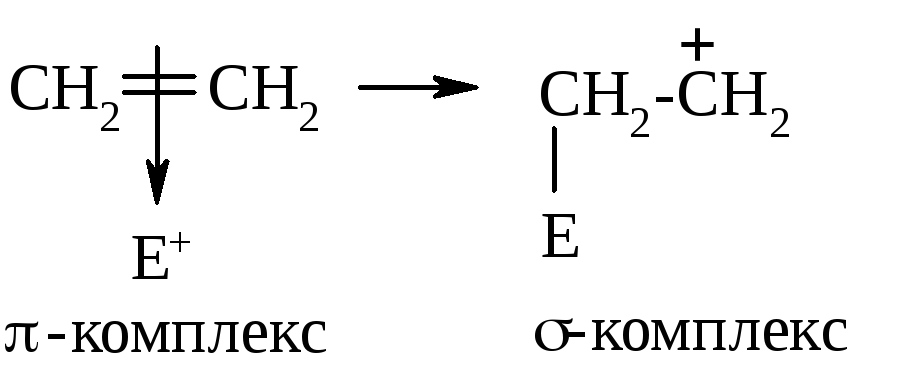
Так как электрофил использовал на образование новой связи электроны π-связи, соседний углерод приобретает полный положительный заряд.
σ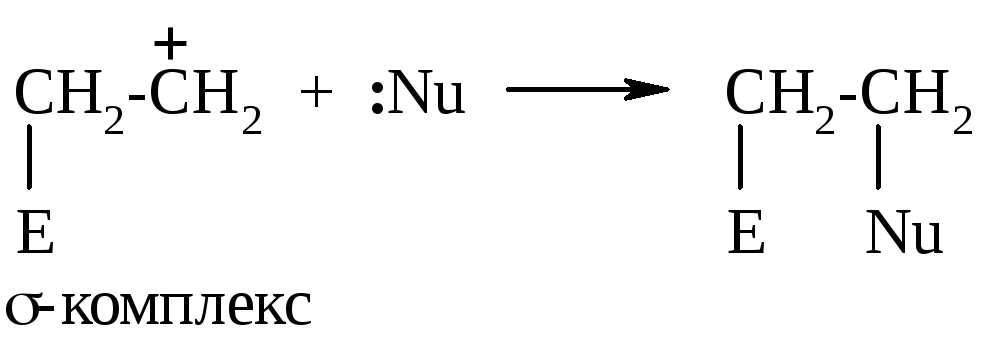 -Комплекс
затем реагирует с оставшимся нуклеофилом,
который предоставляет свои электроны
для образования новой связи:
-Комплекс
затем реагирует с оставшимся нуклеофилом,
который предоставляет свои электроны
для образования новой связи:
Стадия образования карбкатиона является самой медленной (старая π-связь должна разорваться, это требует затрат энергии). Скорость этой стадии определяет скорость реакции в целом. Её называют лимитирующей стадией реакции.
Теперь рассмотрим конкретные примеры реакций электрофильного присоединения.
Р еакция
гидрогалогенирования (гидрохлорирования,
гидробромирования).
Эта реакция
протекает полностью в соответствии с
общим механизмом AE:
еакция
гидрогалогенирования (гидрохлорирования,
гидробромирования).
Эта реакция
протекает полностью в соответствии с
общим механизмом AE:
В результате реакции образуются галогеналканы.
Реакция гидратации – присоединение воды. Эта реакция возможна только в присутствии сильных минеральных кислот (серной или фосфорной). Чтобы объяснить роль кислоты, необходимо рассмотреть механизм этой реакции.
Молекула воды – плохой источник электрофильных частиц (H+), т.к. степень её диссоциации очень низкая. Фактически роль электрофилов в реакции гидратации играют протоны, полученные не от молекул воды, а от молекул минеральной кислоты. Именно они и начинают реакцию.
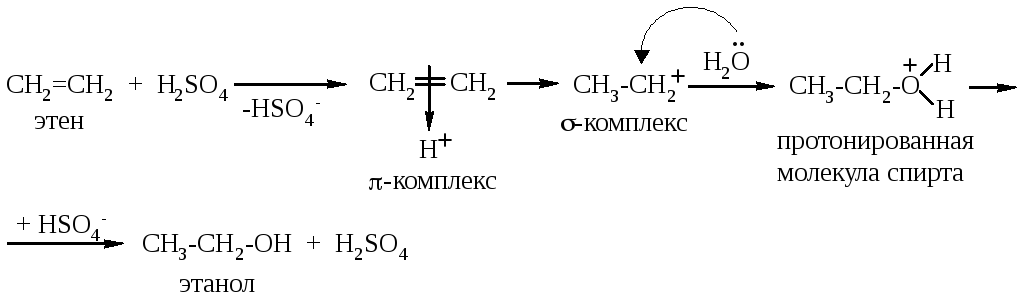
На первой стадии реакции протон кислоты образует π-комплекс с электронным облаком π-связи. Затем протон водорода присоединяется к одному из атомов углерода, при этом на соседнем атоме углерода возникает полный положительный заряд. Образуется σ-комплекс (карбкатион). Вы видите, что эти две стадии протекают в соответствии с общим механизмом реакций AE. А вот над следующей стадией этой реакции надо подумать: σ-комплекс должен прореагировать с нуклеофилом (см. общий механизм), а в реакционной среде есть два вида нуклеофилов – анионы кислоты HSO4- и нейтральные молекулы воды с неподелённой электронной парой на кислороде. В общем, анионы – более сильные нуклеофилы, но в этой реакции кислота используется в каталитических количествах (анионов мало), в то время как воду используют в избытке. Вот почему в этом «соревновании нуклеофилов» побеждают молекулы воды.
Итак, на следующей стадии реакции молекула воды как нуклеофил атакует карбкатион, и по донорно-акцепторному механизму образуется новая σ-связь. Так как атом кислорода затратил на образование новой связи два своих электрона (как донор), на нём образовался полный положительный заряд. Получилась протонированная молекула спирта – нестабильная заряженная частица. Для стабилизации ей необходимо отщепить протон, что и делает анион серной кислоты. В результате этой реакции образовались молекулы спирта и серной кислоты. То, что серная кислота в результате реакции не расходуется, подтверждает, что она является катализатором этой реакции. Итак, роль серной кислоты в реакции гидратации алкенов – это роль катализатора, источника электрофильных частиц (H+).
Р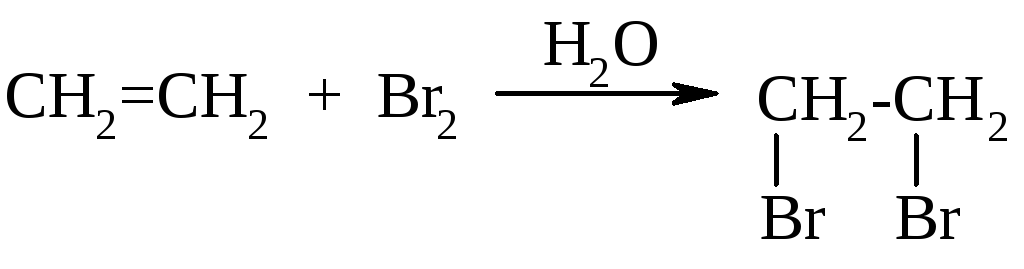 еакция
галогенирования (хлорирования,
бромирования).
Алкены в
обычных условиях легко присоединяют
галогены, например, в реакции бромирования
этена образуется 1,2-дибромэтан:
еакция
галогенирования (хлорирования,
бромирования).
Алкены в
обычных условиях легко присоединяют
галогены, например, в реакции бромирования
этена образуется 1,2-дибромэтан:
Эта реакция протекает с водным раствором брома, так называемой бромной водой. Под действием полярных молекул воды неполярная связь в молекуле брома поляризуется:
![]()
З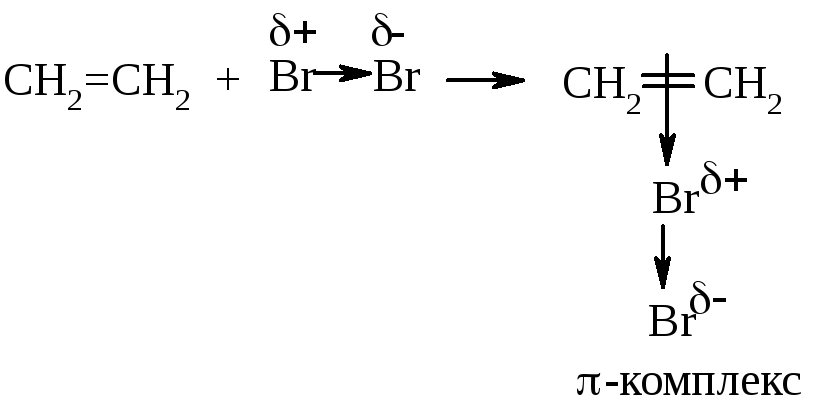 атем
эта поляризованная молекула брома
взаимодействует с π-электронным облаком
этена, образуя π-комплекс:
атем
эта поляризованная молекула брома
взаимодействует с π-электронным облаком
этена, образуя π-комплекс:
П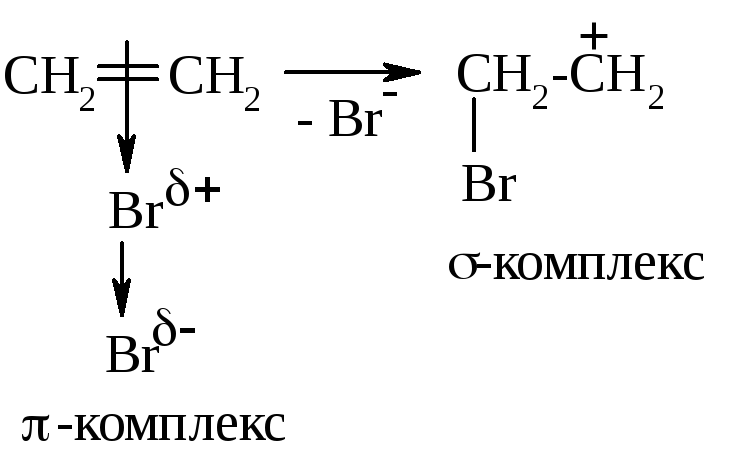 од
действием электронов π-облака происходит
ещё большая поляризация связи Br-Br,
она разрывается гетеролитически, и Br+
участвует в образовании σ-комплекса:
од
действием электронов π-облака происходит
ещё большая поляризация связи Br-Br,
она разрывается гетеролитически, и Br+
участвует в образовании σ-комплекса:
У положительно заряженного атома углерода σ-комплекса есть вакантная p-орбиталь, а у атома брома – неподелённая электронная пара. Они взаимодействуют по донорно-акцепторному механизму, образуется циклический катион бромония:
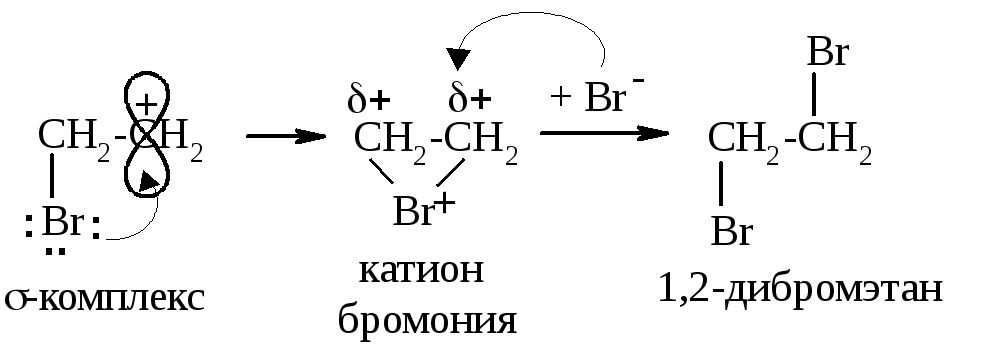
Катион бромония подвергается атаке нуклеофила (Br-), и образуется 1,2-дибромэтан. Поскольку подход Br- со стороны первого брома затруднён стерически, его атака происходит с противоположной стороны (так называемое транс-присоединение).
В случае образования 1,2-дибромэтана это не столь важно, т.к. конформеры свободно переходят друг в друга, но при присоединении к циклоалкенам нужно обращать внимание именно на транс-присоединение, например, при бромировании циклопентена образуется транс-1,2-дибромциклопентан:
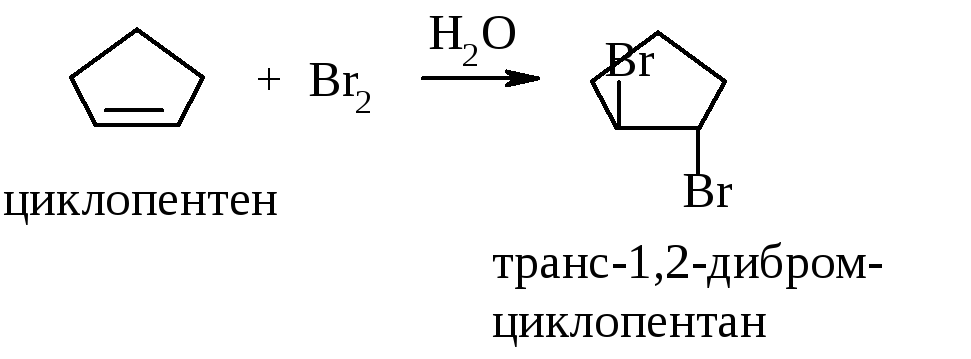
Реакцию бромирования используют как качественную реакцию на непредельность (на двойную и тройную связь). Качественными называют реакции, результат которых хорошо виден, например, выпадение или растворение осадка, изменение окраски, выделение пузырьков газа, появление характерного запаха. В реакции бромирования алкенов можно наблюдать обесцвечивание бромной воды (исчезновение оранжевой или жёлто-оранжевой окраски).
