
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
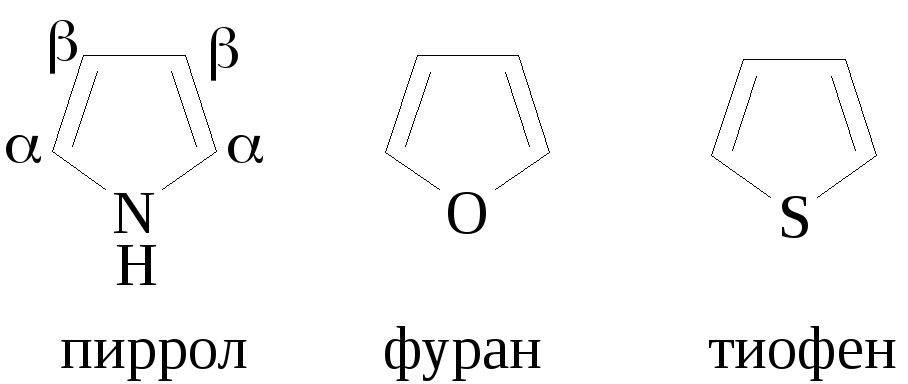
Пятичленные гетероциклы с одним гетероатомом
Представителями пятичленных гетероциклов с одним гетероатомом являются пиррол, фуран и тиофен:
В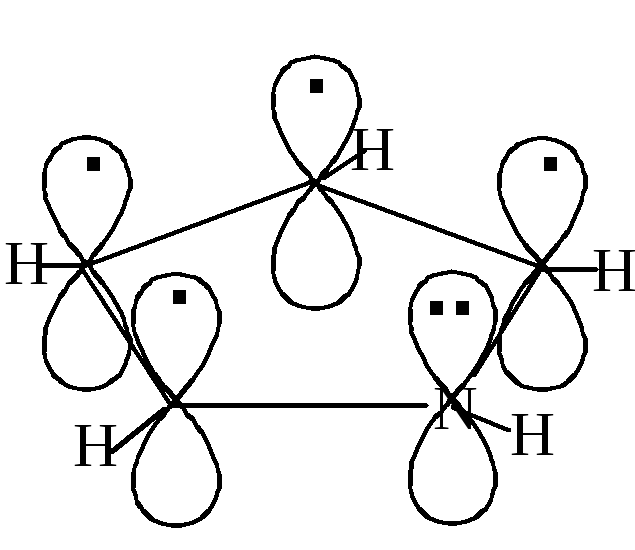 се
они являются ароматическими соединениями,
т.к. отвечают критериям ароматичности.
Все атомы цикла sp2-гибридизованы,
цикл плоский. Имеется замкнутая
p,π-сопряженная
система. Гетероатом отдает в сопряжение
неподеленную электронную пару, т.е.
4n+2=6;
n=1.
се
они являются ароматическими соединениями,
т.к. отвечают критериям ароматичности.
Все атомы цикла sp2-гибридизованы,
цикл плоский. Имеется замкнутая
p,π-сопряженная
система. Гетероатом отдает в сопряжение
неподеленную электронную пару, т.е.
4n+2=6;
n=1.
Пиррол, фуран и тиофен относят к π-избыточным гетероциклам, т.к. электронная плотность ароматического кольца повышена в сравнении с бензолом (шесть электронов ароматического облака делокализована между пятью атомами).
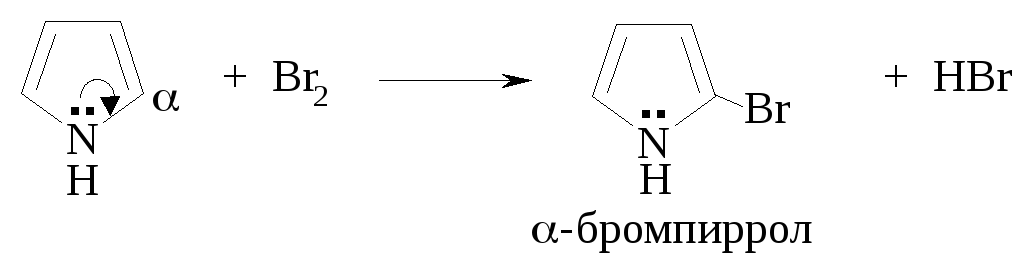
Как для всех ароматических соединений для пиррола, фурана и тиофена характерны реакции электрофильного замещения. Из-за π-избыточности циклов эти реакции протекают легче, чем в бензоле. Кроме того, в отличие от бензола электронная плотность в их молекулах распределена неравномерно, она наиболее высокая в α-положениях. Поэтому реакции SE протекают по α-положениям.
Например, реакцию бромирования пиррола проводят при комнатной температуре, без катализатора:
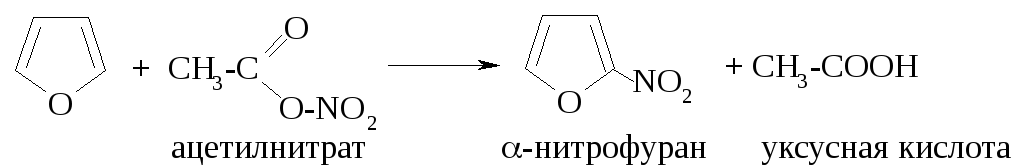
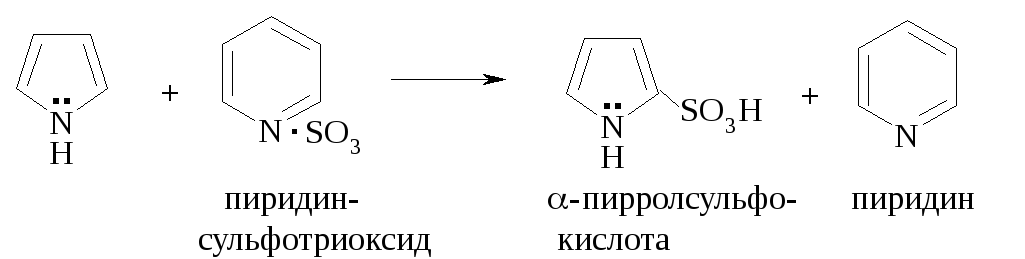
Реакции нитрования и сульфирования пиррола и фурана проводят в специальных условиях, что связано с ацидофобностью этих циклов. Ацидофобность в переводе с греческого – «боязнь кислот». При действии на ацидофобные гетероциклы концентрированных кислот происходит реакция полимеризации, и образуется смолоподобная масса (происходит осмоление). Рассмотрим причины ацидофобности на примере пиррола.
Неподеленная электронная пара азота, отвечающая за основные свойства, является частью ароматического облака, поэтому пиррол не проявляет основных свойств при взаимодействии с разбавленными кислотами. Протоны концентрированных минеральных кислот «вырывают» пару электронов атома азота из сопряжения, тем самым нарушая ароматичность. Полученный продукт подвергается полимеризации:
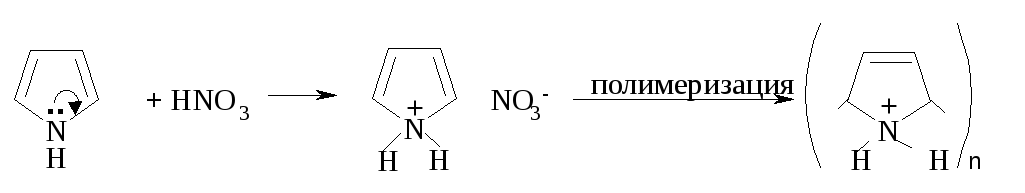
Для нитрования и сульфирования пиррола и фурана необходимо использовать реагенты, не проявляющие сильных кислотных свойств: ацетилнитрат и пиридинсульфотриоксид.
Свойства пиррола и его производных
Пиррол проявляет крайне слабые основные свойства при взаимодействии с концентрированными минеральными кислотами (см. ацидофобность пиррола). За счёт полярности NH-связи проявляются слабые кислотные свойства. Пиррол образует соли при взаимодействии с щелочными металлами или их амидами:
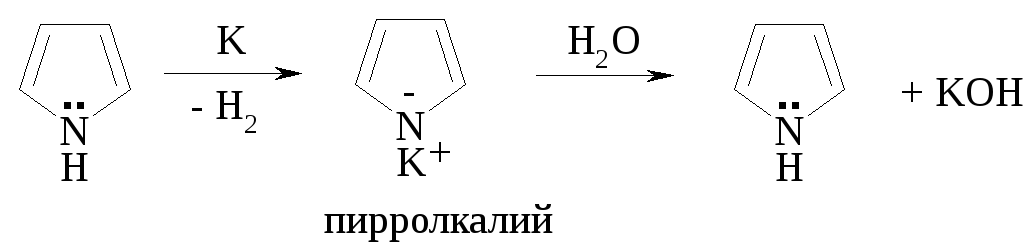
Даже вода, являясь более сильной кислотой, чем пиррол, вытесняет его из солей.
Реакции восстановления (гидрирования) пиррола протекают в довольно жёстких условиях, ступенчато:
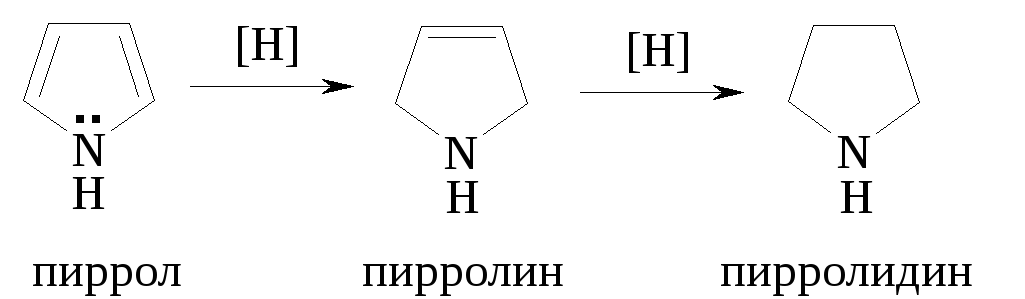
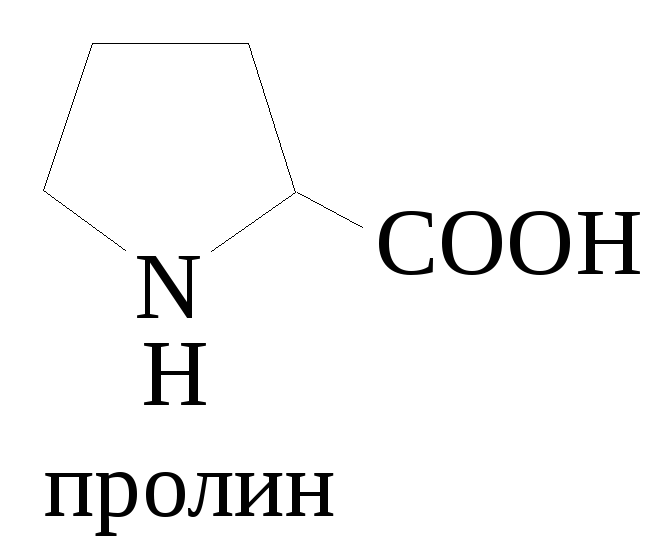
П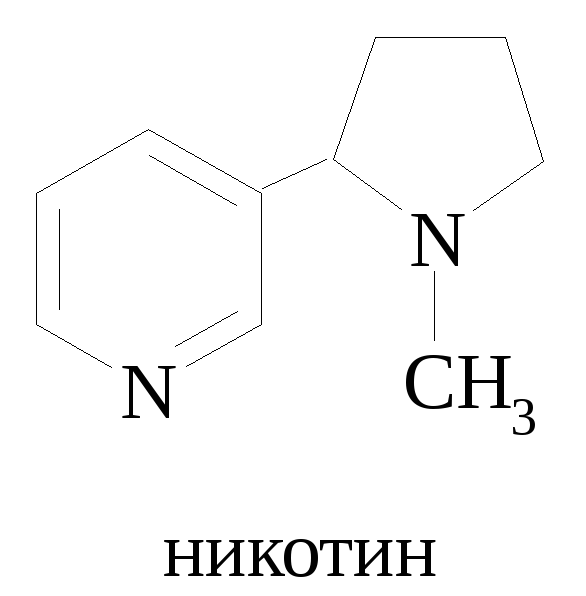 ирролидин
– сильное основание (как вторичный
алифатический амин). Ядро пирролидина
входит в структуру алкалоида никотина,
аминокислоты пролина:
ирролидин
– сильное основание (как вторичный
алифатический амин). Ядро пирролидина
входит в структуру алкалоида никотина,
аминокислоты пролина:
В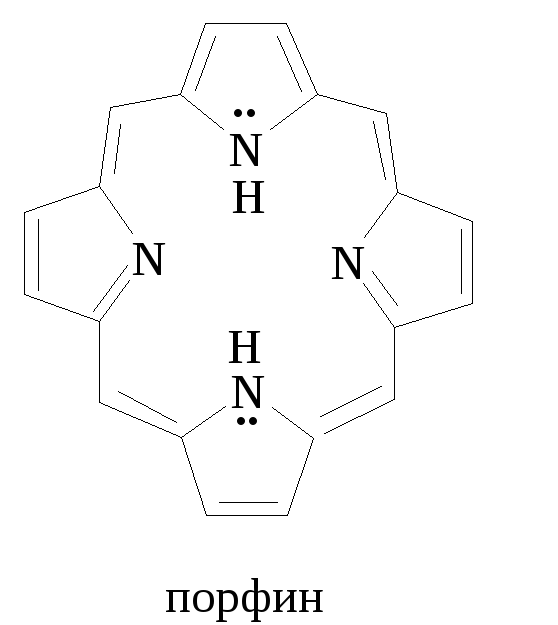 ажную
группу азотсодержащих природных веществ
составляют так называемые тетрапиррольные
соединения, т.е. соединения, в структуру
которых входят четыре пиррольных кольца.
К тетрапиррольным соединениям относится
порфин, производными которого являются
такие биологически важные соединения
как хлорофилл, гем, цитохром. Порфин
является устойчивой ароматической
системой (энергия сопряжения – 840
кДж/моль). В замкнутой p,π-сопряженной
системе делокализовано 26 электронов.
ажную
группу азотсодержащих природных веществ
составляют так называемые тетрапиррольные
соединения, т.е. соединения, в структуру
которых входят четыре пиррольных кольца.
К тетрапиррольным соединениям относится
порфин, производными которого являются
такие биологически важные соединения
как хлорофилл, гем, цитохром. Порфин
является устойчивой ароматической
системой (энергия сопряжения – 840
кДж/моль). В замкнутой p,π-сопряженной
системе делокализовано 26 электронов.
П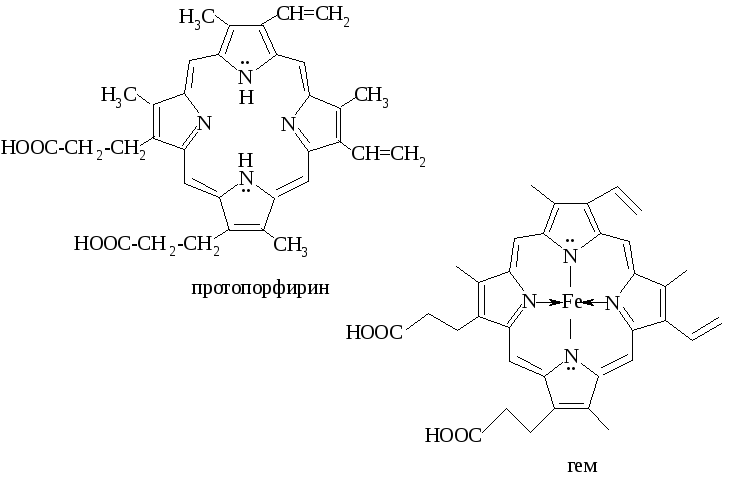 орфины,
имеющие заместители в пиррольных циклах,
называются порфиринами. Заместители
могут содержать кратные связи, способные
вступать в сопряжение с ароматическим
облаком, что еще более стабилизирует
молекулу. Пример порфирина –
протопорфирин, входящий в структуру
гемоглобина крови.
орфины,
имеющие заместители в пиррольных циклах,
называются порфиринами. Заместители
могут содержать кратные связи, способные
вступать в сопряжение с ароматическим
облаком, что еще более стабилизирует
молекулу. Пример порфирина –
протопорфирин, входящий в структуру
гемоглобина крови.
Порфирины находятся в природе в виде комплексов с металлами. Комплекс порфирина с железом – гем – небелковая часть молекулы гемоглобина и цитохромов. Комплекс с магнием является основой молекулы хлорофилла.
П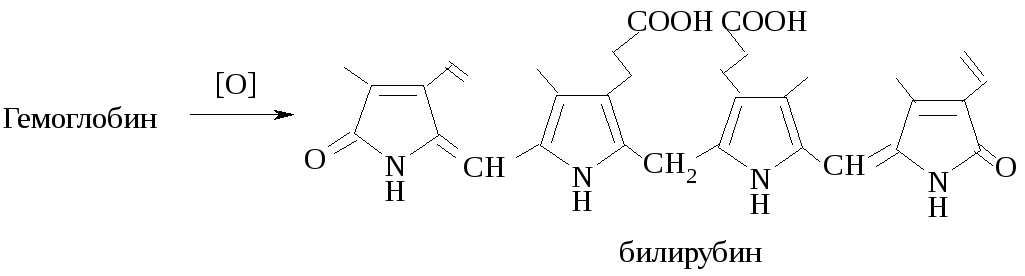 ри
биологическом окислении гемоглобина
образуются окрашенные вещества с
линейной тетрапиррольной структурой
– билирубиноиды, например, билирубин,
имеющий оранжевую окраску.
ри
биологическом окислении гемоглобина
образуются окрашенные вещества с
линейной тетрапиррольной структурой
– билирубиноиды, например, билирубин,
имеющий оранжевую окраску.
И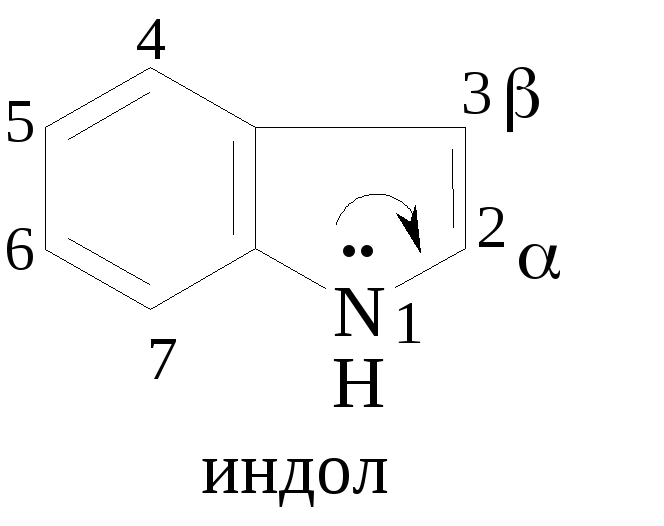 ндол
(бензопиррол) – конденсированное
гетероциклическое соединение. В его
молекуле сконденсированы бензольное
и пиррольное кольца. Индол ароматичен.
В его p,π-сопряженной
системе делокализовано 10 электронов.
ндол
(бензопиррол) – конденсированное
гетероциклическое соединение. В его
молекуле сконденсированы бензольное
и пиррольное кольца. Индол ароматичен.
В его p,π-сопряженной
системе делокализовано 10 электронов.
П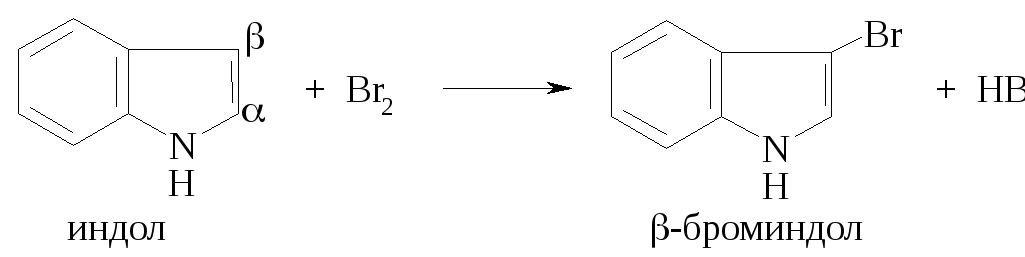 о
свойствам индол подобен пирролу. Его
основные свойства практически не
проявляются, он ацидофобен, обладает
слабыми NH-кислотными
свойствами. Индол вступает в реакции
электрофильного замещения легче, чем
бензол. Реакции SE
протекают по β-положению пиррольного
кольца:
о
свойствам индол подобен пирролу. Его
основные свойства практически не
проявляются, он ацидофобен, обладает
слабыми NH-кислотными
свойствами. Индол вступает в реакции
электрофильного замещения легче, чем
бензол. Реакции SE
протекают по β-положению пиррольного
кольца:
Наиболее важными биологически активными производными индола являются α-аминокислота триптофан и продукты его метаболических превращений.
Т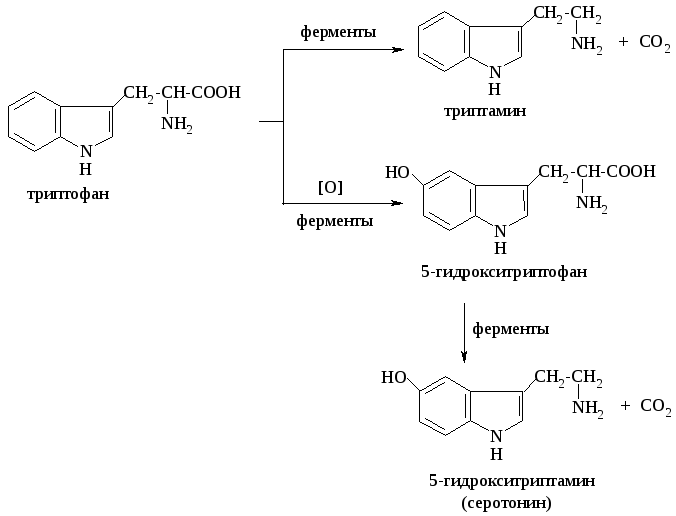 риптофан
входит в структуру белков. В организме
он подвергается метаболическим
превращениям по двум направлениям:
неокислительное и окислительное
декарбоксилирование:
риптофан
входит в структуру белков. В организме
он подвергается метаболическим
превращениям по двум направлениям:
неокислительное и окислительное
декарбоксилирование:
В результате неокислительного декарбоксилирования образуется токсичный биогенный амин триптамин, который затем подвергается дальнейшему превращению в β-индолилуксусную кислоту.
При окислительном декарбоксилировании вначале образуется 5-гидрокситриптофан, который затем декарбоксилируется в 5-гидрокситриптамин (серотонин). Серотонин является одним из нейромедиаторов головного мозга. Нарушение его нормального обмена в организме может привести к шизофрении. В норме серотонин окисляется в (5-гидрокси-β-индолил)уксусную кислоту и выводится с мочой.
Д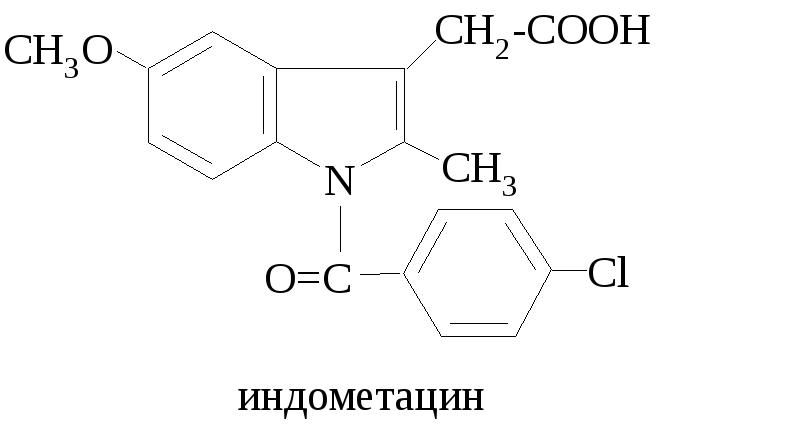 ругим
важным производным индола является
нестероидный противовоспалительный
препарат индометацин.
ругим
важным производным индола является
нестероидный противовоспалительный
препарат индометацин.
