
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Медико-биологическое значение гетерофункциональных производных карбоновых кислот
Молочная кислота широко распространена в природе как продукт молочнокислого брожения углеводов (см. стр. 173). В организме она является одним из продуктов превращения глюкозы (гликолиза). Молочная кислота накапливается в мышцах при интенсивной работе, вследствие чего в них возникает характерная боль.
Некоторые соли молочной кислоты (лактаты) применяются в медицине. Лактат железа (II) назначают при гипохромных анемиях. Он легче, чем неорганические соединения железа всасывается из ЖКТ, не вызывает раздражения слизистых оболочек. Лактат кальция является источником ионов кальция, которые необходимы для осуществления процесса передачи нервных импульсов, формирования костной ткани, процессов свертывания крови. Применяется также как антиаллергическое средство. Лактат кальция переносится лучше, чем хлорид кальция, т.к. не раздражает слизистую оболочку.
β-Гидроксимасляная кислота накапливается в организме больных сахарным диабетом, являясь предшественницей ацетоуксусной кислоты, относится к «кетоновым телам».
Натриевая соль γ-гидроксимасляной кислоты (натрия оксибутират) применяется как снотворное средство, а также в анестезиологии в качестве средства для неингаляционного наркоза.
γ-Аминомасляная кислота (ГАМК) принимает участие в обменных процессах головного мозга, является нейромедиатором. В медицинской практике применяется под названиями гаммалон, аминалон при лечении нервно-психических заболеваний. В медицине применяются и производные лактама γ-аминомасляной кислоты (пирролидона). Поливинилпирролидон используют как заменитель плазмы крови, амид (1-пирролидон-2-ил)-уксусной кислоты (пирацетам, ноотропил) применяют при нарушениях обменных процессов и кровообращения мозга.
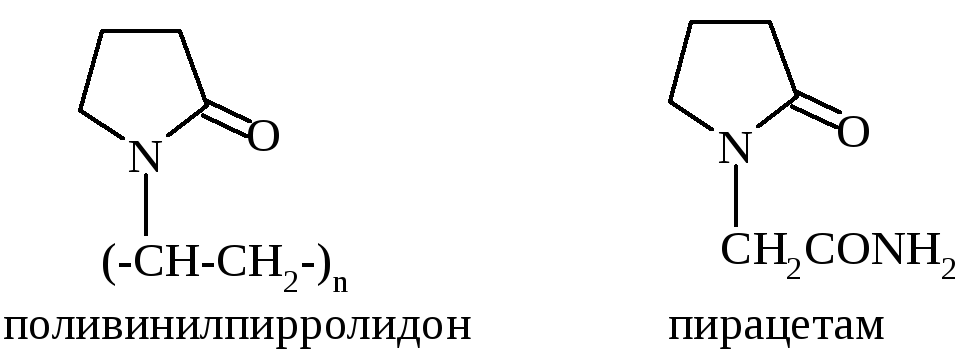
ε-Аминокапроновая кислота оказывает кровоостанавливающее действие.
Яблочная и лимонная кислоты принимают участие в цикле Кребса – универсальном этапе окислительного катаболизма углеводов, липидов и других соединений в присутствии кислорода. Соли лимонной кислоты (цитраты) применяются в медицине. Например, цитрат натрия препятствует свертыванию крови.
Соли винной кислоты (тартраты) используются как мягкие слабительные средства.
Ацетоуксусный эфир широко применяется в органическом синтезе как исходное вещество для получения кетонов, карбоновых кислот, производных гетероциклов, представляющих интерес в качестве лекарственных средств.
Оптическая изомерия
Оптическая изомерия – один из видов пространственной или стереоизомерии.
Стереоизомеры – соединения, молекулы которых имеют одинаковое химическое, но различное пространственное строение. Пространственное строение взаимосвязано не только с физическими и химическими свойствами веществ, но и с их биологической активностью. Название «оптическая» данный вид стереоизомерии получил оттого, что стереоизомеры могут обладать оптической активностью. Другое название оптической изоме- рии – «зеркальная», т.к. изомеры похожи как предмет и его зеркальное отображение.
Оптическая активность – способность вещества отклонять плоскость поляризации поляризованного луча света.
К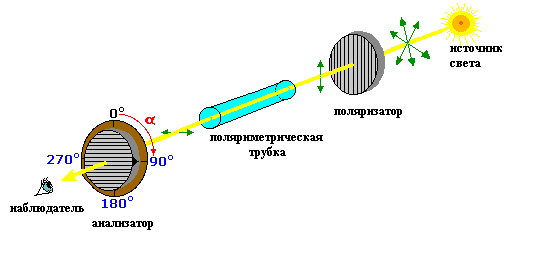 олебания
вектора электрического поля обычного
луча света происходят в разных плоскостях
(рис. 1а). После прохождения через
специальную призму-поляризатор луч
становится плоскополяризованным, т.е.
вектор электрического поля колеблется
только в одной плоскости, перпендикулярной
направлению распространения луча (рис.
1б). Эта плоскость и называется плоскостью
поляризации света. При прохождении
поляризованного луча света через раствор
оптически активного соединения происходит
отклонение плоскости поляризации света
на определенный угол по часовой стрелке
(тогда вещество называется правовращающим,
обозначается «+») или против часовой
стрелки (левовращающим, обозначается
«-»). Оптическую активность можно
определить с помощью прибора –
поляриметра. Схематично принцип работы
поляриметра можно описать следующим
образом (рис. 2):
олебания
вектора электрического поля обычного
луча света происходят в разных плоскостях
(рис. 1а). После прохождения через
специальную призму-поляризатор луч
становится плоскополяризованным, т.е.
вектор электрического поля колеблется
только в одной плоскости, перпендикулярной
направлению распространения луча (рис.
1б). Эта плоскость и называется плоскостью
поляризации света. При прохождении
поляризованного луча света через раствор
оптически активного соединения происходит
отклонение плоскости поляризации света
на определенный угол по часовой стрелке
(тогда вещество называется правовращающим,
обозначается «+») или против часовой
стрелки (левовращающим, обозначается
«-»). Оптическую активность можно
определить с помощью прибора –
поляриметра. Схематично принцип работы
поляриметра можно описать следующим
образом (рис. 2):

Рис. 2. Схема строения поляриметра.
Поляриметр состоит из двух призм, между которыми помещается трубка с раствором исследуемого вещества. Первая призма – поляризатор поляризует луч, исходящий из источника света. Вторая призма – анализатор пропускает плоскополяризованный луч, выходящий из поляриметрической трубки. Если вещество оптически неактивно, то при одинаковой ориентации двух призм свет через анализатор проходит полностью. Если же при выходе из поляриметрической трубки плоскость поляризации света изменилась, то для полного прохождения такого луча света нужно повернуть анализатор на определенный угол (α), который и соответствует углу вращения плоскости поляризации света оптически активным веществом.
Оптической активностью обладают только хиральные молекулы. Хиральность – это свойство объекта (не обязательно молекулы!) не совмещаться со своим зеркальным отображением. Любой симметричный объект совместится со своим отражением в зеркале. Значит, хиральность – это несимметричность. Сам термин «хиральность» произошел от греческого слова «рука», так как наши руки являются примером хиральных объектов. Они похожи как в зеркале, но их невозможно совместить, не вынося из плоскости. Наглядным примером их несовместимости служит невозможность надеть на правую руку левую перчатку, соответствующую пространственному строению левой руки.
Чтобы установить, является ли молекула хиральной, необходимо построить её модель и модель её зеркального отображения и попытаться их совместить. Если это удается – молекула ахиральна, не удается – хиральна. Есть и другой прием: признаком хиральности является наличие в молекуле асимметрического атома углерода. Асимметрическим называют атом углерода, связанный с четырьмя различными заместителями. Обратите внимание: этот признак является необходимым, но не всегда достаточным для проявления оптической активности! Молекула в целом должна быть асимметричной.
Рассмотрим стереоизомерию на примере молочной кислоты.
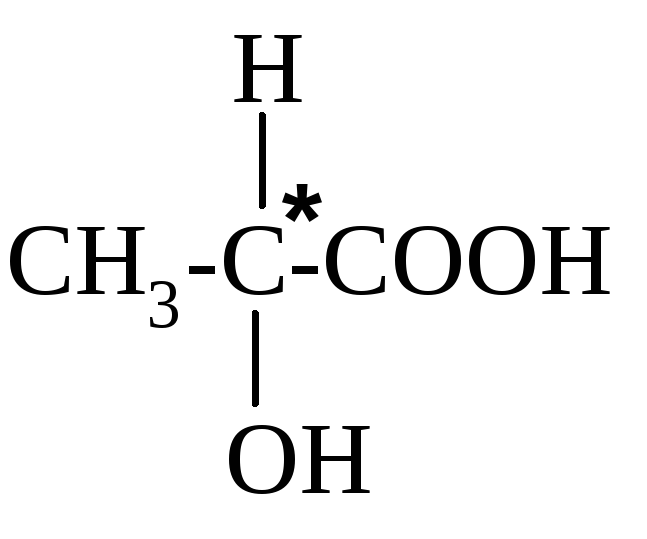 В
молекуле молочной кислоты один
асимметрический атом углерода
(обозначается звездочкой). По формуле
N=2
n,
где n
– число асимметрических атомов углерода,
рассчитываем количество стереоизомеров:
21=2.
Эти стереоизомеры похожи как предмет
и его зеркальное отражение:
В
молекуле молочной кислоты один
асимметрический атом углерода
(обозначается звездочкой). По формуле
N=2
n,
где n
– число асимметрических атомов углерода,
рассчитываем количество стереоизомеров:
21=2.
Эти стереоизомеры похожи как предмет
и его зеркальное отражение:
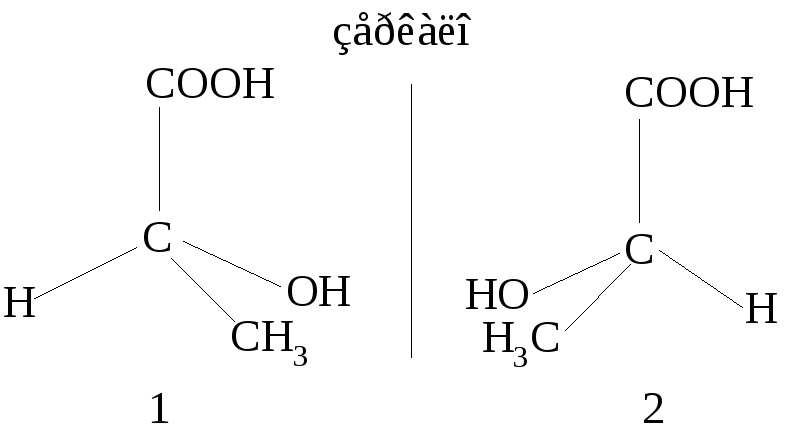
Стереоизомеры, похожие как предмет и несовместимое с ним зеркальное отражение, называются энантиомерами (1 и 2).
Для изображения структур стереоизомеров на плоскости пользуются проекционными формулами Фишера. При их построении пользуются определенными правилами. Углеродную цепь располагают вертикально таким образом, чтобы вверху оказалась старшая группа (в нашем примере – карбоксильная группа). Хиральный атом углерода находится на перекрестье вертикальной и горизонтальной линий и символом не обозначается. Внизу на вертикальной линии обозначается углеродсодержащий заместитель (CH3-группа). На горизонтальной линии располагают оставшиеся группы (в нашем примере – водород и гидроксильная группа). Расположенные на горизонтали заместители должны быть направлены к наблюдателю, а на вертикали – от наблюдателя, т.е. находятся за плоскостью бумаги:
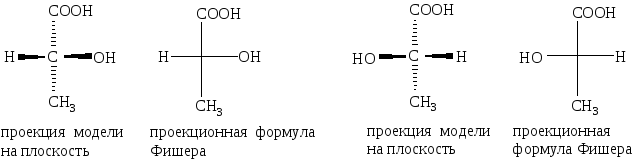
Энантиомеры обладают одинаковыми химическими и физическими свойствами (температура кипения, температура плавления, плотность, показатель преломления и т.д.). Они проявляют одинаковую реакционную способность по отношению к ахиральным реагентам.
Энантиомеры отличаются следующими свойствами:
1. Они отклоняют плоскость поляризации поляризованного луча на одинаковый угол, но в противоположных направлениях, т.е. один из них является правовращающим (+), а другой - левовращающим (-).
2. Они с разной скоростью реагируют с другими хиральными молекулами. А так как ферменты являются хиральными молекулами, то они будут взаимодействовать только с одним из стереоизомеров. Отсюда различная биологическая активность энантиомеров.
Предсказать направление и величину угла вращения поляризованного луча света для данного стереоизомера нельзя! Оптическая активность определяется только опытным путем с помощью поляриметра. Но если определена оптическая активность одного из энантиомеров (например, -20о ), то оптическую активность второго энантиомера можно не определять, она будет равна +20о.
Определение абсолютной конфигурации, т.е. действительного расположения заместителей вокруг хирального центра, стало возможным только с появлением метода рентгеноструктурного анализа. До этого конфигурации стереоизомеров сравнивали с конфигурацией эталонных (ключевых) соединений, т.е. определяли относительную конфигурацию. В 1906 г. по предложению М.А. Розанова за конфигурационный стандарт был принят глицериновый альдегид.
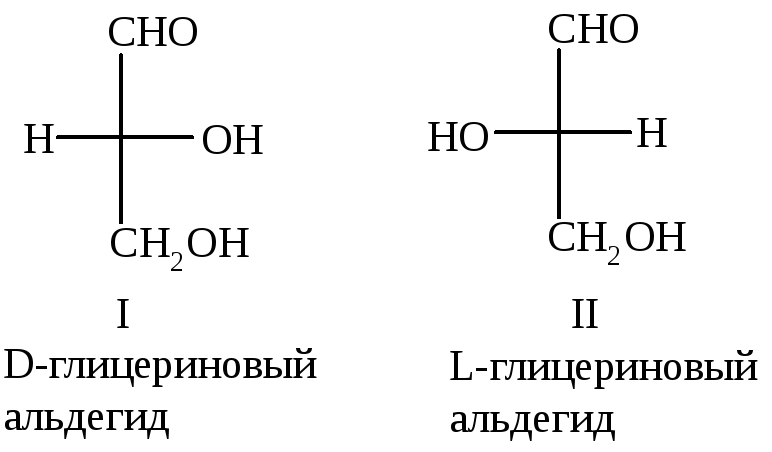 Стереоизомерам
глицеринового альдегида были
предписаны определенные конфигурации,
которые обозначили как D-
и L-.
Поэтому стереоизомеры, имеющие
конфигурацию как D-глицериновый
альдегид, относят к D-стереохимическому
ряду, а имеющие конфигурацию как
L-глицериновый
альдегид – к L-стереохимическому
ряду, например:
Стереоизомерам
глицеринового альдегида были
предписаны определенные конфигурации,
которые обозначили как D-
и L-.
Поэтому стереоизомеры, имеющие
конфигурацию как D-глицериновый
альдегид, относят к D-стереохимическому
ряду, а имеющие конфигурацию как
L-глицериновый
альдегид – к L-стереохимическому
ряду, например:
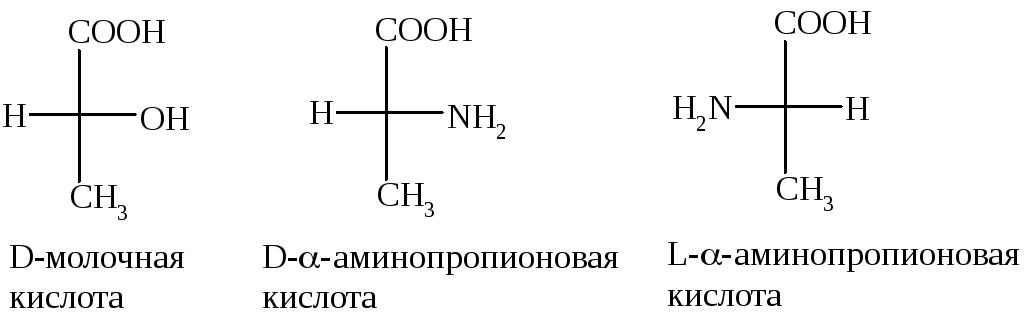
Правильность произвольно приписанной D-глицериновому альдегиду конфигурации в дальнейшем была подтверждена экспериментально и приобрела силу абсолютной конфигурации. Это значит, что можно продолжать сравнивать конфигурации данного изомера с конфигурациями D- и L-глицеринового альдегида.
Сравнение конфигурации исследуемого соединения с глицериновым альдегидом проводят путем серии химических превращений, не затрагивающих центр хиральности. Например, (-)-молочную кислоту можно получить из D-(+)-глицеринового альдегида. Значит, конфигурация хирального атома углерода у неё будет одинаковой с исходным альдегидом, т.е. полученная (-)-молочная кислота будет принадлежать к D-стереохимическому ряду.
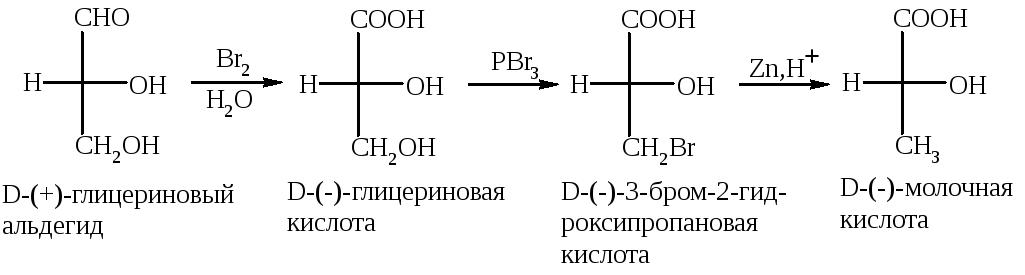
Знак вращения (+ или -) не имеет связи с конфигурацией (D- или L-). Например, D-глицериновый альдегид является правовращающим стереоизомером, а D-молочная кислота – левовращающим.
Смесь равных количеств энантиомеров называется рацемической смесью. Рацемическая смесь не обладает оптической активностью. Существуют методы, позволяющие разделить рацемическую смесь на оптически активные энантиомеры.
