
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Реакции α-аминокислот in vivo
Аминокислоты не накапливаются в клетке: как правило, их избыток разрушается при помощи реакций, которые снабжают живую систему энергией. Аминокислоты принимают участие в метаболических процессах, в результате которых в клетке синтезируются необходимые ей соединения. Основные реакции, за счет которых осуществляется превращение аминокислот в клетке, – это декарбоксилирование, дезаминирование, переаминирование. Эти реакции катализируются соответствующими ферментами.
В результате реакций декарбоксилирования образуются биогенные амины.
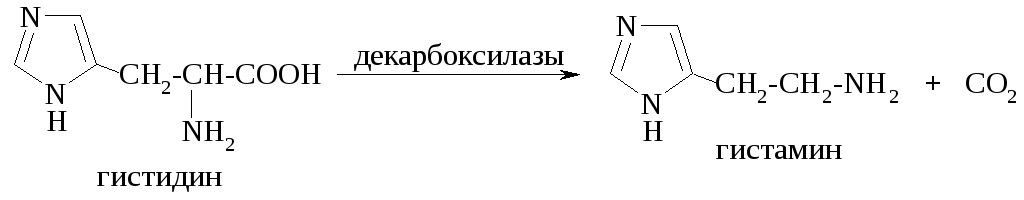
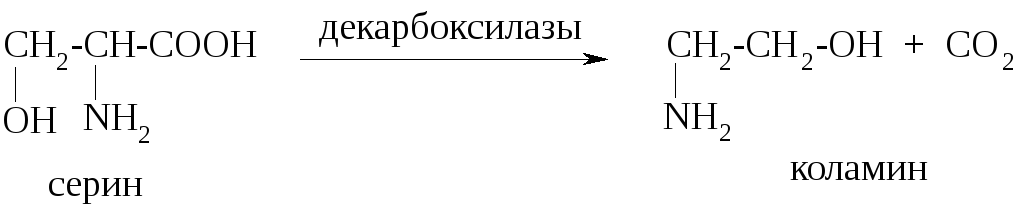
Реакции дезаминирования могут осуществляться как по окислительному, так и по неокислительному пути.
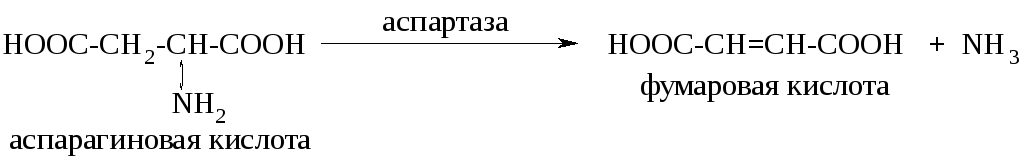
Неокислительное дезаминирование встречается в основном у растений и грибов. Так, например, с участием фермента аспартазы протекает дезаминирование аспарагиновой кислоты с образованием транс-бутендиовой (фумаровой) кислоты:
Окислительное дезаминирование осуществляется через образование промежуточной иминокислоты, которая затем подвергается гидролизу:
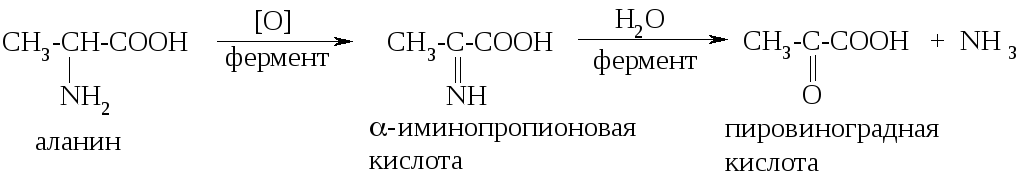
Переаминирование α-аминокислот сводится к взаимопревращению их аминогрупп и карбонильных групп α-кетокислот под действием ферментов трансаминаз (аминотрансфераз). Это основной путь биосинтеза α-аминокислот из α-кетокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетке в достаточном количестве, а ее акцептором – кетокислота. Например, таким образом, из аспарагиновой кислоты в клетке может быть синтезирован аланин или глютаминовая кислота:
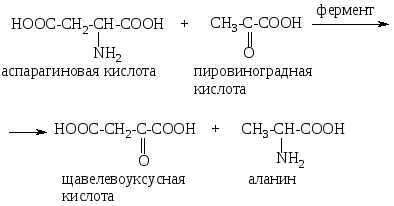

Реакция переаминирования является связующим звеном между процессами метаболизма белков (аминокислоты) и углеводов (кетокислоты).
ПЕПТИДЫ И БЕЛКИ
Пептиды и белки – соединения, построенные из остатков α-аминокислот. Деление между ними условное: принято считать, что пептиды построены из остатков менее 100 аминокислот, белки – более 100 аминокислот.
Можно рассматривать полипептидную цепь как продукт поликонденсации α-аминокислот, а пептидную связь – как амидную, т.е. пептиды и белки являются полиамидами. Схематично образование трипептида можно показать следующим образом:
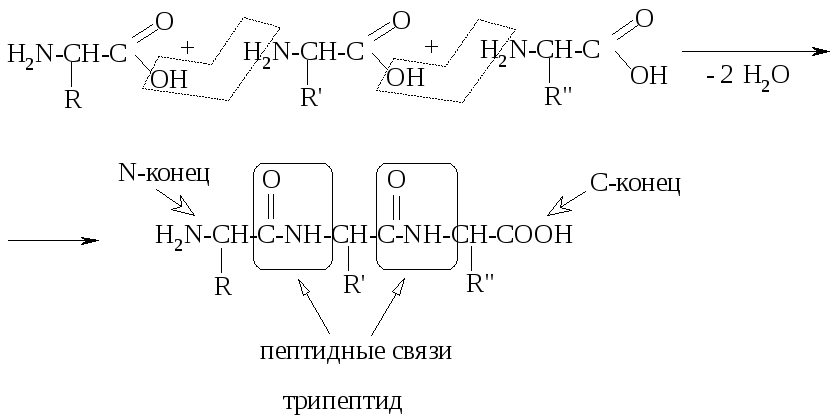
Пептидная цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) групп и CH-групп с соответствующими радикалами. Принято записывать структуру пептида, начиная со свободной аминогруппы (N-конца молекулы) и заканчивая свободной карбоксильной группой (C-конец).
Н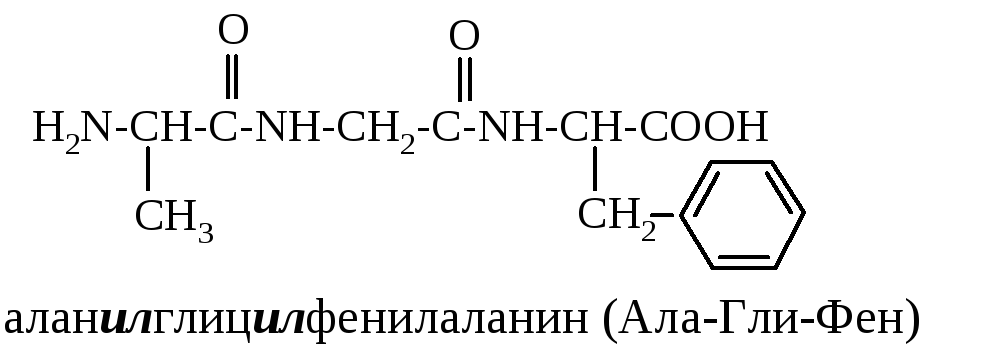 азвания
пептидов строятся путем последовательного
перечисления аминокислотных остатков,
начиная с N-конца.
Названия аминокислот, вступивших в
образование пептидной связи своей
карбоксильной группой, заканчиваются
суффиксом «-ил»,
например:
азвания
пептидов строятся путем последовательного
перечисления аминокислотных остатков,
начиная с N-конца.
Названия аминокислот, вступивших в
образование пептидной связи своей
карбоксильной группой, заканчиваются
суффиксом «-ил»,
например:
Амидная связь между двумя α-аминокислотными остатками называется пептидной связью. Атомы углерода, азота и кислорода пептидной связи находятся в sp2-гибридизации, все 4 атома CONH-группы расположены в одной плоскости под углом 120о.
Н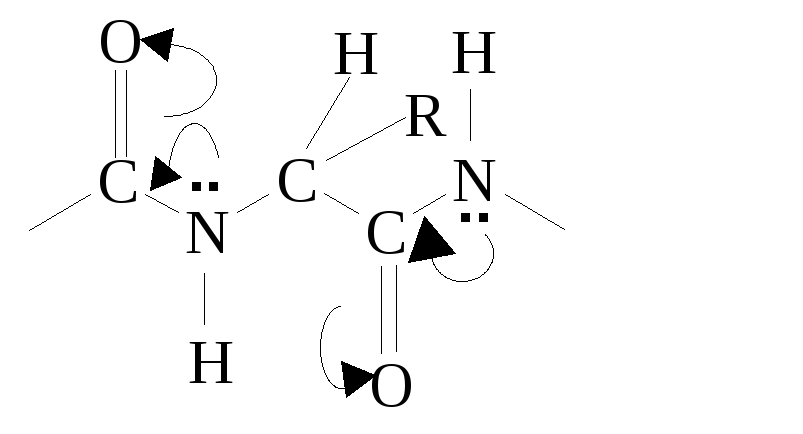 еподеленная
пара электронов азота вступает в
p,π-сопряжение
с электронным облаком π-связи карбонильной
группы, вследствие чего связь C=O
несколько удлиняется (0,124 нм вместо
0,121 нм), а связь C-N
несколько укорачивается (0,132 нм вместо
0,147 нм). Вследствие делокализации
электронной плотности в p,π-сопряженной
системе связи C-O
и C-N
становятся как бы «полуторными», поэтому
вращение вокруг них затруднено. Такое
электронное строение обусловливает
жесткую плоскостную структуру пептидной
связи:
еподеленная
пара электронов азота вступает в
p,π-сопряжение
с электронным облаком π-связи карбонильной
группы, вследствие чего связь C=O
несколько удлиняется (0,124 нм вместо
0,121 нм), а связь C-N
несколько укорачивается (0,132 нм вместо
0,147 нм). Вследствие делокализации
электронной плотности в p,π-сопряженной
системе связи C-O
и C-N
становятся как бы «полуторными», поэтому
вращение вокруг них затруднено. Такое
электронное строение обусловливает
жесткую плоскостную структуру пептидной
связи:
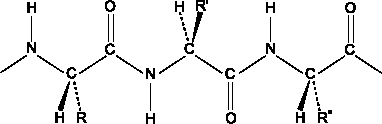
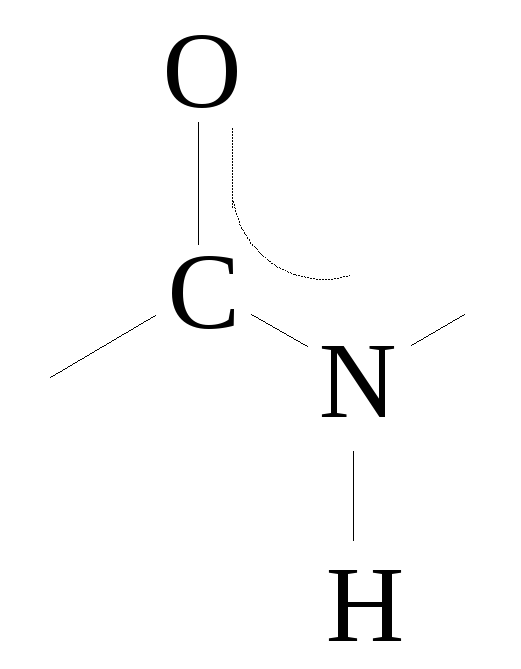
Качественной реакцией на пептидную связь является биуретовая реакция: при взаимодействии пептида с Cu(OH)2 наблюдается красновато-фиолетовое окрашивание. Обратите внимание, что эта реакция не характерна для дипептидов.
При единообразно построенной цепи пептиды и белки отличаются аминокислотным составом и аминокислотной последовательностью. Аминокислотный состав показывает, какие аминокислоты и в каких соотношениях входят в структуру пептидов и белков. Для определения аминокислотного состава пептид или белок подвергают гидролизу и гидролизат анализируют (чаще всего хроматографическими методами).
Пептидные связи гидролизуются и в кислой, и в щелочной среде. При кислотном гидролизе пептидов образуются соли аминокислот по аминогруппе, при щелочном гидролизе – соли по карбоксильной группе:
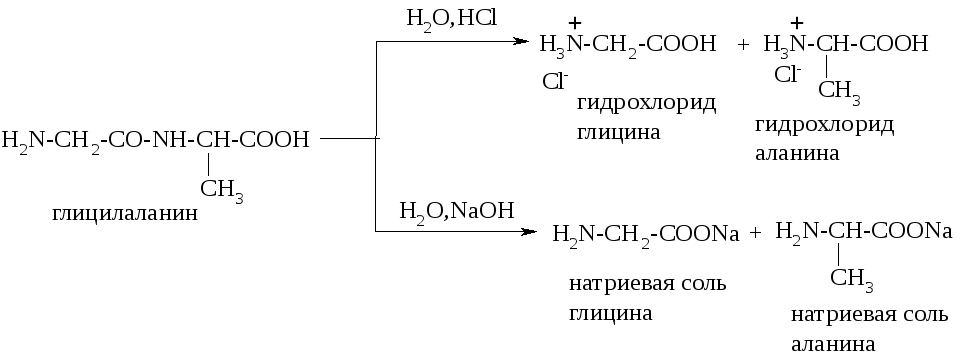
Практически для гидролиза пептидов и белков используют кислотный катализ, т.к. многие аминокислоты в щелочной среде неустойчивы. Полный кислотный гидролиз любого белка протекает при его нагревании с 20% раствором соляной кислоты при 110оС в течение 24 час. Некоторые аминокислоты (например, триптофан) разрушаются и в кислой среде.
Более удобным является ферментативный гидролиз пептидов и белков. Ферментативный гидролиз протекает под действием ферментов – пептидаз. Определенные пептидазы расщепляют пептидные связи между остатками определенных аминокислот. Например, трипсин гидролизует связи, образованные лизином или аргинином с другими аминокислотами, пепсин – связи между аминокислотами с гидрофобными радикалами (аланин, валин, лейцин, изолейцин), химотрипсин – связи, образованные ароматическими аминокислотами. Чтобы осуществить полный ферментативный гидролиз, нужно использовать набор различных ферментов.
При ферментативном гидролизе образуются свободные аминокислоты.
Первичная структура белков – это определенная аминокислотная последовательность, т.е. порядок чередования аминокислотных остатков в полипептидной цепи. Определение аминокислотной последовательности заключается в последовательном отщеплении аминокислотных остатков с N- или C-конца и их идентификации. Существуют различные методы определения аминокислотной последовательности, один из них – фенилтиогидантоиновый, или метод Эдмана.
Этот метод заключается во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде:
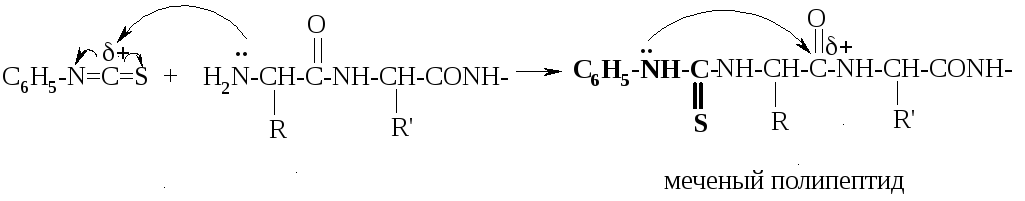
Образуется так называемый меченый полипептид, в структуре которого появился остаток фенилизотиоцианата (это реакция AN). При обработке меченого пептида слабой кислотой при комнатной температуре происходит внутримолекулярная циклизация в фенилтиогидантоиновое производное (ФТГ-производное) с одновременным гидролизом пептидной связи:
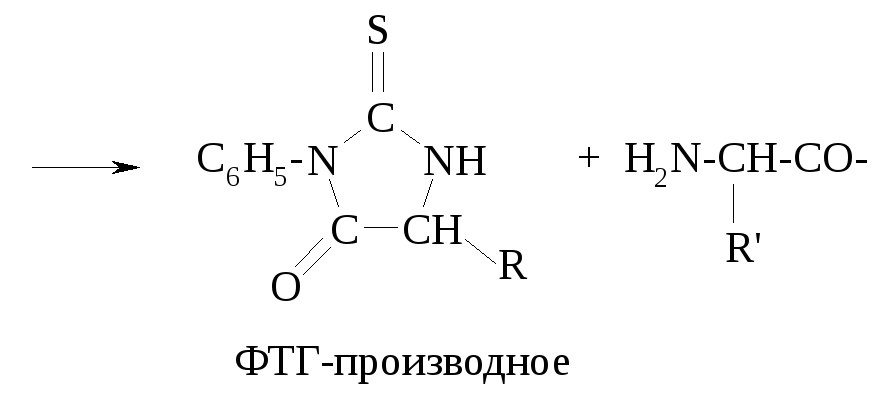
ФТГ-производное идентифицируется методом тонкослойной хроматографии. Преимущество метода Эдмана в том, что остальная часть пептидной молекулы не нарушается, и можно повторять операции по отщеплению следующей N-концевой аминокислоты. Сейчас этот метод воспроизводится в автоматическом приборе, который осуществляет до 50 стадий отщепления и автоматически анализирует ФТГ-производные.
Для белков, наряду с первичной структурой, характерны более высокие уровни организации – вторичная, третичная и четвертичная структуры.
Под вторичной структурой белка понимают пространственное расположение атомов полипептидной цепи. Существует два типа вторичной структуры – α-спираль и β-складчатая структура.
На основании теоретических расчетов в 1950 г. Полинг и Кори доказали, что для полипептидной цепи наиболее выгодной конформацией является α-спираль – структура, сходная с правозакрученной винтовой лестницей (рис. 5). Поскольку α-спираль построена из повторяющихся единиц –NH-CHR-CO-, то размеры ее относительно постоянны. На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали 0,54 нм, диаметр – 0,5 нм. Плоскости двух соседних пептидных групп находятся под углом ~108о, боковые радикалы находятся на наружной стороне спирали (направлены как бы от цилиндра).
Фиксируют такую спиральную конформацию водородные связи, которые возникают между атомом кислорода карбонильной группы каждого первого аминокислотного остатка и атомом водорода NH-группы каждого пятого остатка:
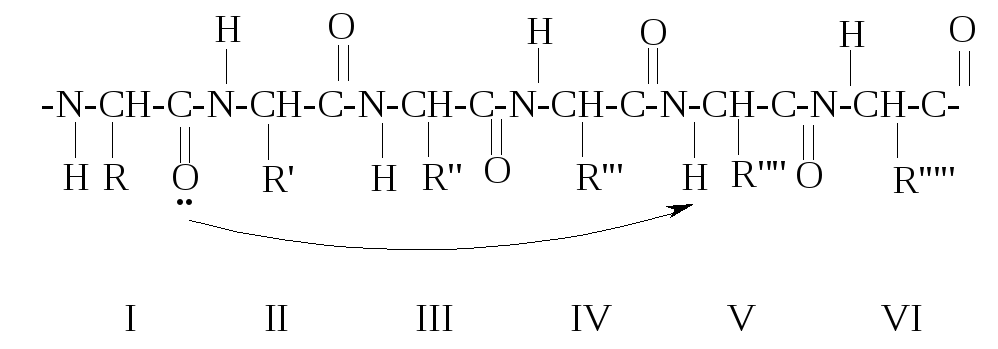
В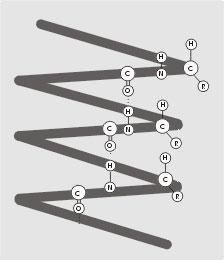 одородные
связи почти параллельны оси спирали, а
так как каждая C=O
и NH-группы
α-спирали участвуют в образовании
водородной связи, это делает вторичную
структуру весьма устойчивой.
одородные
связи почти параллельны оси спирали, а
так как каждая C=O
и NH-группы
α-спирали участвуют в образовании
водородной связи, это делает вторичную
структуру весьма устойчивой.
Рис. 5. Фрагмент белковой α-спирали.
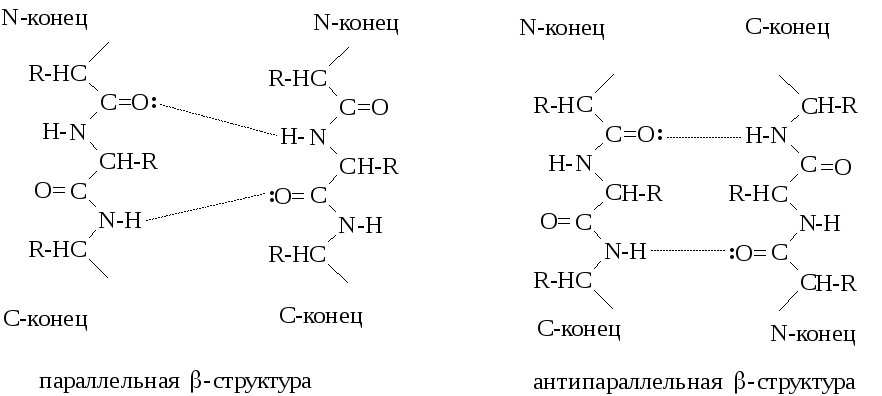
Другим видом вторичной структуры является β-складчатая структура. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей. Складчатый лист включает обычно не более шести полипептидных цепей. Если полипептидные цепи имеют одинаковую направленность от N- к C-концу, то образуется параллельная β-структура, если противоположную – то антипараллельная:
Многие белки содержат одновременно и α-спиральные, и β-складчатые участки.

Полипептидная цепь, имеющая ту или иную вторичную структуру, способна определенным образом закручиваться в пространстве, что и определяет третичную структуру белка, то есть общую форму полипептидной цепи (рис. 6).
Рис. 6. Третичная
структура белка.
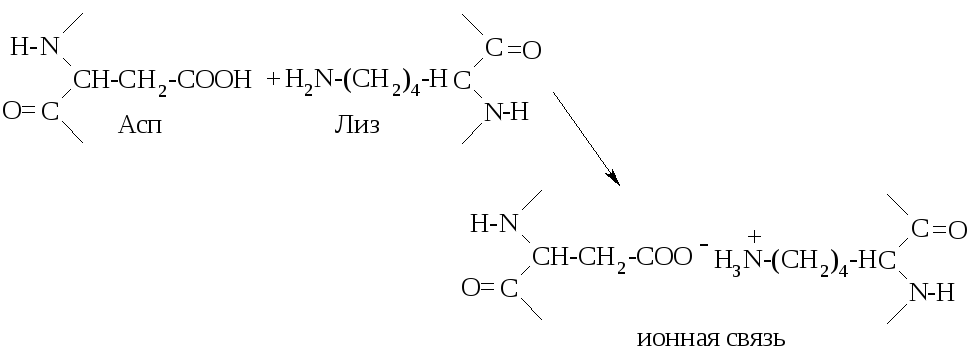
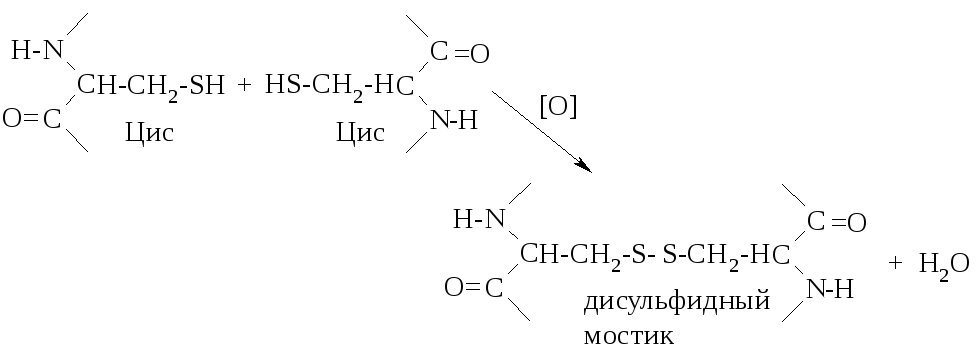
Третичная структура, наряду с водородными связями, стабилизируется ионными связями (между остатками кислых и основных аминокислот), ковалентными связями (дисульфидные мостики в цистине), гидрофобными взаимодействиями (силы притяжения между неполярными радикалами).
По пространственной структуре белки делятся на глобулярные и фибриллярные. Для глобулярных белков более характерна α-спиральная структура, а цепи их изогнуты в пространстве так, что макромолекула приобретает сферическую форму. Глобулярные белки растворяются в воде и солевых растворах с образованием коллоидных растворов. Это альбумин (яичный белок), глобин (белковая часть гемоглобина), большинство ферментов. Фибриллярные белки имеют β-складчатую структуру, волокнистое строение. Они нерастворимы в воде. Это β-кератин (волосы, роговая ткань), коллаген (соединительная ткань), миоинозин (мускульная ткань).
Несколько отдельных полипептидных цепей способны укладываться в более сложные образования. При этом каждая цепь, сохраняя свою первичную, вторичную и третичную структуру, выступает в роли субъединицы комплекса с более высокой пространственной организацией – четвертичной структуры. Четвертичная структура закрепляется за счет водородных связей и гидрофобных взаимодействий между полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
Пространственная структура белков способна нарушаться под влиянием некоторых факторов – высокая или низкая температура, изменение pH среды, УФ- или рентгеновское облучение, механические воздействия. Нарушение природной пространственной структуры белка называется денатурацией. Денатурация может быть обратимой и необратимой. При денатурации белков снижается их растворимость и изменяется биологическая активность.
Сложные белки. По составу белки подразделяются на простые и сложные (конъюгированные). При гидролизе простых белков образуются только α-аминокислоты. Сложные белки, наряду с белковой частью, содержат так называемую простетическую группу непептидной структуры. По характеру простетической группы сложные белки делят на фосфопротеины (содержат остатки фосфорной кислоты), металлопротеины (ионы металлов), гликопротеины (углеводы), липопротеины (липидная часть), нуклеопротеины (нуклеиновые кислоты).
