
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Природные α-аминокислоты. Пептиды, белки
α-Аминокислоты являются мономерными единицами биополимеров – пептидов и белков. Белки – основа всего живого. Функции белков в природе многообразны. Это ферменты и гормоны, выполняющие регуляторную функцию, структурные белки (кератин, коллаген), транспортные (гемоглобин), защитные (иммуноглобулины). Некоторые аминокислоты используются как лекарственные средства, например, глутаминовая кислота – при заболеваниях ЦНС, метионин – для лечения заболеваний печени, цистеин – как радиопротектор, а также в глазной практике.
В природе в свободном и связанном виде обнаружены сотни аминокислот, 20-25 из них постоянно встречаются во всех белках.
Строение и классификация природных α-аминокислот
О бщая
формула α-аминокислот (исключение –
пролин и оксипролин):
бщая
формула α-аминокислот (исключение –
пролин и оксипролин):
В основном используют тривиальные названия α-аминокислот. В биохимии часто пользуются сокращенными трехбуквенными названиями.
Согласно общей формуле, аминокислоты отличаются лишь строением радикала, в соответствии с чем они классифицируются на алифатические, ароматические и гетероциклические. Среди алифатических аминокислот в зависимости от наличия в радикале функциональной группы выделяют подгруппы гидрокси- и серосодержащих аминокислот.
Примеры алифатических аминокислот:

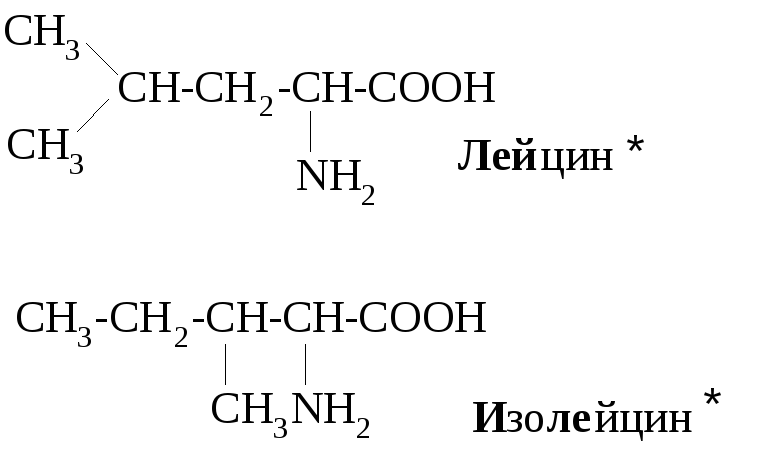
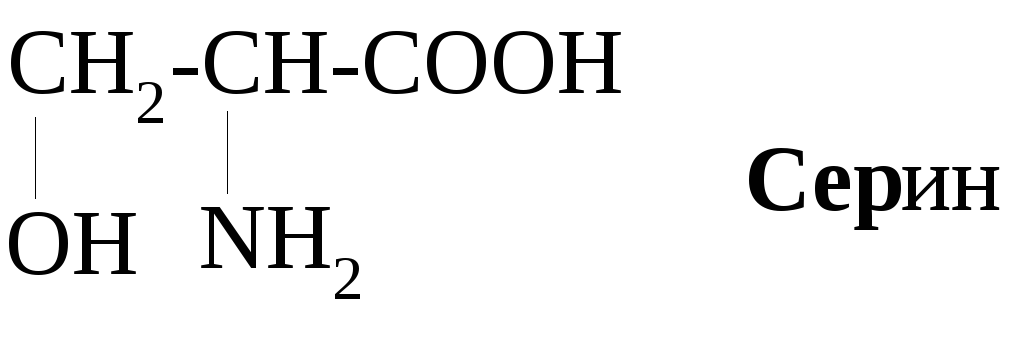





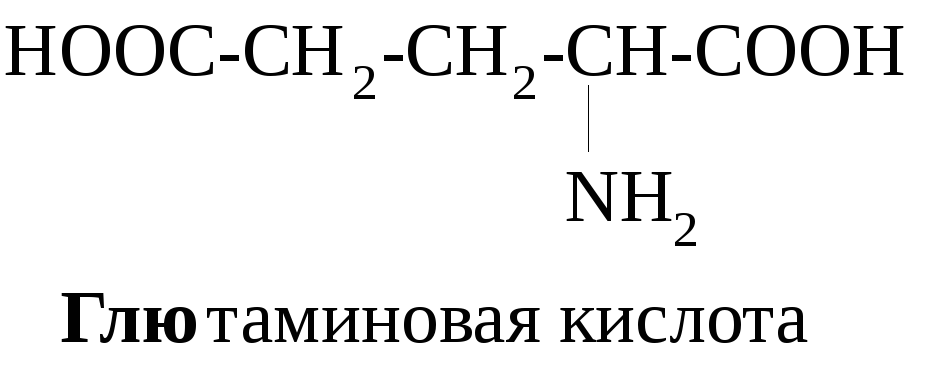


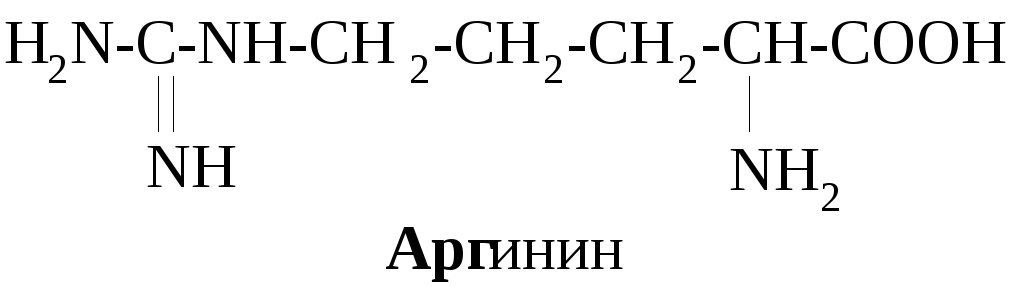
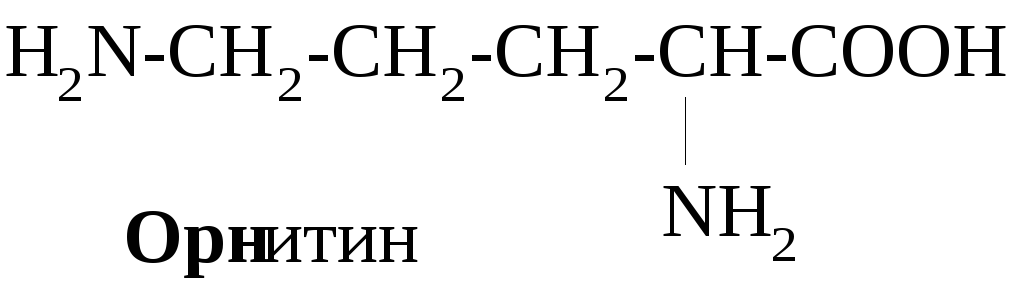

Примерами ароматических аминокислот являются фенилаланин и тирозин:

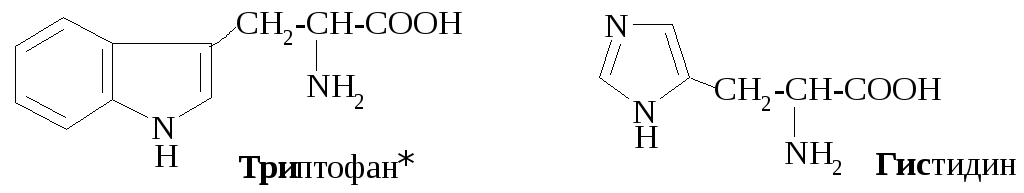
К гетероциклическим аминокислотам относятся:

В зависимости от соотношения количества карбоксильных и аминогрупп в молекулах различают нейтральные (моноаминомонокарбоновые) – глицин, аланин и др., кислые (моноаминодикарбоновые) – аспарагиновая, глютаминовая кислоты, основные (диаминомонокарбоновые) аминокислоты – лизин, орнитин, аргинин.
Природа радикала в молекулах аминокислот значительно влияет на свойства белков. Например, наличие полярных групп (-SH, NH2, -OH, COOH, фенольного гидроксила) увеличивает растворимость белков. Кроме того, эти группы принимают участие в образовании связей, формирующих пространственную структуру белка. За счет карбоксильной и аминогруппы многие ферменты обеспечивают кислотный или основный катализ ряда биохимических процессов.
Большинство α-аминокислот синтезируется в организме, но некоторые организм не способен синтезировать, они должны поступать с пищей. Эти аминокислоты называют незаменимыми, в норме их восемь: валин, лейцин, изолейцин, треонин, метилнин, фенилаланин, триптофан, лизин. При некоторых заболеваниях незаменимых аминокислот больше. Так, фенилкетонурия (пировиноградная олигофрения) представляет собой врожденное нарушение обмена веществ, каким-то образом связанное с некоторыми умственными расстройствами. Люди, страдающие этим заболеванием, нуждаются еще в одной незаменимой для них аминокислоте – тирозине, т.к. в отличие от здоровых людей их организм не способен превращать фенилаланин в тирозин.
