
- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
Реакции электрофильного присоединения к несимметричным алкенам
Когда мы рассматривали реакцию гидрогалогенирования или гидратации на примере этена, у нас не возникало вопроса к какому из атомов углерода при двойной связи присоединится протон водорода на стадии образования σ-комплекса: в молекуле этена (и других симметричных алкенов) оба углерода при двойной связи равноценны. В случае же этих реакций в несимметричных алкенах возможно образование двух продуктов присоединения, а значит, возникает проблема: какой из них будет преобладающим. Рассмотрим это на примере гидрохлорирования пропена:
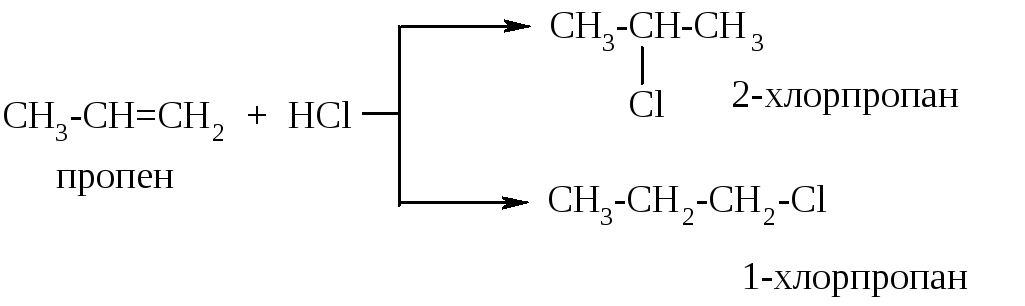
Теоретически, в реакции гидрохлорирования пропена могут образоваться 1-хлорпропан и 2-хлорпропан, однако на практике в основном получается 2-хлорпропан. Эта реакция протекает по правилу Марковникова: при присоединении реагентов типа H+X- (например, HCl, HBr, HOH) к несимметричным алкенам протон водорода присоединяется к более гидрогенизированному атому углерода при двойной связи.
Чтобы объяснить такой порядок присоединения, необходимо рассмотреть статический и динамический факторы.
Статический фактор – это распределение электронной плотности в нереагирующей молекуле.
А![]() том
углерода при двойной связи sp2-гибридизован,
он более электроотрицателен, чем
sp3-гибридизованный
углерод метильной группы. Поэтому
электронная плотность связи CH3-CH=
смещена к углероду с двойной связью.
Так как π-связь поляризуется легче, чем
σ-связь, электроны π-связи смещаются к
соседнему атому углерода, т.е. происходит
её поляризация. В конечном итоге на
первом атоме углерода возникает частичный
отрицательный заряд (δ-), а на втором –
частичный положительный (δ+). Конечно
же, протон водорода (положительно
заряженная частица) будет направляться
к тому углероду, где есть избыток
электронной плотности, а он и есть более
гидрогенизированный атом углерода при
двойной связи.
том
углерода при двойной связи sp2-гибридизован,
он более электроотрицателен, чем
sp3-гибридизованный
углерод метильной группы. Поэтому
электронная плотность связи CH3-CH=
смещена к углероду с двойной связью.
Так как π-связь поляризуется легче, чем
σ-связь, электроны π-связи смещаются к
соседнему атому углерода, т.е. происходит
её поляризация. В конечном итоге на
первом атоме углерода возникает частичный
отрицательный заряд (δ-), а на втором –
частичный положительный (δ+). Конечно
же, протон водорода (положительно
заряженная частица) будет направляться
к тому углероду, где есть избыток
электронной плотности, а он и есть более
гидрогенизированный атом углерода при
двойной связи.
Т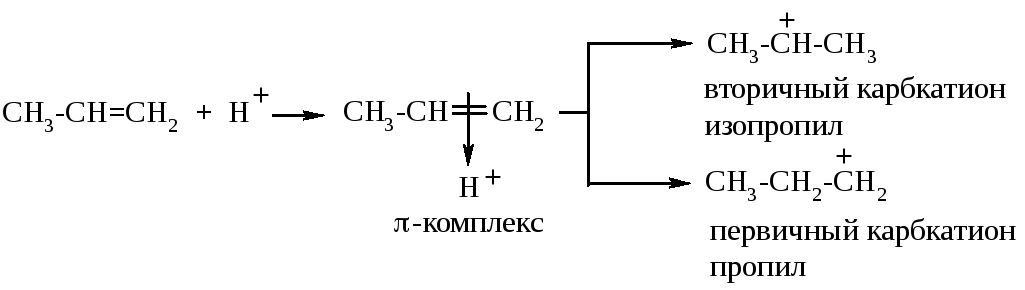 еперь
рассмотрим динамический
фактор –
сравним стабильность промежуточных
частиц (карбкатионов). Вы уже знаете:
чем стабильнее промежуточная частица
(интермедиат), тем больше вероятность
её образования.
еперь
рассмотрим динамический
фактор –
сравним стабильность промежуточных
частиц (карбкатионов). Вы уже знаете:
чем стабильнее промежуточная частица
(интермедиат), тем больше вероятность
её образования.
На стадии образования σ-комплекса теоретически могут образоваться два карбкатиона – пропил (первичный) и изопропил (вторичный). Атом углерода с полным положительным зарядом смещает к себе электронную плотность соседней (или соседних) C-C σ-связи, уменьшая собственный недостаток электронной плотности. Вторичный карбкатион более стабилен из-за большей компенсации положительного заряда на углероде:

Если рассуждать о стабильности карбкатионов вообще, то самыми стабильными являются третичные, затем – вторичные, первичные, а самым нестабильным – катион метил:

Т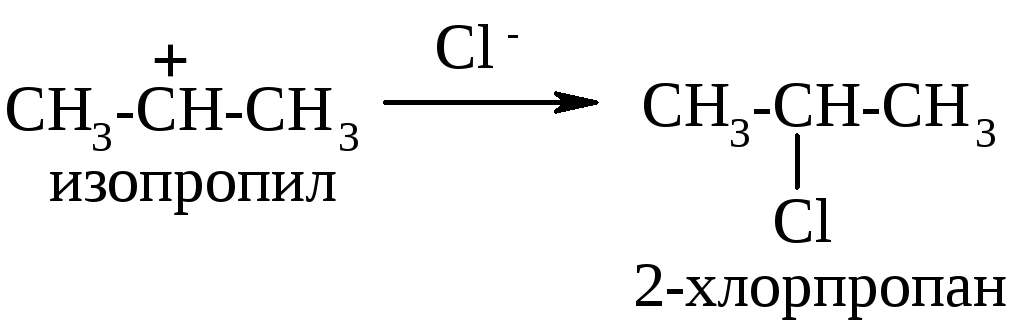 ак
как в рассматриваемом примере более
стабильным является изопропил-катион,
именно он в первую очередь сможет
провзаимодействовать с анионом хлора,
а значит преобладающим продуктом этой
реакции является 2-хлорпропан (т.е. протон
водорода присоединился к более
гидрогенизированному атому углерода):
ак
как в рассматриваемом примере более
стабильным является изопропил-катион,
именно он в первую очередь сможет
провзаимодействовать с анионом хлора,
а значит преобладающим продуктом этой
реакции является 2-хлорпропан (т.е. протон
водорода присоединился к более
гидрогенизированному атому углерода):
Классическое правило Марковникова можно без оговорок применять только к самим алкенам. В случае их производных нужно обязательно рассматривать статический и динамический факторы, влияющие на ход реакции (например, позже мы будем рассматривать реакции электрофильного присоединения в акриловой кислоте, которые протекают против правила Марковникова).
В современной интерпретации правило Марковникова формулируется так: направление присоединения реагентов типа HX к производным алкенов определяется относительной устойчивостью промежуточных карбкатионов.
Реакция гидрирования алкенов протекает по механизму радикального присоединения в присутствии катализаторов (никель, платина), на поверхности которых происходит гомолитический разрыв молекулы водорода. В результате гидрирования алкенов образуются алканы:

Реакции окисления алкенов протекают с образованием различных продуктов в зависимости от условий. Мы рассмотрим только так называемое мягкое окисление алкенов. Его проводят разбавленным раствором перманганата калия при комнатной температуре (реакция Вагнера).
В результате реакции образуются гликоль (двухатомный спирт) и диоксид марганца:
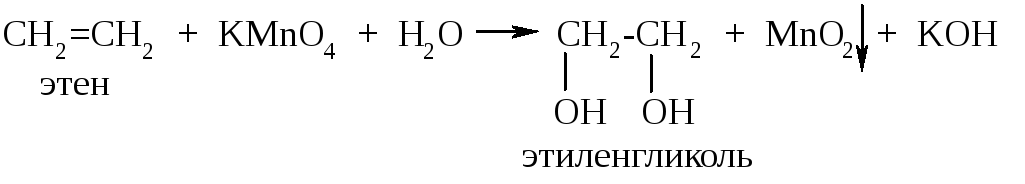
Эту реакцию используют как качественную на наличие двойной связи: в результате исчезает малиновое окрашивание перманганата калия и появляется бурый осадок диоксида марганца.
