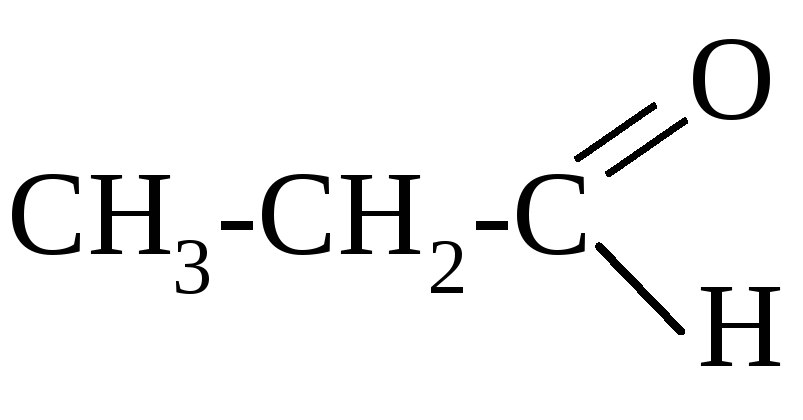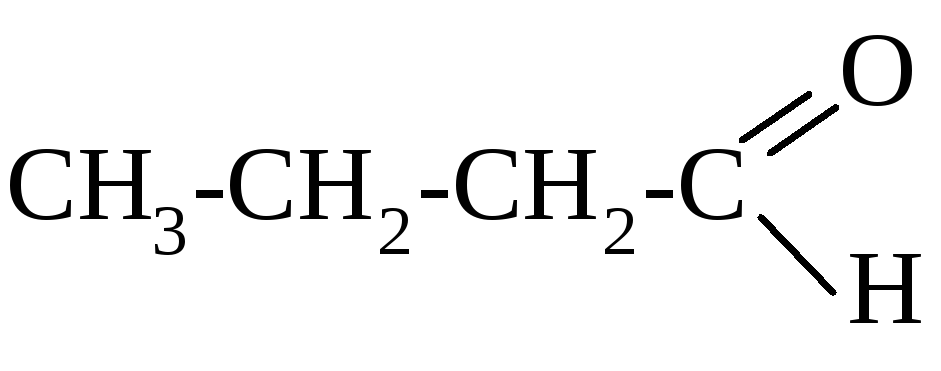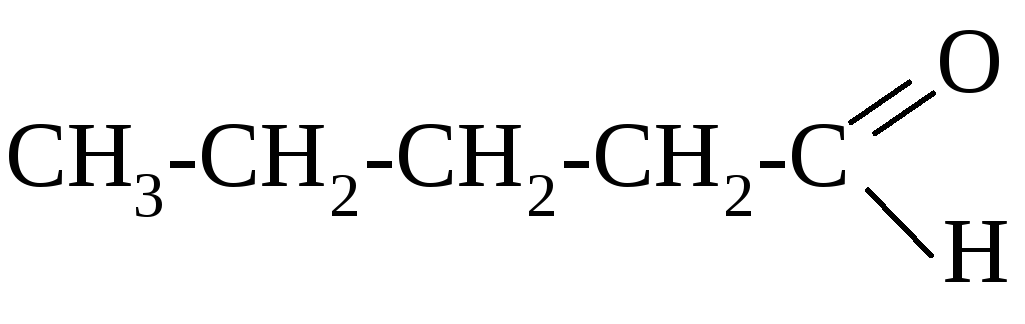- •Введение
- •Электронное строение элементов-органогенов. Химическая связь в органических молекулах
- •Химическая связь в органических молекулах
- •Классификация химических реакций. Химические свойства алканов, алкенов и алкадиенов
- •Реакционная способность алканов
- •Реакционная способность алкенов
- •Химические свойства алкенов
- •Общий механизм реакций электрофильного присоединения
- •Реакции электрофильного присоединения к несимметричным алкенам
- •Реакции присоединения к алкадиенам
- •Сопряжённые системы. Ароматичность. Электронные эффекты. Реакции электрофильного замещения в бензоле и его производных
- •Химические свойства бензола
- •Взаимное влияние атомов в молекулах органических соединений. Электронные эффекты
- •Реакции электрофильного замещения в нафталине
- •Реакции окисления гомологов бензола
- •Химические свойства галогеналканов, спиртов и фенолов
- •Медико-биологическое значение галогеналканов
- •Спирты и фенолы
- •Медико-биологическое значение спиртов и фенолов
- •Кислотные и основные свойства органических соединений. Реакционная способность аминов
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Реакционная способность оксосоединений
- •Классификация и номенклатура оксосоединений
- •Названия алифатических альдегидов
- •Реакционные центры в молекулах оксосоединений
- •Примеры реакций нуклеофильного присоединения
- •Медико-биологическое значение альдегидов и кетонов
- •Химические свойства карбоновых кислот и их функциональных производных
- •Названия предельных алифатических монокарбоновых кислот
- •Реакционные центры в молекулах карбоновых кислот
- •Кислотные свойства карбоновых кислот
- •Реакции нуклеофильного замещения
- •Реакции карбоновых кислот по радикалу
- •Названия насыщенных алифатических дикарбоновых кислот
- •Медико-биологическое значение карбоновых кислот и их производных
- •Гетерофункциональные соединения алифатического ряда – метаболиты и биорегуляторы
- •Аминоспирты
- •Аминокислоты
- •Гидроксикислоты (оксикислоты)
- •Оксокислоты
- •Медико-биологическое значение гетерофункциональных производных карбоновых кислот
- •Оптическая изомерия
- •Стереоизомерия молекул с несколькими центрами хиральности
- •Стереоизомерия и биологическая активность
- •Гетерофункциональные производные бензольного ряда
- •Производные сульфаниловой кислоты
- •Сульфаниламидные препараты
- •Салициловая кислота и ее производные
- •Гетероциклические соединения. Производные пятичленных гетероциклов
- •Пятичленные гетероциклы с одним гетероатомом
- •Свойства пиррола и его производных
- •Свойства фурана и его производных
- •Пятичленные гетероциклы с двумя гетероатомами
- •Шестичленные гетероциклические соединения
- •Шестичленные гетероциклы с двумя гетероатомами
- •Углеводы. Моносахариды
- •Цикло-оксо-таутомерия моносахаридов
- •Углеводы. Ди- и полисахариды
- •Природные α-аминокислоты. Пептиды, белки
- •Строение и классификация природных α-аминокислот
- •Стереоизомерия α-аминокислот
- •Химические свойства
- •Реакции α-аминокислот in vivo
- •Нуклеиновые кислоты
- •Нуклеиновые основания
- •Нуклеозиды
- •Названия нуклеозидов
- •Нуклеотиды
- •Нуклеиновые кислоты
- •Омыляемые липиды
- •Фосфолипиды
- •Неомыляемые липиды
- •Алкалоиды
- •Литература
- •Оглавление
- •305041, Г. Курск, ул. К. Маркса, 3.
- •305041, Г. Курск, ул. К. Маркса, 3. Заказ № 313.
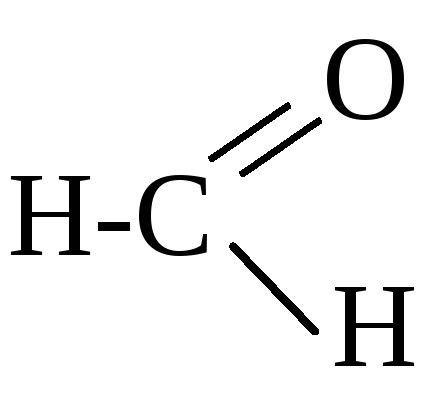
Реакционная способность оксосоединений
Ф![]()
![]() ункциональной
группой оксосоединений является
карбонильная или оксогруппа . В
молекулах альдегидов оксогруппа связана
с радикалом и атомом водорода, поэтому
общая формула альдегидов .
ункциональной
группой оксосоединений является
карбонильная или оксогруппа . В
молекулах альдегидов оксогруппа связана
с радикалом и атомом водорода, поэтому
общая формула альдегидов .
В![]() кетонах оксогруппа связана с двумя
радикалами, общая формула кетонов
.
кетонах оксогруппа связана с двумя
радикалами, общая формула кетонов
.
Классификация и номенклатура оксосоединений
Оксосоединения классифицируют по природе радикала на алифатические (предельные и непредельные) и ароматические.
Рассмотрим номенклатуру первых представителей предельных алифатических альдегидов. По заместительной номенклатуре IUPAC их названия строятся с использованием названий алканов с соответствующим количеством атомов углерода в цепи с добавлением суффикса –аль. Часто используют и тривиальные названия альдегидов.
Таблица 1
Названия алифатических альдегидов
|
Строение |
Тривиальное название |
Название по IUPAC |
|
|
муравьиный альдегид (формальдегид)
уксусный альдегид (ацетальдегид)
пропионовый альдегид
масляный альдегид
валериановый альдегид |
метаналь
этаналь
пропаналь
бутаналь
пентаналь
|
А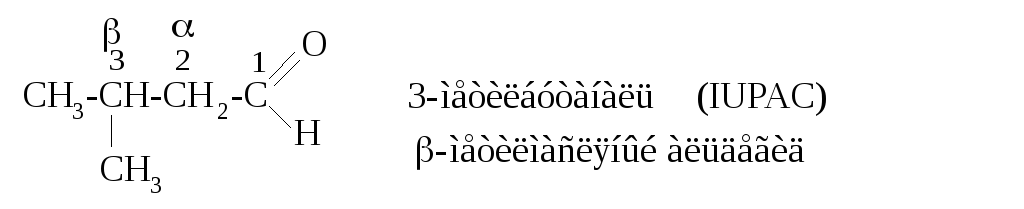 льдегиды
с разветвлёнными радикалами также можно
называть, используя два вида номенклатуры.
Рассмотрим это на конкретном примере:
льдегиды
с разветвлёнными радикалами также можно
называть, используя два вида номенклатуры.
Рассмотрим это на конкретном примере:
По номенклатуре IUPAC это соединение рассматривается как производное бутаналя, положение заместителя обозначается цифрой (первым является атом углерода альдегидной группы): 3-метилбутаналь. Если за основу принимается тривиальное название альдегида (масляный), то положение заместителя обозначается греческой буквой (α-, β-, γ- и т.д.), при этом α-положением является атом углерода, ближайший к альдегидной группе: β-метилмасляный альдегид.
Простейшим непредельным альдегидом является акриловый альдегид, или акролеин (тривиальное название). По номенклатуре IUPAC это пропеналь:
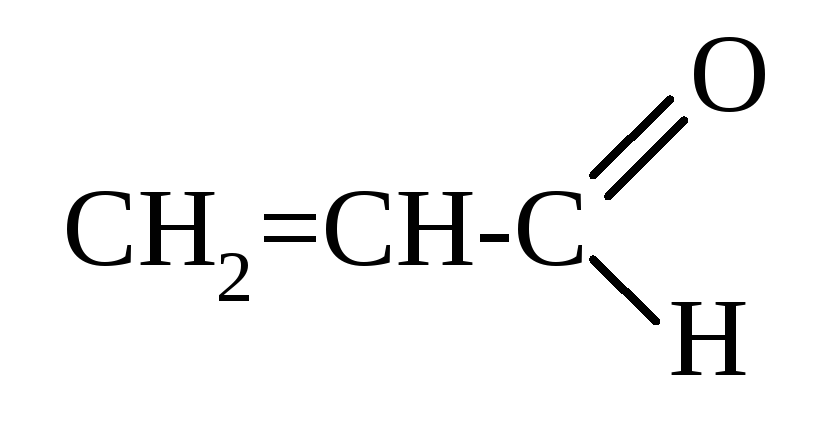
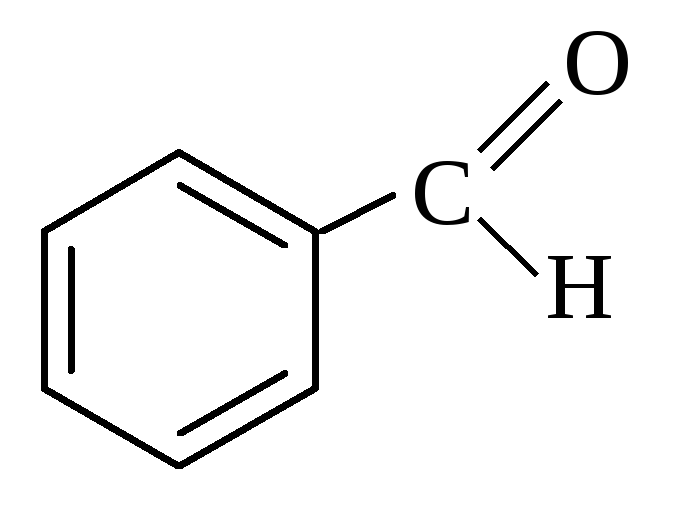
Примером ароматических альдегидов является бензальдегид:
Кетоны называют по двум видам международной номенклатуры – заместительной и радикально-функциональной.
По заместительной номенклатуре название кетона рассматривают как производное соответствующего углеводорода, обозначая оксогруппу суффиксом –он и указывая её положение. По радикало-функциональной номенклатуре название кетона складывается из названий соответствующих радикалов (в алфавитном порядке) с добавлением слова кетон. Например:
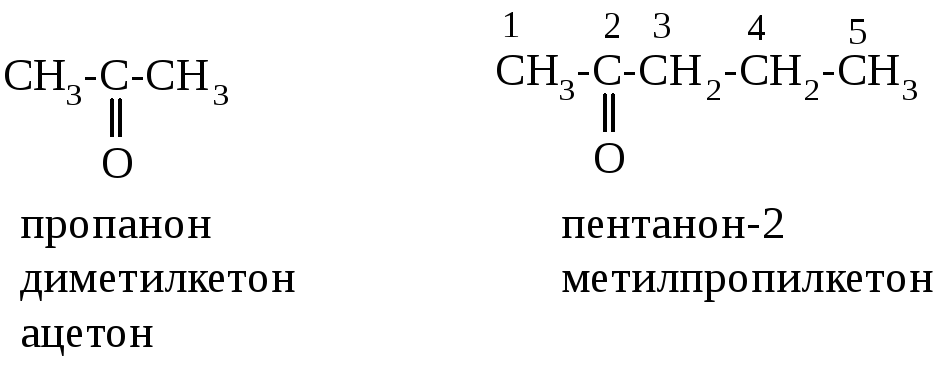
Диметилкетон часто называют тривиальным названием – ацетон.
Реакционные центры в молекулах оксосоединений
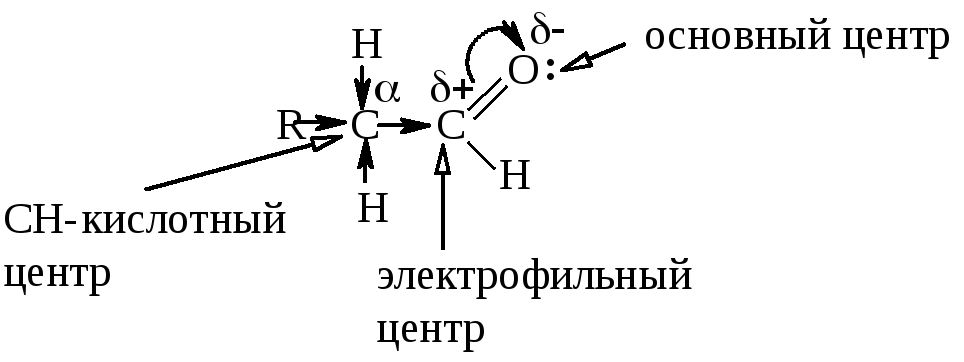
Более электроотрицательный атом кислорода смещает к себе электронную плотность, создавая на атоме углерода карбонильной группы частичный положительный заряд. Углерод карбонильной группы становится электрофильным центром. За счёт неподеленной электронной пары кислород является основным центром. Альдегидная группа смещает электронную плотность с соседнего атома углерода (α-атом), создавая на нем частичный положительный заряд. За счёт этого C-H-связи поляризуются, возникает CH-кислотный центр.
Электрофильный центр в молекулах оксосоединений может быть атакован нуклеофильным реагентом. Реакции протекают с разрывом π-связи (присоединение). Значит, для альдегидов и кетонов характерны реакции нуклеофильного присоединения (AN).
Легкость протекания реакций нуклеофильного присоединения зависит от величины δ+ на электрофильном центре и от его пространственной доступности.
Сравним активность муравьиного, уксусного, трихлоруксусного альдегидов и ацетона.
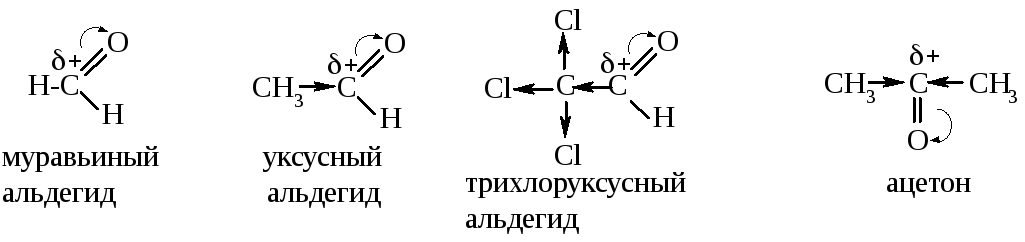
С позиций величины заряда на электрофильном центре наибольшей реакционной способностью обладает трихлоруксусный альдегид, т.к. три электроноакцепторных заместителя способствуют его увеличению. В молекуле муравьиного альдегида заместитель отсутствует. В молекуле уксусного альдегида метильная группа понижает частичный положительный заряд на углероде карбонильной группы, а значит, понижает и активность. В молекуле ацетона таких электронодонорных заместителей два, а значит, активность ещё ниже. Таким образом, электроноакцепторные заместители в радикале повышают активность оксосоединений в реакциях AN, а электронодонорные заметители – понижают.
С позиций доступности реакционного центра ацетон также является наименее реакционноспособным, т.к. возникают пространственные затруднения для атаки нуклеофилом (реакционный центр «экранирован» двумя крупными углеводородными радикалами).
В целом, альдегиды более реакционноспособны в реакциях нуклеофильного присоединения, чем кетоны.
М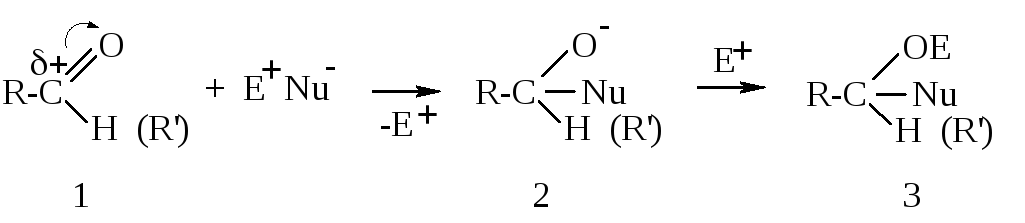 еханизм
реакции нуклеофильного присоединения
может быть описан следующим образом:
еханизм
реакции нуклеофильного присоединения
может быть описан следующим образом:
Нуклеофильная частица (Nu-) атакует электрофильный центр молекулы оксосоединения (1). π-Связь разрывается гетеролитически, и оба её электрона уходят к атому кислорода. Новая связь C-Nu образуется за счёт электронов нуклеофила. Образовавшаяся отрицательная частица (2) дальше взаимодействует с электрофилом, давая продукт нуклеофильного присоединения (3).
По приведенному механизму протекает ряд важных реакций альдегидов и кетонов, в которых нуклеофилами являются, например, H2O, R-OH, HCN, H-, NH3, R-NH2.