
- •Глава 1. Оценка и значение боли в животе 6
- •Глава 2. Дисфагия, боли в груди и гастроэзофагальный рефлюкс 13
- •Глава 3. Язвенная болезнь 27
- •Глава 4. Патофизиология тошноты и рвоты 42
- •Глава 5. Патофизиология диареи 53
- •Глава 6. Мальабсорбция 79
- •Глава 7. Желтуха и нарушение функции печени 113
- •Глава 8. Панкреатиты 135
- •Глава 9. Кровотечение из желудочно-кишечного тракта 156
- •Глава 10. Опухоли желудочно-кишечного тракта 169
- •Введение
- •Проф.Джозеф м. Хендерсон Глава 1. Оценка и значение боли в животе
- •Клинический пример
- •Анатомия и физиология Висцеральные сенсорные пути
- •Стимулы абдоминальной боли
- •Теория входящего контроля боли
- •Клинические корреляции
- •Клиническая оценка и значение
- •Дифференциальный диагноз
- •Лечение
- •Глава 2. Дисфагия, боли в груди и гастроэзофагальный рефлюкс
- •Физиология глотания
- •Клинические корреляции пищеводной дисфункции
- •Клиническая оценка
- •Клинический случай
- •Вопрос 1. В данном случае эти расстройства глотания связаны с нарушениями функции глотки или пищевода?
- •Вопрос 2. Нарушен процесс глотания только твердой пищи или также и жидкой?
- •Вопрос 3. Что показало рентгенографическое исследование?
- •Вопрос 4. Что делать дальше?
- •Вопрос 5. Какой диагноз?
- •Вопрос 7. Как проводится такое лечение?
- •Глава 3. Язвенная болезнь
- •Патофизиология
- •Повреждающие факторы
- •Клинические корреляции
- •Признаки и симптомы
- •Дифференциальный диагноз
- •Терапия
- •Ингибиторы кислоты / Нейтрализующие препараты
- •Препараты, не влияющие на кислотность
- •Хирургическое лечение язвенной болезни
- •Синдром Золлингера-Эллисона
- •Клинические проявления
- •Локализация опухоли
- •Дифференциальная диагностика
- •Направления лечения
- •Клиническое обследование
- •Визуализация язвы
- •Исследование кислотности желудочного сока
- •Локализация опухоли при синдроме Золлингера-Эллисона
- •Клинический случай
- •Дифференциальная диагностика
- •Диагностический план
- •План лечения
- •Заключение
- •Глава 4. Патофизиология тошноты и рвоты
- •Терминология
- •Патофизиология
- •Акт рвоты
- •Метаболические последствия рвоты
- •Последствия повторных актов рвоты
- •Клинические корреляции
- •Функциональная непроходимость
- •Нарушение эвакуаторной функции желудка
- •Нарушение моторики тонкой кишки
- •Нарушения центральной нервной системы
- •Тошнота и рвота при беременности
- •Клиническое обследование
- •Оценка скорости опорожнения желудка
- •Манометрия
- •Электрогастрография
- •Клинический случай
- •Заключение
- •Глава 5. Патофизиология диареи
- •Патофизиология
- •Пассивный транспорт воды
- •Секреторные клетки
- •Пероральная регидратация
- •Наследственные нарушения электролитного транспорта
- •Диарея в клинике
- •Острая и хроническая диарея Острая диарея
- •Хроническая диарея
- •Осмотическая и секреторная диарея
- •Моторика
- •Диарея и колит, вызванные применением антибиотиков
- •Клиническая оценка Содержание электролитов в стуле
- •Перфузионное исследование тонкой кишки
- •Содержание жиров в стуле
- •Водородный дыхательный тест
- •Эндоскопическое исследование сигмовидной кишки
- •Исследование нейроэндокринной системы
- •Культуры микроорганизмов кала / Паразиты и их яйца
- •Клинический случай
- •Заключение
- •Глава 6. Мальабсорбция
- •Патофизиология Переваривание Жевание и слюноотделение
- •Кислота и пепсин желудка. Измельчение и перемешивание пищи
- •Секреция желчи
- •Панкреатическая секреция
- •Всасывание в кишечнике Общая физиология всасывания в кишечнике Кишечные ворсинки и микроворсинки
- •Основные механизмы всасывания и транспорта веществ
- •Частная физиология всасывания в кишечнике Всасывание воды и электролитов
- •Всасывание аминокислот
- •Всасывание углеводов
- •Всасывание жиров
- •Всасывание витаминов и минеральных веществ
- •Признаки и симптомы мальабсорбции
- •Снижение массы тела
- •Потеря белков
- •Дефицит витаминов
- •Клинические корреляции
- •Недостаточность желчных кислот Заболевания печени
- •Обструкция желчевыводящих путей
- •Дисбактериоз
- •Заболевания / Резекция подвздошной кишки
- •Нарушения функций желудка Постгастрэктомический синдром
- •Злокачественная анемия/Ахлоргидрия
- •Ваготомия
- •Патология слизистой оболочки кишечника Целиакия(спру)
- •Тропическая спру
- •Ишемическая энтеропатия
- •Лучевая(радиационная)энтеропатия
- •Другие заболевания Непереносимость лактозы
- •Синдром короткой кишки
- •Протеинтеряющая энтеропатия
- •Клинические тесты
- •Анализы крови
- •Выявление жира в стуле
- •Водородный дыхательный тест
- •Рентгенологическое исследование тонкой кишки
- •Биопсия тонкой кишки
- •Тест Шиллинга
- •Дыхательный тест для оценки содержания желчных кислот
- •Оценка 1-антитрипсина в кале
- •Клинический пример
- •Заключение
- •Глава 7. Желтуха и нарушение функции печени
- •Введение
- •Патофизиология
- •Метаболизм лекарств
- •Лабораторные тесты
- •Маркеры холестаза
- •Оценка синтетической функции печени
- •Клинические корреляции
- •Гемохроматоз
- •Болезнь Вильсона
- •Дефицит 1-антитрипсина
- •Аутоиммунный хронический активный гепатит
- •Алкогольный гепатит
- •Повреждение печени лекарственными препаратами
- •Холестатические синдромы Первичный билиарный цирроз
- •Первичный склерозирующий холангит
- •Инфильтративные процессы
- •Клинический пример
- •Заключение
- •Глава 8. Панкреатиты
- •Анатомия Эмбриология
- •Иннервация, кровоснабжение и лимфоотток
- •Физиология
- •Экзокринная функция
- •Секреция жидкости и электролитов
- •Синтез и секреция ферментов
- •Амилаза
- •Протеазы
- •Стимуляторы панкреатической секреции
- •Фазы пищеварения
- •Ингибиторы секреции поджелудочной железы
- •Клинические корреляции Острый панкреатит Клиническая картина
- •Этиология и патофизиология
- •Хронический панкреатит Клиника
- •Этиология и патофизиология
- •Клинические тесты Тесты со стимуляцией
- •Бентирамидный тест
- •Клинический пример
- •Заключение
- •Глава 9. Кровотечение из желудочно-кишечного тракта
- •Особенности кровоснабжения желудочно-кишечного тракта
- •Микроциркуляция
- •Ишемия внутренних органов
- •Острые и хронические кровотечения из желудочно-кишечного тракта
- •Портальная гипертензия
- •Принципы лечения кровотечения из желудочно-кишечного тракта при портальной гипертензии
- •Локализация кровотечения
- •Прогноз при кровотечениях из верхних отделов желудочно-кишечного тракта
- •Кровотечение при язвенной болезни желудка как пример кровотечения из верхних отделов желудочно-кишечного тракта
- •Кровотечение из дивертикула
- •Сосудистая эктазия как пример хронического кровотечения из желудочно-кишечного тракта
- •Диагностика кровотечений из желудочно-кишечного тракта
- •Клинический пример
- •Дифференциальный диагноз
- •Заключение
- •Глава 10. Опухоли желудочно-кишечного тракта
- •Пролиферация и дифференцировка эпителия
- •Канцерогенез
- •Теории образования опухолей
- •Развитие опухоли
- •Специфические локализации рака
- •Рак желудка
- •Питание и рак желудочно-кишечного тракта Рак поперечно-ободочной и прямой кишки
- •Рак желудка
- •Роль воспаления в возникновении рака желудка Хронический атрофический гастрит и Helicobacter pylori
- •Рак и воспалительные заболевания кишечника
- •Скрининговые тесты при раке толстой кишки
- •Исследование стула на скрытую кровь
- •Возможности скрининговых исследований по поводу рака толстой кишки в XXI столетии— генетический подход
- •Клинический пример
Теории образования опухолей
Онкогены. Хорошо известно, что одиночная мутация или одиночный поврежденный ген не способны в большинстве клеток вызвать развитие рака. В опухолевых клетках было выявлено большое количество мутаций онкогенов, делеций, а также перестроек хромосом. Но существует теория, согласно которой активация даже одного гена может привести к замене фенотипа клетки на раковый. Эти гены-инициаторы названы онкогенами и впервые были выявлены при изучении онкогенных вирусов, способных трансформировать клетки куриных эмбрионов. Обнаружение онкогенов привело к неожиданному открытию: они произошли из нормальных клеточных генов — протоонкогенов. Сейчас открыто более 20 таких генов. Они активируются при точечной мутации, которая изменяет их нормальную функцию либо приводит к перестройке генотипа, нарушающей экспрессию генов (табл.10-1).
Некоторые протоонкогены участвуют в передаче сигналов между клеточной мембраной и ядром. Например, часть онкогенов является факторами клеточного роста, и при нарушении их регуляции происходит постоянная стимуляция тех или иных процессов. Другие протоонкогены — это рецепторы для факторов тканевого роста. Наиболее полно изучены RAS-онкогены и связанные с ними гены, участвующие в передаче сигналов между клеточной мембраной и ядром. Эти гены активируются при точечной мутации, что приводит к постоянной активации белков-передатчиков сигнала вне зависимости от наличия соответствующего лиганда или рецептора. Часть проонкогенов является факторами транскрипции и, взаимодействуя с ДНК, регулирует транскрипцию генов.
Супрессоры опухолевых генов. При раке толстой и прямой кишки отмечаются большие потери генетического материала. Эти участки выпадения ("горячие" локусы) являются местами сосредоточения супрессивных генов, потеря которых и приводит к развитию рака толстой кишки. Наиболее важный из них — ген р53, в норме предотвращающий начало нового периода синтеза ДНК и деления клетки.
Таблица 10-1. функции клеточных онкогенов


Из: Hunter T. Cooperation between oncogenes. Cell, 64: 249, 1991
Регуляторный ген (р53), предотвращающий излишнюю пролиферацию клеток, служит супрессивным геном для опухолевых клеток. Характерно, что активация супрессорных генов происходит в два этапа. В ядре клетки существует по две копии любого гена. Супрессивные гены обладают так называемым "доминирующим" действием, когда для супрессии пролиферации клеток достаточно лишь одной полной копии гена. Теория супрессорных генов согласуется с теорией наследственной предрасположенности к возникновению рака. Инактивация одной из двух аллелей может быть фенотипически "немой" (т. е. не происходит развития злокачественного фенотипа), если достаточно одной (второй) аллели для сохранения незлокачественного фенотипа клеток. Но у таких людей особенно высок риск развития рака, т. к. при одной лишь мутации супрессорных генов клетки трансформируются в раковые. В таблице 10-2 приведены наиболее важные гены тканевой супрессии (TSGs).
Образование запретных клонов. Большинство генетических исследований подтверждают, что опухоль развивается из одной клетки. Принятая в настоящее время теория многоступенчатого канцерогенеза гласит, что эпителий желудочно-кишечного тракта подвергается воздействию вредных факторов окружающей среды. Вследствие этого происходит постепенное повреждение ДНК с накоплением генетических мутаций. При этом мутации обычно возникают в участках ДНК, ответственных за выживаемость и рост клетки. Многие из них способны ингибировать процессы, необходимые для жизнедеятельности клетки, и тем самым привести ее к гибели. Некоторые мутации могут усиливать рост и выживаемость мутированных клеток, позволяя им размножаться быстрее, чем окружающие их клетки. В конце концов мутированные клетки начинают составлять большую часть органа или ткани. Часть мутированных клеток теряет способность исправлять повреждения ДНК, и, следовательно, из поколения в поколение происходит накопление мутаций. Этот пул клеток также подвержен дополнительным мутациям.
Периодически отдельные клетки мутантного клона подвергаются дополнительной мутации, повышающей их выживаемость и способность к росту. Такие клетки постепенно вытесняют из популяции родительские клетки. Увеличение клона мутированных клеток обычно происходит при появлении новых мутаций, которые увеличивают выживаемость клетки. При наблюдении за развитием опухоли на ранней стадии в клетках выявляется определенное количество мутаций, число которых возрастает с течением времени. На Рис. 10-1 показана прогрессия опухоли на фоне появления клонов с новыми характеристиками.
Таблица 10-2. примеры генов, подавляющих рост опухоли У человека
|
|
Соматические мутации |
Врожденные мутации |
|||||
|
Ген-супрессор опухоли |
Локус хромосомы |
Локализация/ предположительная функция |
Основные типы |
Примеры опухолей |
Синдром |
Количество гетерозигот на 105новорожденных |
Типичные опухоли |
|
р53 |
17р13.1 |
Ядро/фактор транскрипции |
Отсутствует |
Большинство типов рака у человека |
Синдром Ли-Фраумени |
~2 |
Карциномы груди, коры надпочечников, саркомы, лейкемия, опухоли мозга |
|
RB1 |
13q14 |
Ядро/модификатор транскрипции |
Делеция и незначимая мутация |
Ретинобластома, остеосаркома, карцинома молочной железы, простаты, мочевого пузыря, легкого |
Ретинобластома |
~2 |
Ретинобластома, остеосаркома |
|
АРС |
5q21 |
Цитоплазма/ неизвестно |
Делеция и незначимая мутация |
Карцинома толстой кишки, желудка, поджелудочной железы |
Наследственный аденоматозный полипоз толстой кишки |
-10 |
Карциномы толстой кишки, щитовидной железы, желудка |
|
WT1 |
11р13 |
Ядро/фактор |
Отсутствует |
Опухоль Вильмса |
Опухоль Вильмса |
-0.5-1 |
Опухоль Вильмса |
|
NF1 |
17q11 |
транскрипцииЦитоплазма/ГТФ активирующий |
Делеция |
Шванномы |
Нейрофиброматоз (тип 1) |
-30 |
Нейрональные опухоли |
|
NF2 |
22q |
факторЦитоплазма/ мембранные свя |
Делеция и незначимая мутация |
Шванномы и менингиомы |
Нейрофиброматоз (тип 2) |
-3 |
Центральные шванномы и менингиомы |
|
VHL |
Зр25 |
зи цитоскелета Неизвестно |
Делеция |
Неизвестно |
Болезнь ван Хип-пель-Ландау |
-3 |
Гемангиобластома, почечно-клеточная карцинома |
Многоступенчатый канцерогенез. Концепция генетической основы развития рака толстой кишки была разработана Vogelstein с соавторами. Согласно этой концепции процесс протекает медленно, и в него вовлечено множество генов.
Количество генетических повреждений опухолей постепенно увеличивается по мере роста. Часть повреждений появляется только на ранних стадиях, часть — только на поздних. Еще до конца не ясна последовательность появления опреде-
Рис. 10-1. Опухолевый рост. На данной схеме представлена типичная последовательность канцерогенеза. На первой стадии показано действие канцерогена. После накопления критической массы мутировапных генов (единой точки зрения на их количество и локализацию нет) клетка превращается в опухолевую. На второй стадии происходит разрастание клона мутировавших клеток с формированием доброкачественной опухоли. Без каких-либо дополнительных воздействий доброкачественная опухоль способна сохранять свою доброкачественность. Но при дополнительном воздействии она трансформируется в злокачественную и приобретает способность к инвазивному росту и метастазированию (стадия 3). Не существует единой точки зрения на природу этого воздействия. Злокачественная опухоль склонна к инвазивному росту с повреждением органов хозяина. Генотип злокачественных клеток очень нестабилен, поэтому их клон оказывается гетерогенным (стадии 4 и 5). Клинически такая гетерогенность приводит к формированию отдаленных метастазов. (Но: Yamada Т., Alpers D. H., Owyang С., Роwell D. W., Silverstein F. E., cds. Textbook of Gastroenterology, 2nded. Philadelphia: J. B. Lippincott, 1995:586.)
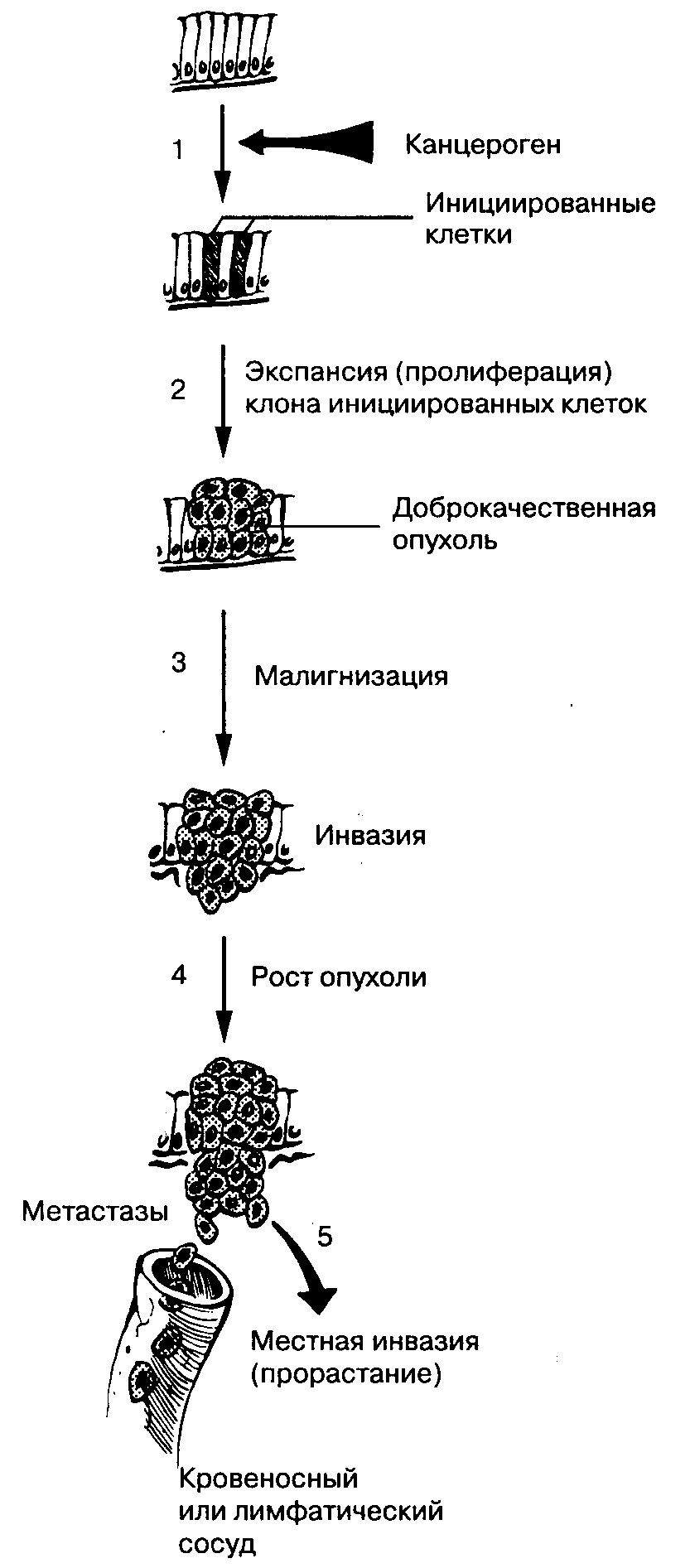

Рис. 10-2. Схема последовательных генетических изменений в многоступенчатом канцерогенезе при раке толстой кишки с дополнениями по Fearon, Vogelstcin. Сверху над схемой показаны мутации, ведущие к потере гетерозиготности (П1), лежащие в основе развития колоректального рака
ленных повреждений в опухолевых клетках, но уже выяснено, что при различных типах рака возможны разные мутации и хромосомные делеции. Для выявления потери участков хромосом используются лабораторные методы, а процесс утраты генетической информации был назван "потерей гетерозиготности".
В ходе своего развития опухолевая клетка кишечника человека претерпевает определенные изменения (рис. 10-2). Гипометилирование ДНК происходит на ранних стадиях возникновения канцерогенеза в аденомах. В клетках небольших аденом могут происходить как мутации, так и выпадения участков хромосом, например изменения на 5q хромосоме при аденоматозном полипозе кишки. Обнаруживаемые в крупных аденоматозных полипах мутации генов K-RASvip53 играют заметную роль в поддержании опухолевого роста. Делеции генов супрессоров опухолевого роста на 18q (встречается при раке толстой кишки) и 17р (локус гена р53) происходят на поздних стадиях и означают малигнизацию процесса. Несмотря на наличие сходства канцерогенеза в толстой кишке и в других отделах желудочно-кишечного тракта, последовательность изменений, а также вовлеченные в процесс гены различны. Детали этих процессов только начинают исследоваться.
Механизмы, замедляющие опухолевую прогрессию. В происхождении опухолей толстой кишки, помимо выпадения супрессорных генов, задействованы и другие механизмы генетических изменений. Микросателлиты — участки ДНК, используемые для картирования генов хромосом. Обычно микросателлиты полностью копируются при репликации клеток, но в некоторых опухолевых клетках отмечается незначительное изменение их длины. Микросателлиты в геноме могут иметь до 103 копий. Было замечено, что в некоторых случаях рака толстой кишки эти микросателлиты копируются не полностью. Наличие "нестабильных" микросателлитов в геноме опухолевых клеток говорит об утрате ими способности адекватно копировать гены. Такое нарушение процессов исправления мутаций считается еще одним механизмом канцерогенеза. Примерная схема этого механизма приведена на Рис. 10-3.
