
Практична мікробіологія - Климнюк С. І. - 2004
.pdf
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
241 |
Для виявлення капсулоутворення кращими способамиєзараження білихмишейз наступнимзабарвленняммазків-відбитківізорганівтапосівинаспеціальнийелек- тивний агар Буза (Венгрія) і Томова (Болгарія) або на середовище, що містить розчин Хенкса і 40 % стерильної бичачої сироватки. Посіви вирощують в атмосфері 20-40 % CO2. Наступного дня 2-3 підозрілі колонії після мікроскопії відсівають на скошений МПА для виділення чистої культури.
Тварини гинуть через 24-36 год від гострої септицемії, проводять їх розтин, роблятьпосівиізкрові, селезінкитадосліджуютьмазки-відбиткияквищеописано.
На 3-й день дослідження знову заражають білих мишей, але вже чистою культурою, проводятьдодатковіпосівиівиконуютьтестидляїїостаточноїідентифікації та диференціації від антракоїдів і деяких бацил грунту. При цьому враховують головні й додаткові ознаки. До головних критеріїв відносять специфічну патогенність, капсулоутворення, тест“перлинногонамиста” насередовищізпеніциліном, лізис специфічним фагом, люмінесцентно-серологічний тест. Додатковими ознаками є лецитиназна активність, відсутність рухливості та гемолізу (табл. 53)
|
|
|
|
|
|
|
|
Таблиця 53 |
|
Диференціальні ознаки збудника сибірки і грунтових бацил |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Наяв- |
Пато- |
Лізис |
Тест |
Люмінес- |
|
|
|
|
|
специ- |
"перлин- |
центно- |
Рухли- |
Гемо- |
Леци- |
Фос- |
||
Вид |
ність |
ген- |
фічним |
ного |
серологіч- |
вість |
ліз |
тиназа |
фатаза |
|
капсули |
ність |
фагом |
намиста" |
ний тест |
|
|
|
|
B. anthracis |
+ |
+ |
+ |
+ |
+ |
– |
– |
– |
– |
B. anthracoides |
– |
– |
– |
– |
– |
± |
+ |
+ |
+ |
B. subtilis |
– |
– |
– |
– |
– |
± |
+ |
+ |
+ |
B. megaterium |
– |
– |
– |
– |
– |
± |
– |
+ |
+ |
B. cereus |
– |
– |
– |
– |
– |
± |
– |
+ |
+ |
Специфічну патогенність визначають введенням білим мишам 0,2 мл суспензії культури. Виявлення у мазках-відбитках із органів загиблих тварин крупних паличок, оточених капсулою, свідчить про наявність у мікробів специфічної патогенності (див. вкл., рис. 16). При зараженні мишей занадто великими дозами культур грунтових бацил у тварин інколи наступає захворювання, але феномен капсулоутвореннявідсутній.
Тест“перлинногонамиста” проводятьтак. ДобульйонуХоттінгеразкінською сироваткою (30 %) добавляють пеніцилін у кількості 0,5 ОД/мл і сіють 2 краплі молодої виділеної культури. Через 3 год росту в термостаті виготовляють мазки, забарвлюють метиленовим синім і мікроскопують. Сибіркові бацили розташовуються у вигляді ланцюжків із кулястих форм, що нагадують намисто з перлин. Сапрофітні грунтові бацили, нечутливі до пеніциліну, ростуть як звичайно, і в мазках виявляють паличкоподібні ланцюжки.
Для виявлення фаголізабельності виділених штамів на підсушений МПА в чашці Петрі з розкресленим на квадрати дном бактеріологічною петлею діаметром5 ммнакоженквадратнаносятьвеликукраплю5-6 – годинноїкультури. Чашку знову підсушують 30 хв і потім на центр кожної бляшки культури петлею діа-
242 |
Частина ІІІ. Спеціальна мікробіологія |
метром 2 мм наносять маленьку краплю специфічного сибіркового бактеріофагу. Облік результатів проводять через 5-6 год інкубації при 37 °С. Якщо культура належить доB. athracis, умісцінанесеннянанеїфагувиднолізисувиглядістерильної плямки. Жоден вид сапрофітних бацил нечутливий до дії специфічного фагу.
Швидко ідентифікувати виділену культуру можна також за допомогою діагностичної сибіркової сироватки, міченої флуоресцеїном (родаміном). Мазок із капсульноїкультурифіксуютьметанолом, потімпротягом20 хвобробляютьлюмінесцентною сироваткою, промивають буферним розчином, висушують і мікроскопуютьпідлюмінесцентниммікроскопом. Умазкахнавколоклітинізкапсулою спостерігається специфічне світіння у вигляді яскраво-зелених обідків. Тепер частіше використовують непрямий варіант РІФ.
Відсутність рухливості виявляють методом надавленої (висячої) краплі або посівом уколом у пробірку з напіврідким агаром, а відсутність гемолізу встановлюють після посіву на кров’яний агар. Проби на лецитиназу і фосфатазу проводять за допомогою загальноприйнятих методик.
Отже, великі грампозитивні нерухливі палички з капсулами, що ростуть у вигляді характерних R-форм колоній, високопатогенні для експериментальних тварин, даютьтест “перлинного намиста”, яскраво світятьсяприобробцісибірковою люмінесцентною сироваткою, ідентифікують як B. anthracis.
У тих випадках, коли виділити збудника з досліджуваного матеріалу дуже важкоабовзагалінеможливо(трупи тварин, шкіра, хутро, шерсть, вовна), атакож приконтролітваринноїсировининадеякихвиробництвах, широковикористовують дуже чутливу й специфічну реакцію термокільцепреципітації Асколі. Вона дає змогу виявляти в матеріалі навіть незначну кількість антигена сибіркових бацил.
Термостабільний антиген із досліджуваних матеріалів екстрагують кип’ятінням або “холодним” способом. Спочатку матеріал подрібнюють, потім заливають 10-кратним об’ємом 0,85 % розчину хлориду натрію, кип’ятять 10-15 хв, фільтруютьчерезазбестовувату. Удеякихвипадкахматеріалзаливаютьпотрійним об’ємом 0,5 % розчину оцтової кислоти. При цьому проходить більш повноцінне екстрагування антигену.
“Холодний” метод частіше застосовують при масовому обстежені шкір та іншоїсировини. Пробиматеріалустерилізуютьуавтоклаві, подрібнюють, залива- ють10-кратнимоб’ємомізотонічногорозчинуізалишаютьпритемпературі6-16 °С на20-24 год, фільтруютьтаксамо. Увсіхвипадкахантигенмаєбутимаксимально прозорим.
Другий компонент реакції – преципітуючу сироватку – отримують шляхом гіперімунізації коней вакциною СТІ або вбитою культурою B. anthracis.
У преципітаційні пробірки вносять 0,2-0,3 мл преципітуючої сироватки, а потім обережно нашаровують 0,3 мл термоекстракту. На межі двох рідин утворюється через 2-5 хв тонке кільце преципітату білуватого кольору (помутніння рідини). Появу осадучерез10 хввважаютьнеспецифічноюреакцією. Паралельно ставлять декілька контролів: преципітуюча сироватка + позитивний естракт; преципітуюча сироватка + естракт із несибіркового матеріалу; преципітуюча сиро-
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
243 |
ватка + ізотонічний розчин; нормальна сироватка + термоестракт та ін. Перший контроль має бути завжди позитивний, всі інші – негативними.
Серологічна діагностика сибірки проводиться рідко, переважно в таких випадках, коли збудника хвороби виділити не вдається. Для виявлення антитіл у сироватцікровіхворихвикористовуютьтаківисокочутливіметоди, якРНГА, ІФА, реакція коаглютинації з протективним сибірковим антигеном.
Алергічний метод. Організм хворої і перехворілої на сибірку людини, а також після вакцинації реагує місцевою алергічноюреакцією на внутрішньошкірне введення алергену. Стан сенсибілізації виникає вже на 4-5 день хвороби і зберігається дужедовго. Алергеном для постановки проби служить антраксин– білко- во-полісахаридний комплекс, отриманий шляхом гідролізу вегетативних форм сибіркових бацил. Препарат вводять внутрішньошкірно на долонній поверхні передпліччявоб’ємі0,1 мл. Результатвраховуютьчерез24 і48 год. Пробу вважають позитивною при виникненні гіперемії та інфільтрату діаметром понад 15 мм.
Мікробіологічна діагностика анаеробних інфекцій
Допершоїгрупипатогенниханаеробнихмікроорганізмівналежатьзбудники правця, ботулізму, анаеробноїгазовоїінфекції, псевдомембранозногоколіту таін. Це великі грампозитивні паличкоподібні бацили, що утворюють термінальні або субтермінальні спори і виділяють сильні екзотоксини. Всі вони входять до роду Clostridium родини Bacillaceae. Захворювання, які вони викликають, називають тепер загальною назвою клостридіози.
Другу групу строгих анаеробів складають безспорові бактерії родів Bacteroides, Fusobacterium, Propionibacterium, Veillonella, Peptococcus і Peptostreptococcus. Вони здатні викликати у людини гнійно-запальні і некротичні процеси різноманітної локалізації.
Ботулізм
Ботулізм – тяжка, часто фатальна токсикоінфекція, яка виникає внаслідок вживання продуктів, що містять токсини Clostridium botulinum, супроводжується специфічними ураженняминервовоїсистеми, переважно ядер язиково-гортанних і окуломоторних нервів. Інколихвороба розвивається після інфікування ран клостридіями ботулізму.
C. botulinum продукує 8 типів сильних токсинів: А, В, С1, С2, D, Е, F, G, які відрізняються антигенною специфічністю, що необхідно враховувати при проведеннілабораторноїдіагностикиілікуванні. Ботулізм улюдейвикликаютьтипиА, В, Е і F, типи С іD – у ссавців і птахів. Патогенність типу G для людини і тварин не доведена.
Основнимрезервуароміджереломінфекціївприродієтеплокровнітравоїдні тварини, в кишечнику яких клостридії розмножуються і з фекаліями у великій кількості потрапляють у грунт і воду. Тут вони перетворюються в спори і дуже
244 |
Частина ІІІ. Спеціальна мікробіологія |
довго зберігаються. Захворювання виникає при споживанні в їжу м’ясних, рибних та інших, переважно консервованих продуктів, у яких нагромаджуються клостридіїботулізмутаїхтоксини. Небезпечнимиєконсервованіпродуктидомашнього приготування, особливо гриби.
Лабораторна діагностика ботулізму спрямована на виявлення токсину в матеріалах, взятих у хворих, атакож харчових продуктах, що спричинили отруєння. Токсин визначають шляхом постановки біопроби і встановлення його типу в реакції нейтралізації. Значно рідше виділяють чисту культуру збудника і проводять серологічні дослідження.
Взяття матеріалу. В усіх випадках захворювань із симптомами ботулізму ухворихобов’язково берутьпромивніводишлунка, блювотнімаси, кров, фекалії, сечу; від трупа – вміст шлунка і кишок, лімфатичні вузли, шматочки печінки, головного і спинного мозку. Необхідно досліджувати і залишки підозрілої їжі.
Кров у хворого в кількості 10 мл беруть до введення ботулінових лікувальних сироваток у пробірку з лимоннокислим натрієм у співвідношенні 3:1. Промивніводишлунка, блювотнімаси(100-200 мл) тавипорожнення(50-60 г) вміщуютьусклянібанкизгумовимикорками. Консервуючіречовинидобавлятинеможна. При взятті секційного матеріалу 50-60 г кожного органу вміщують у окрему банку. Залишки їжі відбирають по 200-300 г.
Щільні матеріали спочатку розтирають у ступках, вносять подвійний об’єм ізотонічного або желатино-фосфатного розчину і залишають при кімнатній температуріна2 годдляекстрагуваннятоксину. Екстрактцентрифугують, рідинунад осадом використовують для поставки біологічної проби. Кров вводять без будьякої обробки.
Проби, щодоставленідолабораторії, досліджуютьодночасноудвохнапрямках: 1) для виявлення ботулотоксинів; 2) з метою виділення C. botulinum. Одночасно в тих же пробах вияляють і C. perfringens.
Виявлення ботулінових токсинів. Наявність ботулінового токсину в досліджуваному матеріаліівизначенняйоготипупроводятьзадопомогоюреакціїнейтралізації на білих мишах. Для цього відбирають 5 пар мишей вагою 16-18 г на кожнупробу. Вреакціївикористовуютьдіагностичні(нелікувальні!) антитоксичні ботулінові сироватки типів A, B, E, F, які розводять 0,85 % розчином хлориду натрію до 100-200 МО/мл, що забезпечує нейтралізацію гомологічного токсину в досліджуваній пробі.
Центрифугатдоставленихматеріалівабокровхворогорозливаютьпо1,4 млу 5 пробірок. У перші чотири з них вносять по 0,6 мл (200 МО/мл) антитоксичних протиботулінових сироваток відповідно типів A, B, E і F. У останню пробірку добавляють 0,6 мл нормальної сироватки. Всі пробірки витримують 40 хв при кімнатнійтемпературідлянейтралізаціїтоксину. По1-мумлсумішізкожноїпробір- кивводятьп’ятипараммишей(центрифугат+ сироватки– підшкірно, кров+ сироватки – в черевну порожнину). За тваринами спостерігають протягом 3-4-х днів.
Принаявностівдосліджуваномуматеріаліботуліновоготоксинугинутьчотирипаримишей, окрімдвох, якимбулавведенасумішматеріалузтимтипомсироват-
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
245 |
ки, що нейтралізувала дію гомологічного типу токсину. При загибелі всіх мишей пробу треба повторити з розведеним в 10, 20, 100 разів біологічним матеріалом.
Постановкареакціїнейтралізаціїзвизначеннямтипуботулотоксинумаєважливе значення при виборі відповідної сироватки для специфічного лікування ботулізму. Тому при видачі відповіді про виявлення ботуліновоготоксину лабораторія повинна обов’язково вказувати його тип.
Якщо бактеріологічна лабораторія має типові антитоксичні ботулінові еритроцитарнідіагностикуми, серотиптоксинукращевизначатизадопомогоюреакції непрямоїгемаглютинації. Вонависокоспецифічна, чутлива, значноекономічніша, швидше дає результат, ніж реакція нейтралізації in vivo. Для виявлення збудника ботулізмучийоготоксинуможнатакожзастосовуватиметодІФАтаімуноелектрофорезу.
ПрофесорС.М. Мінервінійогоспівробітникиу1959 р. розробилиприскорений методдіагностики ботулізмузадопомогоювизначення фагоцитарногопоказника. Він грунтується на тому, що ботулотоксини різко пригнічують фагоцитарну функцію лейкоцитів. Гомологічна антитоксична ботулінова сироватка нейтралізує лейкотоксичну дію екзотоксину, чого немає при дії гетерологічних сироваток.
Дослідставлятьізвикористанняммікродозкомпонентів. У5 маленькихпробірок вносять піпеткою Панченкова по одному об’єму лимоннокислого натрію (1/4 поділок піпетки до мітки 75) і по два об’єми крові хворого. Потім у пробірку № 1 добавляють один об’єм 0,85 % розчину хлориду натрію, а в пробірки № 2, 3, 4 і 5 – відповідні діагностичні ботулінові сироватки типів A, B, E, F у тому ж об’ємі. Після перемішування всіх компонентів пробірки ставлять у термостат на 30 хв для нейтралізації можливого токсину в крові хворого гомологічною сироваткою і в усі пробірки вносять по одному об’єму 1 млрд зависі культури золотистогостафілокока і знову вміщують у термостат на 20 хв для завершення процесу фагоцитозу. Із вмісту кожної пробірки готують мазки, фарбують за Романовсь- ким-Гімзою і визначають фагоцитарний показник. Для цього підраховують кількістьпоглиненихкоківу50 полінуклерахіділятьотриманечислона50. Якщо в крові хворого є токсин, то фагоцитарні показники в усіх пробах крові будуть низькі, за винятком показника в тій пробірці, де тип токсину і сироватки гомологічні. У тяжких випадках ботулізму фагоцитарний показник може падати до нуля. Гомологічна сироватка, нейтралізуючи токсин, відновлює цей показник до норми. Метод не можна використовувати для виявлення ботулотоксину в харчових продуктах і секційному матеріалі.
Виділення культур C. botulinum. До посіву досліджуваний матеріал емульгують у фарфорових ступках як вище вказано. По 10 мл матеріалу сіють у 4 фла- кониз75-150 млсвіжорегенерованогорідкогосередовища(Кітта-Тароцці, Хоттінгера, казеїново-грибного). Два флакони прогрівають: один при 60 °С протягом 15 хв (для селекції C. botulinum типу Е), другий – 20 хв при 80 °С. Два флакони інкубують при 28 °С (для типів E і F) решту – при 35 °С в анаеростаті або під шаром вазелінового масла товщиною 0,5 см. На 2, 4, 6 і 10-й день із флаконів, де є ріст, виготовляютьмазки, забарвлюютьзаГрамомімікроскопують. Збудникботу-

246 |
Частина ІІІ. Спеціальна мікробіологія |
лізму має вигляд крупних грампозитивних паличок із овальною субтермінальною спорою, що нагадують тенісні ракетки (рис. 72).
Щоб визначити тип ботулотоксину з флакона відбирають 10-15 мл культуральної рідини, центрифугують її і ставлятьреакцію нейтралізації набілих мишахабоРНГАзтиповимиботуліновимисироватками, як вище описано.
Для отримання ізольованих колоній з метою виділення чистої культури краплю культуральної
Рис 72. C. botulinum. рідини з флакона вносять на поверхню анаеробного кров’яного або печінкового агару і втирають скля-
ним шпателем в агар послідовно в трьох чашках. Посіви вирощують в анаеростатах. Через 48 год інкубації вивчають характер колоній. На кров’яному агарі колонії можуть бути неправильної форми з фестончастими краями, або гладенькі, круглі, із зонами гемолізу навколо них. Різні типиC. botulinum можуть утворювати неоднакові колонії. При посіві уколом у високий стовпчик цукрового агару колонії мають вигляд чечевичок або жмуточків вати.
Після мікроскопування типових колоній їх відсівають на середовище КіттаТароцці, отримуютьчистукультурутаідентифікуютьїїзаморфологічними, культуральними, токсигенними та біохімічними властивостями шляхом посіву в середовищаГісса. Паличкиботулізмуферментуютьглюкозу, галактозу, гліцерин, мальтозу, сахарозу, фруктозу до кислоти і газу, розріджують желатин, виділяють H2S, не утворюють індол. Для диференціації C. botulinum від інших анаеробів використовують і інші тести (табл. 54).
Диференціальна характеристика анаеробних мікроорганізмів |
Таблиця 54 |
||||||||
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Вид |
Рухли- |
Леци- |
Ліпаза |
|
Ферментація |
|
Індол |
||
вість |
тіназа |
Глюкоза |
|
Лактоза |
|
Маніт |
|||
|
|
|
|
|
|||||
С. botulinum |
+ |
- |
+ |
+ |
|
- |
|
- |
- |
C. difficile |
± |
- |
- |
+ |
|
- |
|
+ |
- |
C. histolyticum |
+ |
- |
- |
- |
|
- |
|
- |
- |
C. novyi |
+ |
+ |
+ |
+ |
|
- |
|
- |
- |
C. perfringens |
- |
+ |
- |
+ |
|
+ |
|
- |
- |
C. septicum |
+ |
- |
- |
+ |
|
+ |
|
- |
- |
C. sordellii |
+ |
+ |
- |
+ |
|
- |
|
- |
+ |
C. sporogens |
+ |
- |
+ |
+ |
|
- |
|
- |
- |
C. tetani |
+ |
- |
± |
- |
|
- |
|
- |
± |
Визначення сероварів збудника ботулізму здійснюють за допомогою реакції нейтралізації токсину in vivo, методом ІФА або в РНГА.
МетодикавиділенняC. perfingens прихарчовихотруєнняхвикладенаврозділі анаеробної газової інфекції.
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
247 |
Правець
Правець (стовбняк) – гостра ранова інфекція людей і тварин, що розвивається в результаті ураження токсином нейромоторних клітин спинного і головного мозку, проявляється розвитком тонічних і тетанічних скорочень м’язів. Збудник – Clostridium tetani – тонкий, довгий, рухливий мікроб із термінальною круглою спорою, яка надає йому вигляд барабанної палички. Вона має О- і Н-антигени, за характером яких збудник правця поділяють на 10 серотипів, але всі вони виділяють однаковий, тотожний токсин.
Джерелом правцевих клостридій є тварини (вівці, коні, кози, корови, свині), у кишечнику яких вони постійно знаходяться у складі нормальної мікрофлори. Із фекаліями тварин мікроби потрапляють у грунт, переходять у спорову форму і зберігаються роками. Хвороба розвивається лише тоді, коли збудник проникає в організм через ушкоджену шкіру, м’язи, слизову оболонку при пораненнях, ін’єкціях, опіках, обмороженнях, пролежнях тощо.
Мікробіологічні дослідження з метою діагностики правця проводять рідко. Клінічна картина хвороби настільки характерна, що необхідність вдаватись до бактеріологічної діагностики просто відпадає. Лише у випадках нетипового або летального її перебігу, при розвитку правця після підпільних абортів чи пологів у домашніхумовах, атакожколивиникаєправецьновонароджених, такідослідження необхідно рекомендувати. Значно частіше проводять виявлення C. tetani у шовних і перев’язувальних матеріалах, лікарських препаратах для парентерального введення, у пробах грунтів тих регіонів, де реєструється висока захворюваність на стовбняк.
Взяття матеріалу. Від хворих на дослідження беруть гній, рановий вміст, ексудат, шматочки некротизованих тканин, тампони з рани, сторонні тіла; від померлих– кров, рановийвміст, старірубці, селезінку. Увипадкахвиникненняправця після абортів і пологів досліджують виділення та біоптати з вагіни і матки; при захворюванні новонароджених – виділення з пупка. Всі матеріали негайно направляютьдобактеріологічноїлабораторіїкращевспеціальнихтранспортних середовищах, захистивши їх від згубної дії кисню повітря.
Первинна бактеріоскопія. Із патологічного або секційного матеріалів виго- товляютьдекількамазківтапрепаратів-відбитків, забарвлюютьзаГрамом, Ожешко (длявиявлення спор) і мікроскопують під імерсійною системою. Наявність у мазках довгих грампозитивних паличок з круглими термінальними спорами при відповіднійклінічнійкартинідаєзмогузапідозритиприсутністьC. tetani (рис. 73).
Але на основі лише мікроскопічного дослідження не можна робити висновок, оскільки в матеріалі можуть бути подібні за морфологією непатогенні мікро-
організми (C. pseudotetanicum, C. tetanomorphum).
Бактеріологічнеібіологічнедослідження. Отриманийвлабораторіїматері-
ал розтирають у стерильних ступках із піском, добавляючи середовище для контролю стерильностідоотримання 10 % суспензії. Рідку фазу матеріалу розділяють на дві рівні частини, одну з яких прогрівають при 80 °С протягом 20 хв. Це при-

248 Частина ІІІ. Спеціальна мікробіологія
|
зводить до загибелі вегетативних клітин бактерій і |
|
|
значно підвищує шанси на виділення C. tetani. Далі |
|
|
грітийінегрітийматеріал досліджуютьпаралельно. |
|
|
Для нагромадження анаеробних клостридій |
|
|
обидві порції висівають у дві пробірки з середови- |
|
|
щем Кітта-Тароцці (або тіогліколевим бульйоном). |
|
|
Одночасно для отримання ізольованих колоній роб- |
|
|
лятьпосівначашкузанаеробнимкров’янимагаром |
|
|
такого складу: до еритрит-агару добавляють 10 % |
|
|
середовища 199, 10 мкг/мл метадіону, 10 мкг/мл ге- |
|
Рис. 73. C. tetani. |
міну, 10 мг/мл цистину, 0,1 % твіну – 80 і 5 % дефіб- |
|
ринованої крові барана або кролика. При сильному |
||
|
забрудненні проб сторонньою мікрофлорою до агару ще додають неоміцин, гентаміцин або налідиксову кислоту в кількості 40-50 мкг/мл.
Посіви інкубують в анаеробних умовах при температурі 37 °С протягом 48-72 год. КолоніїC. tetani на кров’яному агарі плоскі, напівпрозорі, з нерівними краями, нерідко у вигляді переплетених ниток, що нагадують павучків. Навколо колоній виникає зона гемолізу (рис. 74). Якщо колонії відсутні, роблять висів із середовищнакопиченнянакров’янийагар. Припосівіуколомувисокийстовпчик цукрового агару колонії C. tetani нагадують хмаринки або жмуточки вати.
Виділену чисту культуру ідентифікують за морфологічними, культуральними ознаками і обов’язково шляхом визначення токсигенності, яка є вирішальним тестомпридіагностиціправця. Длявиявленнятоксичноїдіїкультуриабо первинного досліджуваного матеріалу ставлять біологічну пробу нейтралізації токсину правцевою сироваткою на тваринах.
Правцевий токсин отримують шляхом вирощування культури в середовищі Кітта-Тароцці протягом 2-3 діб з наступною фільтрацією або центрифугуванням бульйону. Двом білим мишам внутрішньом’язево (біля кореня хвоста) вводять по 0,5 млсумішіфільтратузправцевоюантитоксичноюсироваткою(200 МО). Суміш попередньо витримують у термостаті 40-60 хв. Спостереження замишами проводять протягом 4-5 діб. Якщо у фільтраті містився правцевий екзотоксин, заражені
миші гинуть при явищах висхідного правця. Конт-
|
рольні тварини залишаються живими. Аналогічно |
|
біопробуставлятьіздосліджуванимматеріалом(роз- |
|
тертівізотонічному розчині шматочки тканин, гній, |
|
ексудат тощо). Виникає така ж сама клінічна карти- |
|
на правця, як і після введення токсину, а антисиро- |
|
ватка нейтралізує присутній токсин. |
|
Для виявлення правцевоготоксину в середови- |
|
щах накопичення, а також для ідентифікації виділе- |
|
ної чистої культури C. tetani використовують |
|
високоспецифічну й більш економічну реакцію не- |
Рис.74. Колонії C. tetani. |
прямої гемаглютинації. У ряді лунок полістироло- |
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
249 |
воїпластинироблятьрозведеннякультуральноїрідинивбуферномурозчинізкролячою інактивованою сироваткою від 1:10 до 1:1280. Потім у кожну лунку вносять по 0,1 мл правцевого еритроцитарного антитільного діагностикуму (суспензіяеритроцитівбарана, сенсибілізованихправцевоюантитоксичноюсироваткою). Пластинизлункамивміщуютьутермостатна60 хв, потімзалишаютьприкімнатній температурі. Попередній результат враховують через3 год, остаточний – через 18 год. При наявності правцевого токсину в ряді лунок появляється феномен гемаглютинації.
ДляідентифікаціїC. tetani врізнихоб’єктахможнавикористовуватилюмінес- центно-серологічний метод, застосувавши протиправцеву антимікробну сироватку, мічену ізотіоціанатом флуоресцеїну, а також метод імуноферментного аналізу.
Спеціально для виділення чистої культури збудника правця Філдс запропонував оригінальний спосіб: кілька крапель прогрітого при 60 °С протягом 90 хв досліджуваного матеріалу або культури із рідкогосередовища накопичення сіють у конденсаційну рідину на дні пробірки зі скошеним кров’яним чи сироватковим агаром. Посів вирощують 18-24 год в умовах строгого анаеробіозу. Збудник правця завдяки своєму повзучому росту, обумовленому джгутиками, росте у вигляді тоненькоїплівкиповсій поверхнісередовища. Зверхньоїчастиниплівкироблять 3-5 таких пересівів до отримання чистої культури.
Серологічний метод діагностики правця практично не використовується. Лише для контролю ефективності вакцинації правцевим анатоксином (визначення рівня антитоксину в крові) вибірково проводять постановку реакції нейтралізації, РНГА, ІФА.
Ранова анаеробна газова інфекція
Анаеробнагазоваінфекція(клостридіальнийміозит, газовагангрена) – гостра, тяжка, поліетіологічна ранова інфекція, яку викликають бактерії родуClostridium в асоціації між собою і умовно-патогенними мікроорганізмами. Основними збуд-
никами захворювання є Clostridium perfrigens, C. novyi (oedematiens), C. septicum (див. вкл., рис. 17). ЗначнорідшезустрічаютьсяC. histolyticum, C.sordellіi, C. fallax.
Із аеробних бактерій у рановому вмісті виявляють протей, стафілококи, кишкові палички та ін. C. perfrigens може викликати харчові токсикоінфекції.
Вякостідосліджуваногоматеріалу берутьшматочки ураженихтканин, рановий вміст, eкcудат, випіт при набряках; при харчових токсикоінфеціях – блювотні маси, промивні води шлунка, випорожнення, кров, залишки підозрілої їжі. В разі необхідності досліджують перев’язувальний та шовний матеріал (шовк, кетгут), одяг, грунт, секційний матеріал (шматочки некротизованих тканин, печінки, селезінки). З метою попередження шкідливої дії кисню повітря на анаеробну мікрофлору тверді матеріали для дослідження краще брати у короткі пробірки, що герметично закриваються. Рідкі досліджувані матеріали можна набирати у шприц, на голку насадити гумовий корок і в такому вигляді транспортувати до лабораторії.
250 |
Частина ІІІ. Спеціальна мікробіологія |
Мікробіологічна діагностика газової гангрени зводиться до виділення чистих культур збудників, їхідентифікації на основі морфологічних, культуральних і біохімічних властивостей та визначення типів токсинів.
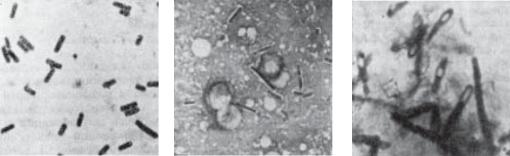
Бактеріоскопія є необхідним етапом для орієнтації в характері ранової мікрофлори. Для цього готують мазки-відбитки з уражених тканин, ексудату чи випоту, забарвлюють за Грамом або метиленовою синькою. Наявність у мазках великої кількості крупних грампозитивних паличок зі спорами чи капсулами (C. perfringens) або без них може служити ознакою можливого розвитку газової гангрени (рис. 75).
1 |
2 |
3 |
Рис. 75. C. Perfringens: 1 – вегетативні форми; 2 – капсули; 3 – спори.
З метою орієнтовної ідентифікації клостридій можна використати люмінес- центно-серологічнийметод, колимазкиобробляютьдіагностичнимифлуоресцентнимисироватками. Завидомсироватки, якавикликаєспецифічнесвітіннянавколо оболонок бактерій під люмінесцентним мікроскопом, визначають вид збудника.
Бактеріологічне дослідження. Рідкі досліджувані матеріали сіють у нативному вигляді. Шматочки уражених тканин та інші щільні матеріали спочатку гомогенізують у фарфорових ступках з піском, добавляючи рівний об’єм ізотонічногорозчинухлоридунатрію. Будь-якийматеріалрозділяютьна2 частини; одну з них прогрівають 20 хв при 80 °С, другу не піддають термічній обробці. Обидві проби паралельно висівають на спеціальні сердовища для культивування анаеробних мікроорганізмів.
Для первинного накопичення анаеробів широко використовують середови- щеКітта-Тароцці. НаньомуC. perfringens ростезінтенсивнимпомутніннямібурхливим газоутворенням. Інші види утворюють помутніння і менше виділення газу абобезнього(C. histolyticum). Припосівінастерильнезнежиренелакмусовемолоко C. perfringens вже через 4-5 год викликає його звудження з утворенням цегляного кольору губчастогозгустка, якийгазпідіймаєнаповерхнюпептонізованоїрідини.
Класичним середовищем для отримання ізольованих колоній є кров’яний цукровий агар Цейслера (до МПА додають 1,5 % дефібринованої крові і 2 % глюкози). Чашки з посівами вирощують в анаеростаті. На цьому агарі колонії основнихзбудниківмаютьгладенькудископодібнуформусіруватогокольорузрівними або бахромчастими краями і піднятим центром, оточені зоною гемолізу (рис. 76).
