
Практична мікробіологія - Климнюк С. І. - 2004
.pdf
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
211 |
куватііззазубренимикраями, інші– круглі, опуклі, звологимблиском. 3-4 колонії мікроскопують, досліджують на рухливість і пересівають на середовище Олькеницького для виділення чистої культури. Якщо на агарі Плоскирєва росту немає, або відсутні характерні колонії шигел, роблять висів із селенітового бульйону на агар Плоскирєва або Ендо. При достатній кількості типових колоній ставлятьорієнтовну реакцію аглютинації на склі з сумішшю сироваток Флекснера і Зонне.
На третій день враховують характер росту на середовищі Олькеницького. Шигеливикликаютьхарактернізмінитрицукровогоагару(жовтієстовпчик, колір скошеноїчастинкинезмінюється, почорніннявідсутнє). Підозрілукультурусіють в середовища Гіссадлявизначення біохімічнихвластивостей (табл. 41), або використовують ентеротести.
|
|
Біохімічні властивості шигел |
|
|
Таблиця 41 |
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Вид |
|
Ферментація вуглеводів |
|
|
Індол |
Каталаза |
|||
лактоза |
глюкоза |
мальтоза |
маніт |
дульцит |
сахароза |
||||
S. dysenteriaе |
- |
+ |
- |
- |
|
- |
- |
- |
- |
S. flexneri |
- |
+ |
+ |
+ |
|
+ |
- |
- |
- |
S. boydii |
- |
+ |
± |
+ |
|
+ |
- |
+ |
- |
S. sonnei |
+ |
+ |
+ |
+ |
|
- |
+ |
- |
+ |
|
повільно |
|
|
|
|
|
повільно |
|
|
Примітка: “+” – ферментація вуглеводів, утворення індолу, каталази; “–” – відсутність ознак
Серологічна ідентифікація виділених культур проводиться за допомогою реакції аглютинації на склі спочатку з сумішшю сироваток проти видів Флекснера і Зонне, які найчастіше зустрічаються, а потім із моновидовими та монорецепторними сироватками. Останнім часом випускають комерційні як полівалентні, так і моновалентні сироватки проти всіх видів збудників дизентерії.
Для визначення виду шигел використовують також реакцію коаглютинації. Вид збудника встановлюють за допомогою позитивної реакції з білком А золотистого стафілокока, на якому адсорбовані специфічні антитіла проти шигел. На типовуколоніюнаносятькраплюсенсибілізованогоантитіламипротеїнуА, похитують чашку й через 15 хв під мікроскопом спостерігають появу аглютинату. Реакцію коаглютинації можна ставити вже на другий день дослідження, якщо на середовищі є достатня кількість лактозонегативних колоній.
З метою швидкої і надійної ідентифікації шигел ставлять також пряму й непряму реакції імунофлуоресценції та ензиммічених антитіл. Остання при дизентерії є високоспецифічною і все частіше використовується при лабораторній діагностиці захворювання.
Для виявлення антигенів у крові хворих, у тому числі в складі циркулюючих імунних комплексів, можна використати реакцію агрегат-гемаглютинації та ме- тодІФА(діагностичнатест-система“Шигелапласт”). Антигенишигелувипорожненнях і сечі виявляють за допомогою РНГА, РЗК і коаглютинації. Ці методи високоефективні, специфічні й придатні для ранньої діагностики.
212 |
Частина ІІІ. Спеціальна мікробіологія |
|
Щоб встановити належність виділених культур до роду шигел ставлять та- |
кож кератокон’юнктивальну пробу на гвінейських свинках. У кон’юнктивальний мішоквносятьпетлюагаровоїкультуриабокраплюбульйонної. Важливонетравмувати при цьому рогівку. Свіжовиділені шигели викликають виражений кератит на2-5 добупіслявведеннякультури. Сальмонелитакожможутьвикликатикон’юнктивіт, але вони не уражають рогівку. Однак, слід пам’ятати, що ентероінвазивні кишкові палички (ЕІКП) особливо серовари 028, 029, 0124, 0143 та ін. також викликають експериментальний кератокон’юнктивіт у гвінейських свинок.
Бактеріологічний метод діагностики дизентерії є найдостовірнішим, але в різних лабораторіях (залежно від кваліфікації бактеріологів і лаборантів) він дає лише 50-70 % позитивних результатів. Окрім діагностики захворювань, бактеріологічне дослідження проводять також для виявлення бактеріоносіїв, особливо серед працівників продовольчих підприємств, дитячих установ і лікарняних закладів. З метою встановлення джерел інфекції визначають фаговари й коліциновари шигел.
Серологічну діагностику дизентерії проводять рідко. Інфекційний процес несупроводжується значним антигенним подразненням, тому титри антитіл у сироватці хворих і реконвалесцентів невисокі. Їх виявляють на 5-8 добу захворювання. Найбільше антитіл утворюється на 2-3-му тижні.
Об’ємну реакцію аглютинації з мікробними діагностикумами ставлять так само, якіреакціюВідаляпричеревномутифііпаратифах. Сироваткукровірозводять від 1:50 до 1:800. Діагностичним титром антитіл до S.flexneri у дорослих хворих вважають 1:200, до S.dysenteriaе і S.sonnei – 1:100 (у дітей відповідно –
1:100 і 1:50).
Більш достовірні результати отримують при постановці РНГА особливо при використанні методу парних сироваток. Діагностичне значення має збільшення титру в 4 і більше разів. Еритроцитарні діагностикуми виготовляють, в основно-
му, з антигенівS.flexneri та S.sonnei.
Допоміжне значення для діагностики має також постановка алергічної внутрішньошкірноїпробиздизентериномЦуверкалова(розчинбілковихфракційшигел Флекснера і Зонне). Вона стає позитивною у хворих на дизентерію, починаючи з 4-годня. Облікреакціїпроводятьчерез24 год. Припоявігіпереміїінабрякушкіри діаметром35 ммібільшереакціяоцінюєтьсяяксильнопозитивна, при20-34 мм – помірна і при 10-15 мм – сумнівна.
Клебсієльози
Клебсієльози – захворювання, які викликають бактерії роду Klebsiella. Вони можуть бути гострими і хронічними; гострі викликають Klebsiella pneumoniae, K.oxytoca, K.planticola, K.terrigena, хронічні– K.ozaenae i K.rhinoscleromatis. Най-
частіше запальні і септичні процеси викликає K.рneumoniae – пневмонії, бронхіти, септицемії, отити, перитоніти, інфекції жовчних і сечовивідних шляхів, харчові токсикоінфекції, госпітальні ранові та опікові інфекції тощо. Значно рідше
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
213 |
зустрічаються такі хронічні хвороби, як смердючий нежить (озена) і риносклерома. Останнім часом резистентні до антибіотиків штами клебсієл можуть стати збудниками внутрішньолікарняних інфекцій.
Основним методом лабораторної діагностики клебсієльозів є бактеріологічнедослідження. Серологічнийметодзастосовуютьрідко. Проводятьтакожмікроскопію мазків.
Матеріаломдлямікробіологічногоаналізуможебутихаркотиння, слизізрото-
іносоглотки, промивні води і блювотні маси, гній, кров, ліквор, сеча, жовч, випорожнення, секційний матеріал, інфільтрати слизової при риносклеромі, кірочки при озені, змиви з предметів тощо.
Бактеріоскопія. Умазках, забарвленихзаГрамом, капсульніформиклебсієл маютьвиглядграмнегативних, еліпсоподібних, товстихпаличокдовжиною5-8 мкм
ішириною 3-5 мкм (рис. 65). Безкапсульні форми мають менші розміри (0,3-0,6 × 1-3 мкм), поодиноке, парнеаболанцюжковерозташування. Угістологічнихзрізах із склеромних гранулем видно багато гігантських клітин Мікуліча, наповнених желатиноподібною масою, в якій знаходяться клебсієли, оточені капсулою.
Бактеріологічне дослідження проводять за такою ж схемою, що й при по-
дібнихзахворюваннях, викликанихіншимивидамиентеробактерій. Посівматеріалу роблять на селективне середовище К-2 (МПА з сечовиною, рафінозою, бромтімоловим синім). Через добу на ньому виростаютькрупні, опуклі, блискучі, слизуватіколоніїжовтого, зеленувато-жовтогоабоголубогокольору. Насередовищах Ендо і Плоскирєва більшість клебсієл утворюють колонії з металевим блиском, характерні для лактозопозитивних бактерій.
Напростомуабогліцериновомуагарічерез2-4 годвирощуванняосновнівиди клебсієл утворюють характерні колонії з різною внутрішньою структурою, що виявляють при агар-мікроскопії таких молодих колоній. У К. pneumoniаe вони мають петлеподібну будову, у K. rhinoskleromatis – концентричну, а у K. ozenae – розсіяно концентричну. Це дає змогу диференціювати названі види клебсієл між собою.
Зрілі колонії мікроскопують і відсівають на косий агар для виділення чистих
культур. Ідентифікацію останніх проводять по- |
|
сівом в середовища строкатого ряду Гісса, жовч- |
|
ний бульйон, визначають рухливість, наявність |
|
уреази. Клебсієлинерухомі, більшістьштамівроз- |
|
кладаютьглюкозу, лактозу, сахарозу, сечовину, да- |
|
ють позитивну реакцію Фогеса – Проскауера, не |
|
виділяють сірководень (табл. 42). |
|
Івсежосновноюйнадійнішоюєсерологічна |
|
ідентифікація клебсієл. Для її проведення викори- |
|
стовують дві реакції: капсульну аглютинацію на |
|
склі з живою культурою і О-аглютинацію. При |
|
постановці першої з них на предметне скло нано- |
Рис. 65. Клебсієли: |
сять діагностичні протиклебсієльозні капсульні |
мазок із чистої культури. |

214 |
|
|
|
|
Частина ІІІ. Спеціальна мікробіологія |
|||
|
Диференціальні ознаки клебсієл |
|
Таблиця 42 |
|||||
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Вид |
|
Ферментація |
|
|
Індол |
Реакція |
Утилі- |
|
Глю- |
Лак- |
Саха- |
Сечо- |
|
Фогеса- |
зація |
||
|
коза |
тоза |
роза |
вина |
|
|
Проскауера |
цитрату |
K.pneumoniae |
+ |
+ |
+ |
+ |
|
- |
+ |
+ |
K.oxytoca |
+ |
+ |
+ |
+ |
|
+ |
+ |
+ |
K.planticola |
+ |
+ |
+ |
+ |
|
± |
+ |
+ |
K.terrigena |
+ |
+ |
+ |
- |
|
- |
+ |
± |
K.ozaenae |
± |
± |
+ |
- |
|
- |
- |
± |
K.rhinoskleromatis |
± |
- |
± |
- |
|
- |
- |
- |
сироватки, а також краплю 0,9 % розчину хлориду натрію (контроль). Біля крапель сироваток та ізотонічного розчину розтирають повну петлю досліджуваної культури, змішують їх, добиваючись ретельної гомогенізації. При позитивному результатіутворюєтьсяаглютинатувиглядігрубихнитокаботяжів. Уконтрольній краплі аглютинації не повинно бути.
ДляО-аглютинаціївиділенікультуристерилізуютьвавтоклавіпротягом150 хв при2-охатм. Прицьомуруйнуєтьсякапсула, культураневзаємодієзК-сироватка- ми і аглютинується О-сироватками. Простерилізовану культуру потрібно двічі відмити у фізіологічному розчині шляхом центрифугування і з осадом поставити реакцію аглютинації на склі.
Із додаткових методів ідентифікації клебсієл використовують фаготипування. Фаги капсульних бактерій мають чітку видову специфічність. Техніка проведення реакції аглютинації та фаготипування детально викладена в інструкціях до відповідних препаратів.
Визначають також чутливість виділених культур до антибіотиків за допомогою дискодифузійного методу.
Серологічнідослідженняпроводятьшляхомпостановкирозгорнутоїреакції аглютинації з сироваткою крові хворих і капсульним та безкапсульним антигенами, а також зв’язування комплементу (титр 1:40 і вище) та більш чутливої і специфічноїреакціїнепрямоїгемаглютинаціїзеритроцитарнимклебсієльознимдіагностикумом. Дляпостановкиостанньоїсироваткухворихрозводятьулункахполістиролових планшет від 1:20 до 1:320 в об’ємі 0,25 мл і добавляють такий же об’єм1% зависісенсибілізованих еритроцитів. Облікрезультатівпроводятьчерез 2 год експозиції планшет при 37 °С. Діагностичний титр 1:160 і вище. Надійніше результати отримують при постановці реакції в динаміці, коли виявляють 4-крат- не наростання титру антитіл.
Холера
Холера – гостра, карантинна, особливо небезпечна інфекційна хвороба з фекально – оральним механізмом передачі, характеризується рясним поносом,
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
215 |
блюванням, сильною інтоксикацією та зневодненням організму. Збудниками захворювання є два біовари холерного вібріона Vibrio cholerae і Vibrio eltor. Обидва відносятьсядородуVibrio родиниVibrionaceae. Окрімцихзбудників, дородуVibrio відносятьсятакож умовно– патогеннівібріони: V.metschnikovii, V.parahaemolyticus, V.alginolyticus, V.vulnificus, V.fluvialis. За певних умов вони можуть викликати у людини гастроентерити.
Узяття і доставка матеріалів. Для мікробіологічного дослідження стерильною ложкою беруть випорожнення, блювотні маси, промивні води хворого в об’ємі 10-20 мл, переносять їх роздільно у стерильні скляні банки, закривають скляними чи гумовими пробками і заливають парафіном. Найкращі результати дає дослідження проб, взятих до початку антимікробної терапії.
Другу порцію випорожнень і блювотних мас в об’ємі 1-2 мл засівають біля ліжка хворогоу10-50 млтранспортногосередовища(1 % пептоннаводарН7,8 чи рН 9,3). Якщо випорожнень в момент забору матеріалу немає, вирізають забруднені фекаліями ділянки білизни. Досліджують також жовч, узяту за допомогою дуоденального зондування.
Під час епідемічного спалаху холери широко практикують ректальний забір. Дляцьогостерильнийватнийтампонабоалюмінієвупетлювводятьупрямукишку на глибину 5-19 см, забирають вміст і вносять у флакон або пробірку з 1 % лужною пептонною водою.
Від трупа беруть невеликі ділянки тонкої кишки з верхнього і нижнього відділу, які перев’язують з обох кінців лігатурами. Забирають також відрізок прямої кишкидовжиною10-15 см. Жовчнийміхурвирізаютьзчастиноюпаренхімипечінки.
При бактеріологічному обстеженні людей, що були в контакті з хворими або вібріоносіями, атакожреконвалесцентівпередвиписуваннямізстаціонарудоцільно заздалегідь дати їм проносне, яке одночасно діяло б і як жовчогінне (напр. 2530 г сульфату магнію). Для дослідження відбирають рідку частину випорожнень, що надійшли з верхнього відділу тонкої кишки і мають вміст жовчного міхура.
За епідеміологічними показниками досліджують воду відкритих водоймищ, водопровідну воду, стічні води, мул, гідробіонтів (риб, жаб, устриць, молюсків, рачківтощо), харчовіпродукти. Змивизоб’єктівнавколишньогосередовищавідбирають з площі 0,25 м2 ватними тампонами, змоченими 1% лужною пептонною водою, і в ній транспортують до лабораторії.
На кожну банку, флакон, пробірку наклеюють направлення, в якому вказуютьпрізвище, ініціали, вік хворого, його домашню і службову адресу, попередній діагноз, дату і час взяття проб, підпис лікаря, що направив матеріали. Відібрані проби потрібно доставити до лабораторії протягом 3-х годин. Якщо це неможливо, матеріал сіють в 1 % пептонну воду з телуритом калію (1:100000) і на чашки з лужним м’ясо-пептонним агаром. При великій віддалі до лабораторії всі проби вміщують у металеві пенали або банки, обмостивши ватою чи стружками. Потім їх пакують у дерев’яний ящик, пломбують, надписують “верх, обережно!” і з великими пересторогами спеціальним транспортом із посланцем доставляють до лабораторії.

216 Частина ІІІ. Спеціальна мікробіологія
Холера – особливо небезпечне захворювання. Тому бактеріологічне дослідження потрібно проводити в режимних лабораторіях, в яких працює спеціально підготовлений персонал. Якщо поблизу такої лабораторії немає, досліджуваний матеріалнаправляютьдонайближчоїзвичайноїбактеріологічноїлабораторії. Тоді прийоміншиханалізівприпиняють, встановлюютьсуворийпротиепідемічнийрежим, персоналу забороняють працювати натщесерце. Лабораторія повинна працювати цілодобово.
Бактеріологічне дослідження. Лабораторна діагностика холери має виняткововеликезначення, оскількивиділеннязбудникадаєправовстановитиостаточний діагноз і розгорнути профілактичні заходи для припинення епідемічного розповсюдження захворювання. Окрім того, вона дозволяє виявити вібріоносіїв, оцінити контроль за об’єктами оточуючого середовища і ефективність дезінфекції. Бактеріологічну діагностику проводять поетапно.
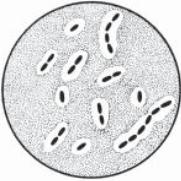
Перший етап. Із досліджуваних матеріалів виготовляють мазки, фіксують спиртом або сумішшю Никифорова, забарвлюють за Грамом і мікроскопують під імерсійним об’єктивом. Холернівібріонивиглядають трохизігнутимипаличками червоного кольору, розташованими між тяжами слизу у вигляді своєрідних скупчень, що нагадують “табунці рибок” (рис. 66).
Порядзтиповимивібріонамивмазкахчасомвиявляютькулясті, колбоподібні, спіралеподібні клітини. Це зменшує діагностичну цінність бактеріоскопічного методу. На цьому етапі з метою прискорення дослідження доцільно використовувати реакцію імунофлуоресценції з міченими діагностичними ОІ холерними сироватками та РНГА з антитільним еритроцитарним діагностикумом. Використовують і імунотушовий метод: фіксовані мазки обробляють 2 хв у вологій камері тушшю, змішаною з протихолерною сироваткою, промивають і мікроскопують. Холерні вібріони фарбуються в чорний колір.
Для швидкого і надійного виявлення холерних вібріонів у різних об’єктах навколишнього середовища, особливо тих, що погано або зовсім не культивуються, використовують метод полімеразної ланцюгової реакції.
Одночасно з бактеріоскопією проводять посів досліджуваного матеріалу в
|
рідкі і на щільні живильні середовища. З рідких |
|
середовищ найчастіше використовують 1 % луж- |
|
ну пептонну воду з телуритомкалію і середовище |
|
Монсура, з щільних – лужний МПА, селективні |
|
середовища TCBS, Аронсона, Монсура. Посіви |
|
роблять в 1 % пептонну воду, лужний МПА і на |
|
одне з селективних середовищ (краще всього |
|
TCBS). Придоставленніматеріалувтранспортно- |
|
му середовищі з нього роблять висів у 50 мл 1 % |
|
пептонної води pH 9.3 (середовище збагачення). |
|
Середовище Аронсона: МПА, доякогодобав- |
Рис. 66. Холерні вібріони |
ляютьсахарозу і фуксин, знебарвлений сульфітом |
у мазку з випорожнень. |
натрію. |
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
217 |
Середовище Монсура: на 1 літр дистильованої води беруть 15 г агар-агару, 1 г желатину, 10 г хлориду натрію, 50 г таурохолату натрію, 30 г карбонату натрію.
Середовище TCBS (тіосульфат-цитрат-бромтимолсахарознийагар) маєстандартнийсклад, випускаєтьсявготовомусухомувигляді. На1 лдистильованоїводи додають 69 г сухого порошку.
Другий етап. Через 5-6 год інкубації посівів у термостаті виготовляють мазок з поверхні рідкого середовища, висячу краплю для визначення рухливості й проводять орієнтовну реакцію аглютинації на склі з O1 (або RO, O139) діагностичною сироваткою (“слайд-аглютинація”).
Одночасно роблять висів з 1% пептонної води на лужний МПА або інші селективні середовища з метою отримання ізольованих колоній. При відсутності видимого росту в першій пептонній воді проводять висів з неї в другу пептонну воду (вразі первинного посіву в середовище збагачення зpH 9,3 подальшийвисів з нього проводять через 14-20 г). Посіви в рідкі і на щільні середовища проводять великою бактеріологічною петлею діаметром 5 мм. За результатами дослідження видають попередню відповідь про виявлення холерного вібріона.
Третій етап. Висів із другого середовища збагачення проводять на лужний МПА(абонаоднезелективнихщільнихсередовищ) через 5-6 г приpH 7,8 ічерез
14-20 год при pH 9,3.
Четвертий етап. Через 16-24 год вирощування посівів на щільних елективних середовищах проводять макро- і мікроскопічне дослідження ізольованих ко- лонійтапересівнадвовуглеводнесередовищеРесселя(лактозно-сахарознийагар) або на тривуглеводне середовище Кліглера (глюкозо-лактозо-сахарозний агар) з метою виділення чистої культури та її ідентифікації.
Колонії холерних вібріонів на лужному МПА в типовій S-формі мають розміри 2-3 мм, круглі, гладенькі, плоскі, голубуваті, прозорі, гомогенні, з рівними краями, маслянистої консистенції, легко знімаються петлею і емульгуються. При посіві матеріалів від хворих, що приймали антибіотики, та віброносіїв, можуть виростати атипові колонії. На агарі Аронсона колонії холерних вібріонів мають яскраво-червоний колір, на середовищі TCBS вони жовті на зеленому фоні, на середовищі Монсура колоніїбезкольору, напівпрозорі, зтемним центром. З колоніями на лужному МПА ставлять пробу на оксидазу, а з тими колоніями, що виросли на елективних середовищах, цю пробу ставити недоцільно.
При відборі колоній використовують індикаторні папірці (СІП-1 – набір для ідентифікації вібріонів). Оксидазопозитивні колонії перевіряють в “слайд аглютинації” з холерною сироваткою О1 (RO,O139) в розведенні 1:100 і варіантоспецифічними сироватками Інаба і Огава (1:50) готують мазки для забарвлення за Грамом і обробляють люмінесцентною сироваткою. Позитивні результати дають право видати попередню відповідь про виявлення холерного вібріона.
П’ятийетап. Досліджуютьхарактерростунаполівуглеводнихсередовищах. Холернийвібріоннаагарі Ресселязмінюєколірстовпчика при збереженні первісного кольору скошеної частини без утворення газу. Середовище Кліглера жовтіє повністю без утворення газу і сірководню. Культури перевіряють за морфологіч-

218 Частина ІІІ. Спеціальна мікробіологія
ними і аглютинабельними властивостями, а в разі потреби визначають групу за Хейбергом (табл. 43).
|
|
Біохмічна характеристика за Хейбергом |
|
Таблиця 43 |
||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Вуглеводи |
|
|
|
|
Г р уп и |
|
|
|
|
|
1 |
|
2 |
3 |
4 |
5 |
6 |
7 |
|
8 |
|
|
|
|
||||||||
Манноза |
+ |
|
- |
+ |
- |
+ |
- |
+ |
|
- |
Сахароза |
+ |
|
+ |
+ |
+ |
- |
- |
- |
|
+ |
Арабіноза |
- |
|
- |
+ |
+ |
- |
- |
+ |
|
- |
Ставлять також розгорнуту об’ємну реакцію аглютинації в пробірках за загальноприйнятою методикою відповідно з інструкцією до діагностичної сироватки. При відсутності реактивів на оксидазу можна використати пробу “тяжа”. На предметне скло наносять краплю 0,5% водного розчину дезоксихолату натрію або2,5% розчинумиючогозасобу“Прогрес”, додаютьповнупетлюагаровоїкультури досліджуваних вібріонів і ретельно перемішують. При позитивній реакції суспензія негайно втрачає мутність, стає слизовою і в’язкою – тягнеться за петлею у вигляді тяжа, що характерно для вібріонів.
Останнім часом розроблені тести для диференціації класичного варіанту холерного вібріона від біовару ельтор (табл. 44).
Основні відмінності між V. сholere і V. еltor |
Таблиця 44 |
|
|
||
|
|
|
Тести |
V. сholere |
V. еltor |
Гемоліз еритроцитів барана |
– |
± |
+ |
||
Аглютинація курячих еритроцитів |
– |
± |
+ |
||
Ріст на агарі з поліміксином (30 од/мл) |
– |
+ |
Лізис холерним фагом С |
+ |
– |
Лізис фагом Ельтор-2 |
– |
+ |
Реакція Фогеса-Проскауера |
– |
+ |
|
|
|
Чутливість виділених культур холерних вібріонів до антибіотиків та хіміотерапевтичнихпрепаратіввизначаютьзадопомогоюметодудифузіївагарзвикористанням стандартних дисків або методом серійних розведень.
Шостий етап. Остаточно враховують результат ідентифікації чистих культур і видають остаточну відповідь про виділення холерного вібріону серогрупи: О1, RO (Інаба, Огава, Гікошима) або 0139. Якщо виділені вібріони за більшістю ознак відносяться до холерних, але не аглютинуються сироватками, видають відповідьпровиділенняхолернихвібріонівнеО1 групи(такзванихНАГ-вібріонів). Обов’язкововідмічаютьгемолітичнуактивність, чутливістьдоантибіотиківілізис культури відповідним бактеріофагом.
Методи прискореної діагностики. Найкращим є люмінесцентно-серологі- чнийметод, віндаєможливістьчерез1,5-2 годвиявитихолернихвібріонівудосліджуваному матеріалі, а також у середовищі після підрощування в кількості 106
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
219 |
мікробних клітин в 1 мл. Методика виготовлення мазків, обробка люмінесцентною сироваткою, мікроскопія та оцінка результатів є загальною для виявлення всіх видів бактерій. Вона викладена в інструкції, що додається до сироватки.
За допомогою методу іммобілізації вібріонів під впливом специфічної холерноїО1 сироваткиможнавиявитизбудникапротягом15-20 хвприконцентрації йоговдосліджуваномуматеріалінеменшеніж105 мікр.тіл/мл. Напредметнескло наносять2 краплірідкихвипорожнень, блювотнихмасабоверхньогошару(плівки) зсередовищанакопичення. Першукраплюнакриваютьпокривнимскельцем(контроль), до другої додають краплю холерної 01 сироватки (1:100), перемішують і також накривають покривним скельцем. Надавлені краплі досліджують під фазо- во-контрастним мікроскопом або використовують темнопольний конденсор. При наявності в пробах холерних вібріонів у першій краплі видно характерний рух, у другій – іммобілізація мікробних тіл та їх аглютинація.
Для прискореної діагностики застосовують також чутливу реакцію непрямої гемаглютинації з використанням холерного антитільного еритроцитарного діагностикуму.
Метод масового дослідження на вібріононосійство проводять під час епі-
демічних спалахів холери. Випорожнення одночасно забирають з прямої кишки алюмінієвими петлями від 10 чоловік, раціонально згрупованих, і вносять їх в однуколбуз200 мллужноїпептонноїводиі01 холерноюаглютинуючоюсироваткою, розведеною до половини титру. Інкубацію проводять при 37 °С протягом 3-4 годин. Холерні вібріони, що розмножились, починають аглютинуватись і у виглядіпластівцівопадаютьнадноколби. Припозитивномурезультатіматеріалзабирають від кожної з 10 осіб і досліджують роздільно. Такий метод дає значну економію живильних середовищ і робочого часу бактеріологів.
Серологічні дослідження мають лише допоміжне значення і зводяться до визначення в сироватці хворих і вібріоносіїв вібріоцидних антитіл, аглютинінів та антитоксинів. Від хворих потрібно брати парні сироватки з інтервалом у 8-10 днів (першу пробу беруть на 3-5 день хвороби).
Найбільш чутливою є реакція визначення вібріоцидинів. Ці антитіла визна- чаютьсяз3-годнязахворюваннявтитрах1:100-1:1000 імаксимальнонаростають до 10-12-го дня. При постановці реакції спочатку ізотонічним розчином хлориду натрію розводять комплемент 1:20 і розливають його в ряд пробірок по 0,9 мл. Потім в першу пробірку вносять 0,1 мл сироватки хворого, перемішують і послідовно переносять по 0,1 мл до розведення 10-10, отримуючи десятикратні розведення в об’ємі 0,9 мл. У кожну пробірку додають по 0,1 мл суспензії культури холерного вібріона, в якій міститься 1-2 тис. мікробних клітин. Реакцію супроводжуютьвідповіднимиконтролямикомплементу, сироваткиікультури. Пробірки витримують при 37 °С протягом 60 хв і роблять висіви з них на сектори агару в чашках Петрі, інкубують у термостаті 18-20 год і підраховують кількість вирощених колоній. Титром вібріоцидних антитіл вважають максимальне розведення сироватки, якеспричиняєзагибельнеменше50 % вібріонівупорівняннізкількістю колоній, що виросли після висіву з пробірки контролю комплементу.
220 |
Частина ІІІ. Спеціальна мікробіологія |
Протихолерні аглютиніни виявляють за допомогою розгорнутої реакції аглютинації. Досліджувану сироватку розводять 1% лужною пептонною водою в об’ємі 1 мл від 1:10 до 1:640. Антигеном служить 3-годинна бульйонна культура холерного вібріона, який виділили в даному вогнищі. У два ряди пробірок з розтитрованими парними сироватками вносять по 1 краплі культури і ставлять на 60 хвутермостатпри37 °С, потімдоранку в холодильник, післячоговраховують результати. Реакцію супроводять, як звичайно, контролями сироватки і антигена. Результатвважають орієнтовно позитивним приаглютинації першою сироваткою в розведенні 1:40 і вище. Діагностичне значення має не менше ніж 4-кратне наростання титру антитіл у реакції з другою сироваткою.
Більш чутливою і специфічною вважають двокомпонентну реакцію непрямої гемаглютинації з еритроцитарним холерним діагностикумом. Необхідні компоненти реакції та методика її постановки в макрота мікрооб’ємах наведені в інструкції до діагностикуму. Обов’язково потрібно ставити і цюреакцію методом парних сироваток. Діагностичне значення має принаймні 4-кратне наростання титру антитіл у динаміці.
Визначення антитоксинів у сироватці крові проводять за допомогою непрямої гемаглютинації. Досліджувану сироватку розводять мікроабо макрооб’ємним способом і додають еритроцитарний холерний ентеротоксичний діагностикум. Діагностичнимтитромвважають розведення сироватки1:160. Доцільнодосліджувати парні сироватки.
Дослідження матеріалів довкілля. Найчастіше досліджують воду відкритих водоймищ, водопровідну воду, гідробіонтів, харчові продукти, мух, змиви з різних предметів.
Удосліджувану воду(двіпробипо500 мл) додаютьрозчиносновногопептону до 1% концентрації, інкубують 5-8 год при 37 °С і досліджують поверхневу плівку так само, як і плівку з пептонної води після посіву випорожнень чи блювотнихмас. Надійніші результатиотримують привикористанні методу фільтрації через мембранні фільтри № 2 або 3, змиви з яких після фільтрування води засівають у лужну пептонну воду і на селективні середовища. При цьому досліджують великі кількості води (1,5-2,5 л). Із змиву з фільтрів можна також робити мазки длязабарвлення їх люмінесцентною холерноюсироваткою, а такожставити реакцію непрямої гемаглютинації.
Від гідробіонтів після їх розтину сіють жовчний міхур, шлунок і кишечник (після їх гомогенізації) в 1% лужну пептонну воду і на елективний агар. Дафній і рачків розтирають у ступці і засівають петлею в 1 % пептонну воду.
Тверді харчові продукти подрібнюють, розтирають у ступці з ізотонічним розчином хлориду натрію і засівають у кількості 10 г у 50-100 мл 1 % пептонної води та на агарові середовища. Молоко і молочні продукти, змиви з об’єктів довкілля та мух засівають в 1% пептонну воду і досліджують за звичайною схемою.
У різних об’єктах навколишнього середовища можуть знаходитись і інші представники родини Vibrionaceae, морфологічно подібні до вібріонів. Особливо це стосується родів Aeromonas, Pseudomonas і Plesiomonas. Відрізнити їх від хо-
