
Практична мікробіологія - Климнюк С. І. - 2004
.pdfРозділ 7. Генетика бактерій |
111 |
Отже, DL50 відповідатиме розведенню зависі 10-5,5. Враховуючи, що при серійнихрозведенняхпослідовнозпробіркивпробіркупереноситься0,1 млматеріалу (тобто, додається до 0,9 мл ізотонічного розчину), в 1 мл вихідної зависі бактерій міститься 106,5 DL50.
Розділ 7
ГЕНЕТИКА БАКТЕРІЙ
Генетика бактерій та вірусів – наука, що вивчає механізми успадковування генетичних ознак та їх фенотипові прояви. Генетичний апарат прокаріотів побудований із двоспіральної суперспіралізованої ДНК. Сукупність генів нуклеоїду і позахромосомних факторів зумовлює генотип бактерій, а фенотип – це індивідуальний вияв генотипу в конкретних умовах існування.
Розрізняють два види мінливості мікроорганізмів: неспадкову, або модифікаційну та спадкову, або генотипову. Неспадкова мінливість виникає під впливом факторівзовнішньогосередовища(змінаморфологіїклітини, появаL-формтощо). Модифікаційні зміни нетривалі, після припинення дії агента вони зникають. При генотиповій мінливості різноманітні ознаки бактерій успадковуються. Ця мінливість виникає внаслідок мутацій, трансформацій, коньюгацій і трансдукцій.
Вивчення модифікаційної мінливості бактерій. Готують 2 чашки Петрі,
одназякихміститьм’ясо-пептоннийагарз0,1 % фенолу, інша– звичайнийМПА. На поверхню чашок засівають культуру Proteus vulgaris. Посіви інкубують у термостаті при температурі 37 °С протягом доби. Потім вивчають особливості росту мікробів на поверхні агару, роблять мазки, забарвлюють їх за Грамом і розглядають під імерсійним об’єктивом. На контрольному середовищі (МПА) вульгарний протейпредставленоневеликимиграмнегативнимипаличками, якімаютьтенденцію до повзучого росту по поверхні середовища. На агарі з фенолом спостерігаєтьсятенденціядоутворенняізольованих колоній, вмазках виднониткоподібні форми бактерій, часом із колбоподібними потовщеннями на кінцях.
Фенол як фактор модифікаційної мінливості може викликати втрату рухливості протеїв. Для її перевірки добову культуру P. vulgaris засівають у дві пробірки: одна з них містить звичайний МПБ (контроль), інша – 0,1 % феноловий МПБ. Через добу культивування притемпературі 37 °Сувисячій краплі перевіряють рухливість збудників.
У контрольній пробірці вони зберігають рухливість, у дослідній – мікроби нерухомі. Для доведення природи модифікаційної мінливості мікроби засівають на звичайний м’ясо-пептонний агар і після 18-24-годинного культивування перевіряють біологічні ознаки, в яких у цьому випадку спостерігається реверсія.
Метод реплік для виявлення мутантів. На чашку Петрі із повноцінним м’ясо-пептонним агаром за добу до досліду засівають 0,1 мл добової бульйонної
112 Частина І. Загальна мікробіологія
культури E. сolі, розведеної до 10-3 ступеня із розрахунку, щоб виросло 100 колоній. Нанаступнийденьготуютьмінімальнеживильнесередовище, якенемістить ростових факторів для бактерій (глюкозо-сольовий агар), і чашку з повноцінним середовищем. Для досліду використовують штамп-реплікатор, який представляє собою дерев’яний або металевий циліндр товщиною до 1 см з діаметром дещо меншим, ніжчашкаПетрі(рис. 39). Йогоробочаповерхнявкритаоксамитом, вор-
саланом або іншим матеріалом, що має
|
дрібні ворсинки. Відкривають чашку |
|
Петрі, на якій виросли колонії мікроор- |
|
ганізмів (матрична чашка), і прикладають |
|
до неї штамп-реплікатор. Після цього пе- |
|
реносятьколонії, якіприкріпилисьдовор- |
|
синок, на дослідну і контрольну чашки |
|
Петрі(чашки-репліки) ізвідповіднимисе- |
Рис. 39. Метод реплік. |
редовищами. Необхіднозвернутиувагуна |
|
точне фіксування положення штампа-ре- |
плікатора наматричнійчашціічашках-репліках. Післядобовоїінкубаціїпритемпературі 37°Свивчаютьколонії, щовирослиначашкахіпідраховуютьїхкількість. Відмічаютьколоніїмікроорганізмів, якіневирослинамінімальномуживильному середовищі. Вони є ауксотрофними мутантами, тому що нездатні синтезувати відповідні ростові фактори.
Ідентичний експеримент можна поставити для виділення мутантів, які є резистентнимидоантибіотиків, непотрапляючи попередньо підїхвплив(селекційна дія).
Флуктуаційний тест Лурія і Дельбрюка для виявлення частоти спон-
танних мутацій. Для того, щоб виявити частоту спонтанних мутацій, які зумовлюють стійкість до стрептоміцину (Strr варіанти), відбирають чутливий до цього антибіотикаштам E.coli. Здобовоїкультури бактерійустерильному ізотонічному розчині хлориду натрію готують суспензію клітин з концентрацією 1000-10000 клітин в1 мл. Їхзасівають у пробірку з10 млМПБів10 пробірок з1 мланалогічного середовища так, щоб концентрація мікробів коливалась у межах 100-1000 клітин в 1 мл. Після добової інкубації при оптимальній температурі (37 °С) з 1-ої пробірки роблять висів по 0,1 мл на 10 чашок Петрі, які містять по 100 ОД стрептоміцину в 1 мл агару. Посів проводять за допомогою шпателя. Вміст інших десятипробіроктакожзасіваютьнааналогічніокремічашкиПетріізстрептоміцином, кожну в об’ємі 0,1 мл, шпателем. Посіви інкубують у термостаті при 37 °С протягом 18-20 год.
Якщострептоміцинорезистентнікишковіпалички утворюютьсятількипісля контактумікробівізантибіотикомпротягомдоби, тоїхчислоповиннобулоббути приблизнооднаковимнавсіх20 чашкахПетрі. Віншомувипадку, заумовипередіснування антибіотикостійких варіантів (мутантних), на чашках виростає неоднаковакількістьколоніймікроорганізмів. Цеєпроявколивань(флуктуацій) кількості мутантних клітин залежно від часу формування мутацій.

Розділ 8. Визначення чутливості бактерій до антибіотиків |
113 |
Висівмікробівізпробірки, дезнаходилось10 млживильногосередовища, не дає таких флуктуацій мутантів, оскільки клітини рівномірно розподіляються в живильному середовищі.
Моделювання трансформації в мікроорганізмів. У досліді використовуєть-
сястрептоміциночутлива сінна паличка (Bac. subtilis Strs) ідонорська ДНК аналогічного мікроба, яка має гени, що кодують стійкість клітини до антибіотиків.
У стерильну пробірку наливають 0,5 мл бульйонної культури штама-реципі- єнтаBac. subtilis ідодають0,5 млдонорськоїДНКзконцентрацією1 мкг/мл. Суміш інкубуютьутермостатіпри37°Спротягом20-30 хв, потімдодають0,5 млрозчину хлориду магнію для руйнування ДНК, що не встигла проникнути в клітину-реци- пієнт. Роблятьсерійні 10-кратні розведеннятрансформованоїкультури у стериль- номуізотонічномурозчиніхлоридунатріюдо10-5-10-6 іпроводятьпосівиматеріалу в об’ємі 0,1 мл за допомогою шпателя паралельно на чашки без антибіотика і з 100 ОД/мл стрептоміцину.
Після інкубації протягом 18-24 год при температурі 37 °С оцінюють результати досліду, вираховуючи частоту трансформації.
Наприклад, післяпосівуштама-реципієнта, якийбулорозведенов10000 (10-5) разів, наповерхнісередовищавиросло120 колонійбацил(1,2·108/мл). Посів0,1 мл нерозведеного рекомбінантногоштаму на середовище із стрептоміцином дав ріст 60 колоній (6,0·102/мл). Отже, частота трансформації (ЧТ) дорівнюватиме :
ЧТ = 6,0 102 = 5 10−6 1,2 108
Таким чином, генетичні феномени знаходять широке практичне застосуванняврізнихгалузяхнауки, техніки, медицини, фармацевтичноїпромисловості, біотехнології, сільського господарства тощо.
Розділ 8
ВИЗНАЧЕННЯ ЧУТЛИВОСТІ БАКТЕРІЙ ДО АНТИБІОТИКІВ
Антибіотики – це речовини мікробного, рослинного або тваринного походження, їх напівсинтетичні та синтетичні аналоги і похідні, що вибірково пригнічуютьжиттєдіяльністьмікроорганізмів, вірусів, найпростіших, грибів, атакож затримують ріст пухлин.
Антибіотикам притаманна висока біологічна активність. Вони спричиняють біологічний ефект у дужемалихкількостях (наприклад, пеніцилін викликає виражену бактерицидну дію на бактерії у концентрації 0,000001 г/мл). Антибіотики мають високу вибіркову специфічність, оскільки проявляють свою дію тільки
114 |
Частина І. Загальна мікробіологія |
відповідно до певних груп організмів, не завдаючи шкоди іншим. Так, бензилпеніцилінзатримуєрістгрампозитивнихбактерій(стафілококів, стрептококів) іпрактично не впливає на грамнегативні мікроби, гриби.
Біологічну активність антибіотиків оцінюють в умовних одиницях, які містятьсяв1 млрозчину(ОД/мл) абов1 мгпрепарату(ОД/мг). Утакихантибіотиків, як еритроміцин, новобіоцин, ністатин, трихоцетинта ін. одна одиниця активності еквівалентна 1 мкг препарату. За одиницю антибіотичної активності пеніциліну приймають мінімальну кількість препарату, здатну затримувати ріст штаму Staphylococcus aureus 209 у50 млпоживногобульйону. Активністьстрептоміцину вимірюєтьсямінімальноюкількістюантибіотика, якийінгібуєрістEscherichia coli в1 млпоживного бульйону. Фактичнодлябільшостіантибіотиків1 ОДвідповідає 1 мкг хімічно чистого препарату. Однак є антибіотики, для яких існують винятки. Так, наприклад, для пеніциліну 1 ОД відповідає 0,6 мкг, поліміксину В – 0,1 мкг, ністатину – 0,333 мкг хімічно чистих антибіотиків.
Оцінка чутливості мікробів до антибіотиків та вивчення їх фармакокінетики ворганізміхворогоєосновнимилабораторнимипоказниками, якіприїхспівставленнідозволяютьпрогнозуватиефективністьантибактеріальноїтерапії. Крімтого, результативизначенняантибіотикочутливостівикористовуютьякмаркер, щодозволяє виявляти та контролювати зміни антибіотикограми збудників у динаміці, використовувати детермінанти резистентності, якінайчастіше зустрічаються, або їхсполученняякдодатковімаркерипридіагностицівнутрішньолікарнянихінфекцій, длявиявленняджерелінфікуванняташляхіврозповсюдженняполірезистентних штамів. Такі дані, одержані та узагальнені у різних регіонах країни протягом фіксованихпроміжківчасу, використовуютьсяприформуванніполітикиантибактеріальної терапії та визначенні номенклатури антибіотиків, які випускаються в країні.
Найрозповсюдженішими методами визначення антибіотикочутливості збудників інфекцій є диско-дифузійний (метод дисків) та серійних розведень.
Живильні середовища для визначення чутливості бактерій до антибіотиків повинні відповідати таким вимогам:
•бутистандартнимитазабезпечуватиоптимальніумовиростумікроорганізмів;
•неміститиінгібіторівбактеріальногоростуівеликоїкількостістимуляторів;
•не мати речовин, що пригнічують активність препаратів.
Нарезультати дослідженняможесуттєво впливати значення рН середовища. Найдоцільніше вибирати нейтральне або дещо лужне середовище (рН 7,0-7,4), оскільки ці значення придатні для більшості антибіотиків. При визначенні чутли- востібактерійвикористовуютьбульйоні1,5-2 % агарнапереварі Хоттінгера, звичайний м’ясо-пептонний бульйон і 1,5-2 % агар на ньому, середовище АГВ (агар Гівенталя-Вєдьміної), агар Mueller-Hinton 2. Вони придатні при визначенні антибіотикочутливості стафілококів, ентеробактерій, псевдомонад. Однак стрептококи та гемофільні бактерії вимагають добавки ростових факторів; дріжджі та анаеробнібактерії– спеціальнихсередовищіпевнихумовкультивування. Нарезультати визначення чутливості мікроорганізмів до антибіотиків-аміноглікозидів,
Розділ 8. Визначення чутливості бактерій до антибіотиків |
115 |
поліміксинів, тетрациклініввпливаєвмістуживильнихсередовищахкатіонівкальцію, магнію, що особливо важливо при дослідженні P. aeruginosa. Оптимальний вміст– 50 мг/л Са2+ і 25 мг/лMg2+. Більшістьсередовищ, що випускаються країнами СНД, за цим показником, як правило, не стандартизуються. Це призводить до суттєвихколиваньвмістудвовалентнихкатіонівурізнихсеріяхсередовищ, навіть якщо вони випускаються одним підприємством, і спотворює результати.
Диско-дифузійнийметодвизначенняантибіотикочутливостієнайпростішим якісним методом і широко використовується для епідеміологічного контролю резистентності. Достовірність результатів забезпечується шляхом стандартизації проведення тесту на всіх етапах дослідження: вибір і виготовлення живильних середовищ із врахуванням всіх властивостей можливих збудників, взяття проб і умови їх доставки, виготовлення і розливання посівного матеріалу на поверхню агару, вибір дисків (використання набору дисків у відповідності до виду виділеного збудника та локалізації інфекції).
Чутливість мікроорганізмів до антибіотиків слід визначати тільки у чистій культурі. Однак у ряді випадків для швидкого одержання орієнтовних даних про антибіотикограму бактерій використовують безпосередньо патологічний матеріал. Щільнісубстрати(харкотиння, гній, калтаін.) розтирають, рідини(сеча, ексудати та ін.) центрифугують, а для посіву використовують осад. Досліджуваний матеріал наносять на поверхню живильного середовища петлею або ватним тампоном. Після одержання чистої культури дослідження повторюють.
Для виготовлення інокулюму 5-10 однорідних колоній суспендують у 2 мл рідкого середовища або фізіологічного розчину. Бактеріальну суспензію (103-105 КУО/мл залежно від виду мікробів) в об’ємі 1 мл рівномірно розподіляють по поверхнісередовищаприпохитуваннічашки, надлишокрідинивидаляютьпіпеткою. Чашки підсушують при кімнатній температурі протягом 20-30 хв, а потім на них на однаковій віддалі кладуть диски з антибіотиками.
Рівномірністьгазону, якавизначаєтьсявеличиноюпосівноїдози, – найголовніший фактор одержання достовірних результатів і підлягає кількісній оцінці та якісній стандартизації. Ступінь нестандартності результатів дослідження, який пов’язаний із зміною величини дози інокулюму, варіює залежно від виду збудників, властивостей антибіотика та інших факторів. При невеликій дозі інокулюму при визначенні чутливості до бета-лактамних препаратів пеніциліназо-утво- рюючих бактерійможна одержати великірозміризонзатримкиросту, які створюютьуявленняпровисокучутливістьштамів. І, навпаки, розмірзонрізкознижується при збільшенні щільності інокулюму. Вирішальне значення має його величина привизначеннічутливостідобета-лактамнихантибіотиківметицилінорезистент- них варіантівстафілококів внаслідок гетерогенності їхсамезапоказником чутливості. Для виявлення стійкості до метициліну необхідно дотримуватись певних температурних режимів (30-35 °С). Оскільки ці стафілококи повільніше ростуть при 37 °С, слідїхкультивуватинасередовищахздодаванням5 % хлоридунатрію. Результати враховують через 24 та 48 год (рис. 40). Для контролю стандартності проведення досліджень у кожному досліді використовують тест-культури з відо-

116 |
Частина І. Загальна мікробіологія |
|
мою чутливістю до антибіотиків. ВООЗ рекомен- |
|
дує три штами типових культур: Escherichia coli, |
|
Staphylococcus aureus, Pseudomonas aeruginosa. |
|
Привизначенніантибіотикочутливостівиділених |
|
штамів слід співставляти отримані дані з розмі- |
|
рами зон пригнічення росту навколо дисків з ан- |
|
тибіотиками для контрольних культур (табл. 12). |
|
Їхпорівнюютьздопустимимиконтрольнимизна- |
|
ченнями. |
|
Якщо діаметри зон пригнічення росту конт- |
Рис. 40. Визначення антибіотико- |
рольних штамів знаходяться у певних межах, це |
свідчить про достатню стандартизацію і точність |
|
чутливості за допомогою |
проведених експериментів. Не слід розміщати на |
методу стандартних дисків. |
|
|
чашці Петрі понад 6 дисків, так як при великих |
діаметрах зон затримки росту це може бути джерелом помилок і впливати на кількісну інтерпретацію результатів. Правильний підбір набору дисків є фактором, який визначає коректність досліджень і, без сумніву, інтерпретацію резуль-
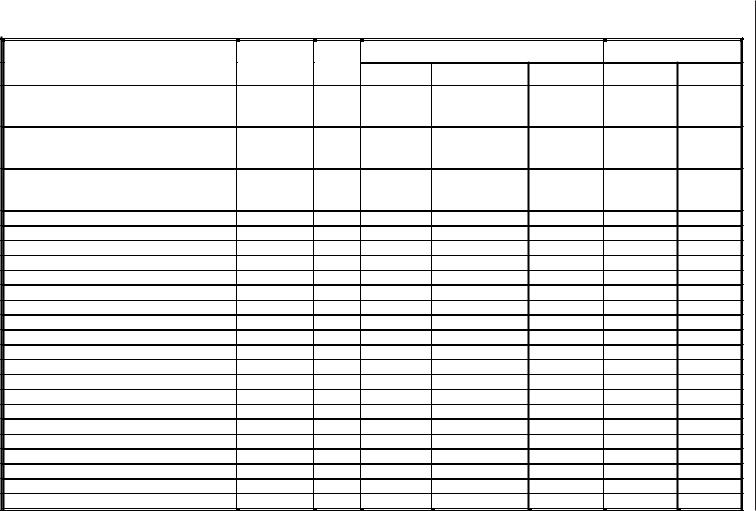
Таблиця 12
Граничні межі діаметрів зон затримки росту еталонних штамів
|
|
|
Діаметри зон затримки росту, мм |
|
|||
Антибіотики |
на середовищах № 1 і № 2 |
на середовищі АГВ |
|||||
S. aureus |
E. coli |
P. aeruginosa |
S. aureus |
E. coli |
P. aeruginosa |
||
|
ATCC |
ATCC |
ATCC |
ATCC |
ATCC |
ATCC |
|
|
25923 |
25922 |
27853 |
25923 |
25922 |
27853 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Бензилпеніцилін |
- |
|
- |
- |
29-38 |
- |
- |
Ампіцилін |
24-35 |
13 |
-20 |
- |
30-36 |
14-20 |
- |
Карбеніцилін (25 мкг) |
- |
|
- |
- |
32-38 |
19-25 |
- |
Карбеніцилін (100 мкг) |
- |
21 |
-26 |
20-24 |
35-42 |
23-29 |
18-24 |
Метицилін |
- |
|
- |
- |
22-30 |
- |
- |
Оксацилін |
27-32 |
|
- |
- |
24-30 |
- |
- |
Цефалотин |
24-37 |
15 |
-22 |
- |
30-40 |
15-20 |
- |
Стрептоміцин |
17-25 |
14 |
-22 |
- |
20-25 |
14-19 |
- |
Неоміцин |
19-27 |
18 |
-24 |
- |
20-27 |
13-17 |
- |
Канаміцин |
20-27 |
18 |
-26 |
- |
20-27 |
15-19 |
- |
Гентаміцин |
20-28 |
20 |
-27 |
16-24 |
22-32 |
21-30 |
16-26 |
Тетрациклін |
20-29 |
19 |
-26 |
- |
22-31 |
17-26 |
- |
Еритроміцин |
23-31 |
|
- |
- |
22-31 |
8-15 |
- |
Олеандоміцин |
20-29 |
|
- |
- |
22-29 |
- |
- |
Лінкоміцин |
24-32 |
|
- |
- |
24-32 |
- |
- |
Левоміцетин |
21-27 |
26 |
-28 |
- |
19-25 |
19-27 |
- |
Рифампіцин |
- |
|
- |
- |
26-34 |
7-11 |
- |
Поліміксин |
- |
12 |
-17 |
- |
- |
16-20 |
15-20 |
Ристоміцин |
14-18 |
|
- |
- |
12-16 |
- |
- |
|
|
|
|
|
|
|
|

Розділ 8. Визначення чутливості бактерій до антибіотиків |
117 |
татів. Орієнтовні дані щодо вибору наборів дисків із врахуванням виду виділеного збудника і локалізації інфекції наведено у таблиці 13.
Таблиця 13
Основні набори дисків, які рекомендуються для визначення чутливості залежно від виду виділеної культури та патологічного матеріалу
|
Попереднє вивчення |
Дослідження чистої культури (штами) |
||||||
Антибіотики |
чутливості мікрофлори |
|
|
|
|
|||
харко- |
гною |
сечі |
стафіло- |
стреп- |
ентеро- |
псевдо- |
||
|
||||||||
|
тиння |
коків |
тококів |
бактерій |
монад |
|||
Бензилпеніцилін |
+ |
+* |
|
+* |
+* |
|
|
|
Метицилін, |
+* |
+* |
|
+* |
+* |
|
|
|
Оксацилін |
|
|
|
|
|
|
|
|
Ампіцилін |
+* |
|
+* |
|
|
+* |
|
|
Карбеніцилін (25 мг) |
|
|
+* |
|
|
+ |
|
|
Карбеніцилін (100 мг) |
|
|
+* |
|
|
|
+* |
|
Цефалексин |
+* |
+* |
+* |
+* |
+* |
+* |
|
|
Цефалотин |
+ |
+ |
|
+* |
+* |
+* |
|
|
Еритроміцин |
+* |
|
|
+* |
+* |
|
|
|
Олеандоміцин |
+ |
|
|
+* |
+* |
|
|
|
Лінкоміцин |
|
|
|
+ |
+ |
|
|
|
Ристоміцин |
|
|
|
+ |
|
|
|
|
Фузидин |
|
|
|
+ |
|
|
|
|
Стрептоміцин |
|
|
|
|
|
+ |
|
|
Канаміцин |
|
+* |
|
+ |
|
+ |
|
|
Гентаміцин |
|
+* |
|
+ |
|
+ |
+* |
|
Тетрациклін |
+* |
+* |
|
+ |
+ |
+* |
|
|
Левоміцетин |
+ |
+ |
+ |
|
|
+ |
|
|
Поліміксин |
|
|
|
|
|
+ |
+* |
|
|
|
|
|
|
|
|
|
|
Примітка. * – антибіотики, чутливість до яких визначають у першу чергу.
Оцінку результатів проводять за таблицею 14, яка містить граничні значення діаметрів зон затримки росту для резистентних, помірно резистентних та чутливихштамів, атакожзначеннямінімальноїпригнічуючої(інгібуючої) концентрації (МПК, МІК) антибіотиків для стійких і чутливих штамів.
Одержані значення діаметрів зон затримки росту порівнюють з контрольними значеннями таблиці 14 і відносять досліджувані штами до однієї з трьох категорій чутливості.
Метод дифузії за допомогою дисків є якісним методом. Він дозволяє встановити лише факт чутливості або резистентності збудників інфекції. Однак встановлений корелятивний зв’язок розмірів зон пригнічення росту досліджуваних штамів і значень МІК (мінімальна концентрація препарату, яка інгібує ріст досліджуваного штаму) антибіотиків дозволяє оцінити ступінь чутливості і кількісно, використовуючи дані, наведені у таблиці 14. За своїм ступенем чутливості до антибіотиків мікроорганізми поділяються на три групи:
Таблиця 14
Граничні значення діаметрів зон затримки росту і значення МПК антибіотиків для інтерпретації результатів
Антибіотики |
Вміст |
Код |
Діаметри зон для середовища АГВ, мм |
МПК, мкг/мл |
|||
антибіотика |
диску |
стійкі |
помірно-стійкі |
чутливі |
стійкі |
чутливі |
|
|
в диску, мкг |
||||||
Бензилпеніцилін: |
|
ПЕН |
|
|
|
|
|
при дослідженні стафілококів |
6 |
|
≤20 |
21-28 |
≥29 |
- |
≤0,1 |
при дослідженні інших мікробів |
|
АМП |
≤10 |
11-16 |
≥17 |
- |
≤1,5 |
Ампіцилін при дослідженні: |
|
|
|
|
|
|
|
стафілококів |
10 |
|
≤20 |
21-28 |
≥29 |
- |
≤0,2 |
грамнегативних бактерій та ентерококів |
|
КАР |
≤9 |
10-13 |
≥14 |
≥32 |
≤8 |
Карбеніцилін при дослідженні: |
|
|
|
|
|
|
|
кишкової палички та протея |
25 |
|
≤14 |
15-18 |
≥19 |
≥32 |
≤16 |
синьогнійної палички |
100 |
|
≤11 |
12-14 |
≥15 |
≥250 |
≤125 |
Метицилін |
10 |
МЕТ |
≤13 |
14-18 |
≥19 |
- |
≤3 |
Оксацилін |
10 |
ОКС |
≤15 |
16-19 |
≥20 |
- |
≤3 |
Цефалексин |
30 |
ЦФЛ |
- |
- |
- |
≥32 |
≤10 |
Цефалотин |
30 |
ЦФТ |
≤14 |
15-18 |
≥19 |
≥32 |
≤10 |
Стрептоміцин |
30 |
СТР |
≤16 |
17-19 |
≥20 |
≥15 |
≤6 |
Неоміцин |
30 |
НЕО |
≤12 |
13-16 |
≥17 |
- |
≤10 |
Канаміцин |
30 |
КАН |
≤14 |
15-18 |
≥19 |
≥25 |
≤6 |
Мономіцин |
30 |
МОН |
≤13 |
14-17 |
≥18 |
- |
≤10 |
Гентаміцин |
10 |
ГЕН |
≤15 |
- |
≥16 |
≥6 |
≤4 |
Сизоміцин |
10 |
СИЗ |
- |
- |
- |
≥6 |
≤4 |
Тетрациклін |
30 |
ТЕТ |
≤16 |
17-21 |
≥22 |
≥12 |
≤2 |
Доксициклін |
10 |
ДОК |
- |
- |
- |
≥12 |
≤2 |
Еритроміцин |
15 |
ЕРИ |
≤17 |
18-21 |
≥22 |
≥8 |
≤2 |
Олеандоміцин |
15 |
ОЛЕ |
≤16 |
17-20 |
≥21 |
≥8 |
≤2 |
Лінкоміцин |
15 |
ЛІН |
≤19 |
20-23 |
≥24 |
≥8 |
≤2 |
Левоміцетин |
30 |
ЛЕВ |
≤15 |
16-18 |
≥19 |
≥16 |
≤8 |
Рифампіцин |
5 |
РІФ |
≤12 |
13-15 |
≥16 |
≥8 |
≤2 |
Фузидин |
10 |
ФУЗ |
- |
- |
- |
≥16 |
≤2 |
Поліміксин |
300 ОД |
ПОЛ |
≤11 |
12-14 |
≥15 |
≥50 ОД/мл |
- |
Ристоміцин |
30 |
РІС |
≤9 |
10-11 |
≥12 |
- |
≤5 |
118
мікробіологія Загальна .І Частина
Розділ 8. Визначення чутливості бактерій до антибіотиків |
119 |
1 група – чутливі до антибіотиків (збудники знищуються в організмі при використанні звичайних терапевтичних доз препаратів);
2 група – помірно-резистентні (для них лікувальний ефект може бути досягнутий при використанні максимальних терапевтичних доз препаратів);
3 група – резистентні (бактерицидних концентрацій препаратів в організмі створити неможливо, тому що вони будуть токсичними).
При визначенні стійкості до антибіотиків, близьких за хімічною будовою і спектром антибактеріальної дії, можливе використання клас-диска, просякнутого одним з антибіотиків певної групи. Так, за допомогою диска збензилпеніциліном можна визначати чутливість до біцилінів, феноксиметилпеніциліну; цефалексиновим – до цефазоліну, цефаклору, цефалотину. Однак, не рекомендується використовувати тетрациклінові диски для визначення чутливості до доксицикліну.
Строки та температура зберігання дисків вказані на етикетці упаковок. Диски з малостабільними антибіотиками (бензилпеніциліном, ампіциліном, карбеніциліном, метициліном, оксациліном) слідзберігатипри4 °Сабо14 °С. Післятого, як флакон із дисками відкрито, його зберігають протягом тижня при 4 °С. Перед застосуванням його протягом 1 год залишають при кімнатній температурі для попередження утворення конденсату на внутрішніх стінках флакона. Диски із простроченим терміном зберігання, де сілікагель має рожевий колір, використовувати не можна.
Метод серійних розведень. Показаннями для визначення антибіотикочутливості за методом серійних розведень є необхідність одержання кількісних даних (переважнопритяжкомуперебігуінфекційнихпроцесів) дляпроведеннярегульованої антибіотикотерапії.
Встановлення ступеня чутливості мікробів до антибактеріальних препаратів впливає на вибір антибіотика (наприклад, відмова від ліків з високою токсичністю при помірному ступені чутливостізбудника до них), його дозування (концен- траціяантибіотикавкровіповиннав2-3 разиперевищуватийогомінімальнупригнічуючуконцентраціюповідношеннюдозбудника) ірежимвведення. Крімтого, її кількісне визначення необхідне також для встановлення бактерицидної дії обраного препарату (як гарантії швидкого терапевтичного ефекту та безрецидивного перебігу) по відношенню до даного збудника.
Існують дві модифікації методу серійних розведень – визначення чутливості на рідкому та густому живильних середовищах. Метод дає можливість визначити МПК препарату для виділеного штаму збудника.
Для визначення антибіотикочутливості за методом серійних розведень у рідкому живильному середовищі готують ряд (8-10 і більше) пробірок з двократними послідовними розведеннями препарату (табл. 15).
Середовище попередньо розливають у пробірки по 2 мл. У першу додають 2 мл розчину антибіотика певної концентрації, перемішують і переносять до наступної пробірки, продовжуючи розведення до передостанньої, з якої видаляють 2 млсуміші. Останняпробіркаслужитьконтролемростукультури. Утомужбульйоні, який використовують для розведення антибіотиків, готують суспензію добо-

120 |
|
|
|
|
|
|
Частина І. Загальна мікробіологія |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Таблиця 15 |
Схема визначення антибіотикочутливості за методом серійних розведень |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пробірки |
|
|
|
|
||
Компоненти, мл |
|
|
|
|
|
|
|
|
|
|
Контроль |
Контроль |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
8 |
|
анти- |
||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
бактерій |
біотика |
МПБ |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
2,0 |
|
2,0 |
|
2,0 |
2,0 |
Пеніцилін, 100 ОД/мл |
2,0 |
→ |
→ |
→ |
→ |
→ |
→ |
|
↑ |
|
- |
2,0 |
Концентрація |
50 |
25 |
12,5 |
6,3 |
3,2 |
1,6 |
0,8 |
|
0,4 |
|
- |
50 |
антибіотика, ОД/мл |
|
|
|
|
|
|
|
|
|
|
|
|
Суспензія бактерій, |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
0,2 |
|
0,2 |
- |
105/мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
Інкубація в термостаті при 37 °С 18-24 год |
|
|
|||||||||
Результат |
|
|
|
|
|
|
|
|
|
|
|
|
вої агарової або бульйонної культури бактерій з розрахунку 105-106 мікробних тіл в 1 мл залежно від виду збудника. Потім до кожної пробірки з розведеннями, а також до контрольної додають по 0,2 мл виготовленої суспензії. При визначенні чутливості до пеніцилінів пеніциліназоутворюючих стафілококів рекомендують використовуватиодночасновеликеймалемікробненавантаження(100, 100000 та вище мікробних тіл в 1 мл). Залежно від величини посівної дози значення МПК препарату може коливатись: при збільшенні дози чутливість знижується за рахунок зростання кількості пеніцилінази, що утворюється в середовищі.
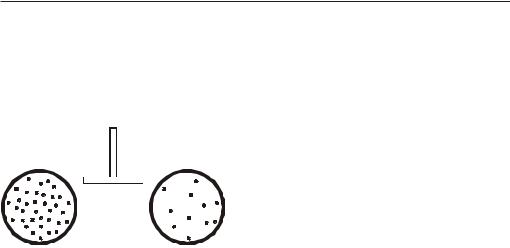
Пробірки інкубують у термостаті при 37 °С протягом 18-24 год. Результати враховують, визначаючи наявність або відсутність росту в середовищі з різними розведеннями препарату. (рис. 41). Остання пробірка, в якій спостерігають затримкуростукультури(прозорийбульйон), відповідаєМПК(мінімальнійпригнічуючій концентрації) або МБсК (мінімальній бактеріостатичній концентрації) препарату відносно даного мікроба і вказує на ступінь його чутливості. Якщо ознаки росту з’являються в усіх пробірках, досліджуваний штам резистентий до максимальної концентрації препарату, яку було взято у дослід. Відсутність росту бактерійвусіхпробірках, крімконтрольної, свідчить, щоМПКпрепарату нижча, ніж
та, що використовується в досліді.
|
|
|
|
|
|
|
|
Длявизначеннябактерицидногоефек- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ту антибіотика з декількох останніх про- |
|
|
|
|
|
|
|
|
бірок, в яких немає ознак росту, роблять |
|
|
|
|
|
|
|
|
висів на сектори агару в чашках Петрі. Че- |
|
|
|
|
|
|
|
|
рез 24-48 год інкубації при оптимальній |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
температурі відмічають ту найменшу кон- |
|
|
|
|
|
|
|
|
центраціюпрепаратувпробірці, посівзякої |
|
|
|
|
|
|
|
|
недавросту. Її вважаютьмінімальноюбак- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
терицидною концентрацією (МБцК). |
|
|
|
|
|
|
|
|
|
Рис. 41. Визначення антибіотикочутли- |
Принципметодусерійнихрозведеньу |
|||||||
вості методом серійних розведень. |
густому живильному середовищі анало- |
|||||||
