
Практична мікробіологія - Климнюк С. І. - 2004
.pdfРозділ 4. Фізіологія бактерій |
71 |
Виділення чистої культури анаеробних бактерій
У лабораторній практиці часто доводиться працювати з анаеробними мікроорганізмами. Вони більш вибагливі до живильних середовищ, ніж аероби, частіше потребують спеціальних ростових добавок, вимагають припинення доступу киснюприїхкультивуванні, тривалістьростуїхдовша. Томуроботазнимискладніша, вимагає значної уваги бактеріологів і лаборантів.
Важливим є захист матеріалу, щомістить анаеробні збудникивідтоксичного впливуатмосферногокисню. Томуматеріалізвогнищгнійноїінфекціїрекомендуєтьсязабиратипідчасїхпункціїзадопомогоюшприца, часміжвзяттямматеріалу та посівом його на живильне середовище повинен бути максимально коротким.
Оскількидлякультивуванняанаеробнихбактерійвикористовуютьспеціальні живильні середовища, які не повинні містити кисню і мають низький окисновідновний потенціал (-20 -150 мВ), до їх складу вводять індикатори – резазурин, метиленовий синій тощо, які реагують на зміну цього потенціалу. При його зростанні відновлені безбарвні форми індикаторів змінюють свій колір: резазурин забарвлюєсередовищеврожевийколір, аметиленовийсиній– вголубий. Такізміни свідчать про неможливість використання середовищ для культивування анаеробних мікробів.
Сприяє зниженню окисно-відновного потенціалу введення в середовище не менше 0,05 % агару, який, збільшуючи його в’язкість, сприяє зменшенню надходження кисню. Це, в свою чергу, досягається ще й використанням свіжих (не пізніше двох годин після виготовлення) і редукованих живильних середовищ.
Слід врахувати, що через особливості бродильного типу метаболізму анаеробних бактерій вони вимагають багатших на живильні компоненти і вітаміни середовищ. Найчастіше використовують серцево-мозковий й печінковий настої, соєві та дріжджові екстракти, гідролітичний перевар казеїну, пептон, триптон. Обов’язковимєдодаванняфакторівросту, такихяктвін-80, гемін, менадіон, цільна або гемолізована кров.
Методи створення анаеробних умов. Враховуючи, що вільний молекуляр-
ний кисень є токсичним для облігатно-анаеробних бактерій, обов’язковою умовою культивування таких мікроорганізмів є обмеження його доступу. Існує ряд методів (механічних, фізичних, біологічних), які дозволяють це забезпечити.
Фізичні методи. 1. Перед посівом бактерій на живильне середовище його обов’язково регенерують для видалення надлишку розчиненого кисню. З цією метою середовище кип’ятять протягом 15-20 хв на водяній бані, а потім швидко охолоджують до необхідної температури.
2.Для попередження проникненя кисню в середовище його заливають шаром стерильної вазелінової олії або парафіном.
3.Стовпчик живильного середовища у пробірках повинен бути достатньо
високим (10-12 см). Кисень, як правило, дифундує в товщу стовпчика на глибину до 2 см, тому нижче створюються сприятливі умови для культивування анаеробних мікробів.
72 |
Частина І. Загальна мікробіологія |
4. Евакуаційно-замісний метод полягає у використанні анаеростатів. Вони представляють собою герметичні металеві або пластмасові банки, з яких можна викачати кисень і замінити його інертним газом (гелій, азот, аргон). Допускається використання трикомпонентної газової суміші, яка складається з 80 % азоту, 10 % диоксиду вуглецю та 10 % водню. Деколи допустимим вважається використання природногогазу. Дляпоглинаннякисню, якийзалишаєтьсяванаеростаті, використовують паладієві каталізатори. З метою поглинання водяної пари використовують хлорид кальцію, силікагель тощо, які поміщають на дно анаеростата.
Хімічніметоди. 1. Використанняречовин, здатнихпоглинатикисень. Зцією метою допустимим є застосування лужного розчину пірогалолу. При цьому враховуютьпоглинаючуактивністьречовини: на100 млємностігерметичноїпосудини, в якій знаходяться чашки Петрі, використовують 1 г пірогалолу і 10 мл 2,5 N розчину гідроксиду натрію.
Киснезв’язуючийефектмаєтакожгідросульфітнатрію(Na2S2O4). Длязв’язування кисню в 1 л повітря використовуютьсуміш, яка складається з 100 мл свіжого 20 % розчину Na2S2O4 і 16 мл 50 % гідроксиду калію.
2. Застосуванняречовин-редуцентів. Враховуючи, щорістоблігатно-анаероб- них бактерій відбувається в середовищах з низьким рівнем окисно-відновного потенціалу, донихдодаютьсяспеціальнівідновлювачі: цистеїн(0,03-0,0,5 %), тіогліколеву кислоту або тіогліколат натрію (0,01-0,02 %), сульфід натрію, аскорбінову кислоту (0,1 %), різноманітні цукри.
Функціївідновлювачівможутьвиконуватишматочкипаренхіматознихорганів тварин (печінка, нирки, серце) або навіть рослин (картопля, інші коренеплоди).
Ступінь поглинання кисню або ступінь відновлення середовища вимірюють абоелектрометричноабозадопомогоюіндикаторів(резазурин, нейтральнийчервоний, феносафранін).
3. Використання спеціальних газогенеруючих систем, які дозволяють створити безкисневі умови в мікроанаеростатах, транспортних пластикових пакетах тощо. Однією з найпоширеніших є система “Gas Generating Box”. До її складу входять хімічні генератори водню (борогідрит натрію) та вуглекислого газу (таблетки бікарбонату натрію та лимонної кислоти), а також паладієвий каталізатор, який поглинає кисень.
Чашки з посівами поміщаються в мікроанаеростат, на дні якого знаходиться шар паладієвого каталізатору. Кінчик пакета “Gas Generating Box” надрізають ножицями, і в нього наливають 10-15 мл води. Пакет розташовують у мікроанаеростаті. Через 15-20 хв у ньому створюються анаеробні умови. Водень, який виділяється, взаємодіє з киснем, утворюючи воду, а вуглекислота продукується при взаємодії бікарбонату натрію з лимонною кислотою.
Біологічні методи. 1. Метод Фортнера. Метод полягає в спільному культивування на одному середовищі аеробних і анаеробних мікроорганізмів. Спочатку подіаметручашкивирізаютьполоскуагарушириноюдо0,5-1,0 см. Зодногобоку засівають досліджуваний метралі, що містить анаеробні збудники, а з іншого – мікроби, що є індикатором анаеробних умов (Serratia marcescens або “чудесна па-
Розділ 4. Фізіологія бактерій |
73 |
личка”). Краї чашки парафінують або закривають пластиліном. За деякий час на поверхні середовища виростають колонії як аеробних, так і анаеробних мікробів. Припоглинанні киснюSerratia marcescens даєрістблідо-рожевихабобезбарвних колоній, а при порушеннях герметичності – яскраво-червоні. На іншій половині чашки виростають колонії анаеробних мікробів.
2. МетодХеннеля(“годинниковихскелець”). Вінєсвоєрідноюмодифікацією попереднього. Матеріал, щоміститьанаеробнізбудники, засіваєтьсянаповерхню живильногосередовищадіаметром2-2,5 см. Зверхувінпокривається“годинниковимсклом”, заповненимшаромМПАізасіянимSerratia marcescens. Аеробнімікроби, поглинаючи кисень, створюють умови для сприятливого росту анаеробних збудників.
У високо спеціалізованих лабораторіях користуються спеціальною анаеробною технікою, яка включає використання живильних середовищ без кисню із відновлювачами, виконання посівів і пересівів в атмосфері інертних газів, вуглекислоти тощо.
За останні роки створено стаціонарні анаеробні бокси, які містять все необхідне для створення анаеробних умов культивування, включаючи термостати. Як правило, такі камери заповнюються трикомпонентною газовою сумішшю. Бактеріолог працює в камері, перебуваючи зовні, застосовуючи гумові рукавиці, вмонтовані в неї. Таке устаткування має незаперечні переваги, які полягають у тому, що повністю виключається контакт кисню з досліджуваним матеріалом.
Виділення та ідентифікація анаеробних мікроорганізмів
Враховуючи сучасний розвиток мікробіологічної науки, виділяти та ідентифікувати культури анаеробних мікроорганізмів можна аналогічно аеробним бактеріям. Обов’язковим при цьому є дотримання на всіх етапах дослідження умов анаеробіозу, використовуючи для цьоготрикомпонентну газову суміш (упевному співвідношенні азот, воденьта вуглекислий газ) чи систему“Gas Generating Box”.
Однак збудники правця, ботулізму, газової анаеробної інфекції можна виділяти та ідентифікувати за іншою схемою.
Напершомуетапі(Іденьдослідження) вивчаютьмакроскопічніособливості клінічного матеріалу, роблять мазок і забарвлюють його за методом Грама. Після цього матеріал засівають на середовище Кітта-Тароцці та молоко. Попередньо середовище регенерують на киплячій водяній бані протягом 10-20 хв і охолоджують. Безпосередньопісляпосівуматеріалусередовищенагріваютьнаводянійбані при 80°С протягом 20 хв для знищення вегетативних неспорових форм мікробів. Середовища ставлять у термостат і при температурі 37 °С культивують 1-3 доби.
На другому етапі вивчають прояви росту мікроорганізмів (помутніння, утворенняосадутагазунасередовищіКітта-Тароцці, пептонізаціямолока). Оскільки середовище Кітта-Тароцці зверху залите шаром вазелінової олії для запобігання доступу кисню, в нього занурюють пастерівську піпетку, набирають рідину, з якої готують мазок, фарбуючи його за методом Грама. Під мікроскопом у мазку можна бачити великі грампозитивні паличкоподібні бактерії. Після цього прово-

74 |
Частина І. Загальна мікробіологія |
|
дять посів матеріалу за методами Вейнберга або Цейсс- |
|
лера для одержання ізольованих колоній. |
|
За методом Вейнберга готують декілька вузьких |
|
високихпробірок(3-4) зрозтоплениміохолодженимдо |
|
42-45 °С цукровим м’ясо-пептонним агаром. Можливе |
|
використання середовища Вільсон-Блера. Матеріал із |
|
середовища Кітта-Тароцці вносять у першу пробірку за |
|
допомогою пастерівської піпетки й ретельно перемішу- |
|
ють, потім переносять у другу, а далі – в третю. Для за- |
|
стигання агару їх швидко охолоджують під струменем |
|
холодної водопровідної води. За рахунок цього живі |
|
мікробні клітини фіксуються в певних ділянка агару. |
|
Післязастиганняагарупробіркикультивуютьприопти- |
Рис. 23. Ізольовані |
мальнійтемпературіпротягом1-2 дібдляутворенняізо- |
за методом Вейнберга |
льованих колоній (рис. 23). |
колонії анаеробів. |
Вміст кожної пробірки можна, крім того, всмокта- |
ти у пастерівські піпетки або трубки Віньяль-Вейона, стежачи, щоб не було бульбашок повітря. Останні мають довжину біля 30 см і діаметр 0,5-0,6 см. Верхній кінець їх, який закривається ватою, має перетяжку, а нижній витягнутий у вигляді капіляра. Після заповнення піпетки її витягнутий кінець запаюють і кладуть у термостат для культивування. Через 1-2 доби в агарі виростають колонії анаеробних бактерій. Для того щоб їх ізолювати, трубку надрізають напильником на певному рівні, розламують, колонію беруть бактеріальною петлею або голкою, переносять у відповідне середовище.
Для виділення ізольованих колоній за методом Цейсслера матеріал із середовища Кітта-Тароцці або молока наносять петлею або 1-2 краплі пастерівською піпеткоюначашкуПетрізцукрово-кров’янимагароміроблятьпосівшпателемза методомДригальського. Нестерилізуючишпатель, засіваютьдругучашку, апотім і третю. Чашки перевертають догори дном, підписують, ставлять в анаеростат, в якомустворюютьанаеробніумови, апотім– утермостатпритемпературі 37 °Сна 2-3 доби. На останній чашці виростають ізольовані колонії.
Третій етап дослідження починається з вивчення морфологічних особливостей колоній, які виросливчашках Петріаботрубках Віньяль-Вейона. Досліджуютьсяїхформа, величина, колір, характеркраїв, рельєфколонії, консистенціятощо. Зколонійготуютьмазки, фарбуютьїхзаметодомГрама. Післяцьогоколоніївідсівають у середовище Кітта-Тароцці для одержання чистої культури. Посіви інкубують певний час при оптимальній температурі.
На четвертому етапі звертають увагу на особливості росту чистої культури збудниківнавідповіднихсередовищах, перевіряютьїїначистотуіпроводятьідентифікацію. Ідентифікують виділені чисті культури анаеробних мікроорганізмів подібно до аеробних за морфологічними, культуральними, біохімічними та біологічнимиознаками. Обов’язкововикористовуютьвизначеннятоксигеннихвластивостей збудників у біологічниій пробі та реакції нейтралізації на лаборатор-
Розділ 4. Фізіологія бактерій |
75 |
них тваринах. У деяких випадках визначають антигенні властивості мікроорганізмів.
Таким чином, на підставі вивчення різноманітних властивостей мікроорганізмів робиться висновок про належність їх до того чи іншого виду.
Середовища для культивування анаеробних мікроорганізмів
Середовище Кітта-Тароцці готують на основі бульйону Хоттінгера, до якого додають шматочки бичачої печінки або мяса. Стерилізують його при 1 атмосфері протягом 30 хв. Активна реакція середовища – 7,4-7,6. Після посіву матеріалу середовище заливають зверху шаром вазелінової олії товщиною до 1 см.
Анаеробнийкров’янийагарготуютьнаосновіеритрит-агару. Дойогоскладу входятьтакожспеціальнідобавки: середовище199 (10 %), гемін(10 мкг/мл), твін80 (0,1 %), метадіон (10 мкг/мл), цитратна кров (до 5 %) тощо. Після стерилізації його розливають у чашки Петрі. Використовують не пізніше, як через 2 год після виготовлення.
Жовтковий агар. У розтоплене і охолоджене до 56-60 °С середовище на основі еритрит-агару додають суспензію курячого жовтка (20 %), глюкозу (0,2 %), гемін (10 мкг/мл) і розливають у чашки Петрі. Середовище використовують для визначення лецитиназної активності збудників, зокрема C. perfringens. При наявності лецитинази навколо колоній утворюються зони помутніння.
Комерційне середовище для контролю стерильності. Його можна використовувати як транспортне. Для поліпшення росту анаеробних бактерій до його складу можна вводити спеціальні добавки, такі як середовище 199, гемін, твін-80, метадіон, цитратна кров тощо.
Середовище Вільсон-Блера. Його готують на основі розтопленого й охолодженого до 60 °С 1 % цукрового (глюкоза) МПА рН 7,4 з додаванням на 100 мл 10 мл стерильного 20 % розчину сульфіту натрію і 1 мл 8 % розчину хлориду заліза. Готове середовище не стерилізують.
Його використовують для прискореної діагностики газової анаеробної інфекції, викликаноїClostridium рerfringens. Вжечерез1-2 годспостерігаютьзміну середовища: воно чорніє внаслідок відновлення сульфіту натрію в сульфат, який взаємодієзхлоридомзаліза, утворюючисульфідзаліза. З’являютьсятакожрозриви агару внаслідок інтенсивного газоутворення.
Лакмусовемолоко. Готуютьсередовищеізсвіжогомолока. Попередньойого кип’ятять і залишають у прохолодному місці на одну добу. Знімають верхній шар жиру і процедуру повторюють. Молоко фільтрують, і 10 % розчином бікарбонату натріюдоводятьрНдо7,2. Передстерилізацієюдомолока додають5-10 % лакмусової настойки та ідентичну кількість 10 % розчину бікарбонату натрію, щоб піна молока набула синьо-фіолетового відтінку. При підлужуванні молока воно стає синьо-фіолетовим, при підкислюванні – рожевим аж до червоного.
Ідентифікація мікроорганізмів за допомогою бактеріофагів
Бактеріофагимаютьвираженулітичнудіюнамікроорганізми. Цюособливість використовують для визначення їх виду. З цією метою у дві пробірки з м’ясо-
76 |
Частина І. Загальна мікробіологія |
пептонним бульйоном засівають досліджувану культуру бактерій. Потім в одну з них додаютьдекілька крапельіндикаторного фага. Пробірки інкубуютьприоптимальній температурі протягом 18-24 год. Порівнюють мутність бульйону в контрольній та дослідній пробірці і роблять висновок про чутливість мікроорганізмів до літичної дії бактеріофагів.
Можна з цією метою використати щільне живильне середовище, на яке газономзасіваютьдосліджуванукультурубактерій. Післяпідсушуваннячашокнаних бактеріологічною петлею або пастерівською піпеткою наносять краплю відповідного розведення бактеріофагу, яке вказане на ампулі. Посіви інкубують в термостаті при 37 °С протягом 18-24 год і фіксують наявність прозорих круглих плям, які свідчать про літичну дію бактеріофагу. Позитивний результат свідчить про належність бактерій до певного виду.
Фаготипування мікроорганізмів проводять з метою аналізу епідеміологічної ситуації для визначення джерела інфекції. Найчастіше його виконують при діагностиці стафілококових, кишкових та інших інфекцій.
В основі тесту лежить визначення фаговаріантів (фаговарів) збудників. Для цьогодночашки зм’ясо-пептонним агаром за числом бактеріофагів поділяють на квадрати. Вирощуютьчотиригодиннубульйоннукультурудосліджуваногоштаму і1 млїїзасіваютьнаповерхнюсередовища. Розподіляютьрівномірнокультуру по поверхні середовища і надлишок її зливають. Чашку підсушують у термостаті при 37 °Спротягом 30-40 хв і на поверхню агару в кожний квадрат капають піпеткою бактеріофаги відповідних розведень. Посіви ставлять у термостат або залишають при кімнатній температурі протягом 18-20 год, після чого оцінюють результати. Облік результатів проводять на темному фоні за допомогою лупи. Залежно від ступеня чутливості культури до бактеріофагів виділяють різні ступені лізису бактерій, який оцінюється за чотириплюсовою системою: від лізису, який зливається до його відсутності.
Враховуючи, що чутливість бактерій до фагу є достатньо постійною ознакою, порівнюють фаготиии досліджуваних культур з фаготипом мікробів, який було виділено від вірогідного джерела інфекції. При їх збігу роблять висновок про виявлене джерело інфекції.
Визначення бактеріоциногенності мікроорганізмів
Бактеріоцини є речовинами антибіотичної природи, які продукуються різними бактеріями. Вони мають досить вузький спектр протимікробної дії, спрямованийпротифілогенетичноблизькихзбудників. Цейтествикористовуютьзепідеміологічною метою для виявлення джерела інфекції, а також для ідентифікації певних груп бактерій.
Для визначення бактеріоциноварів на поверхню агару в чашці Петрі у вигляді смужки по діаметру засівають бактеріологічною петлею культуру збудника. Чашку інкубують у термостаті при оптимальній температурі протягом 24-48 год, потім мікроорганізми вбивають за допомогою УФВ або парів хлороформу. Культуру обережно знімають з поверхні агару за допомогою шліфувального скла, і до
Розділ 4. Фізіологія бактерій |
77 |
неї перпендикулярно штрихами бактеріологічною петлею підсівають 4-годинні бульйоннікультуриіндикаторнихштамів. Після18-24-годинноїінкубаціїприопти- мальній температурі оцінюють чутливість індикаторних штамів до бактеріоцинів за величиною зон затримки росту. Такий підхід дозволяє визначити бактеріоцинотип досліджуваних мікроорганізмів.
Для визначення чутливості досліджуваного штаму до певних бактеріоцинів у щільне живильне середовище уколом засівають індикаторні бактерії, які продукують певні типи бактеріоцинів. Після інкубування в термостаті мікроби, які виросли, інактивують за допомогою парів хлороформу або ультрафіолетового опромінення. Потімнаповерхнючашкизаливаютьрозтопленийіохолодженийдо45°С МПА, змішаний з 0,2 мл 4-годинної бульйонної культури досліджуваного штаму. Після того, як агар застигне, чашку знову поміщають у термостат і інкубують при оптимальній температурі протягом доби. За діаметрами зон затримки росту культури оцінюють чутливість її до бактеріоцинів.
Молекулярно-генетичні методи
Для виявлення та ідентифікації бактерій, вірусів, грибів і найпростіших останнім часом почали широко використовувати молекулярно-генетичні методи.
РеакціягібридизаціїДНКіРНК(реакціягеннихзондів). Послідовністьнук-
леотидівДНКіРНКєунікальноюдлягеноміввсіхмікроорганізмів. Будь-якуділян- ку нуклеїнової кислоти можна визначити за допомогою комплементарної копії ДНК чи РНК, міченої ферментом або радіоактивною міткою (ДНК- і РНК-зонди). Такі зонди отримані для більшості патогенних бактерій і вірусів. За їх допомогою проводять ідентифікацію ДНК або РНК збудників бактеріальних і вірусних інфекційуклінічному матеріалі. Реакціямолекулярноїгібридизаціїєдуже чутливою і високоспецифічною. Вона дає змогу виявляти ДНК або РНК в дуже малих кількостях (1-10 пг).
Методика реакції генних зондів зводиться до того, що виділені з патологічногоматеріалуДНКабоРНКзбудниківденатуруютьінаносятьнаспеціальнімембрани з нітроцелюлози. Після чого вносять ДНКабо РНК-зонди, витримують певнийчас, роблятьбагаторазову промивку, щобвидалитиреагенти, щонепрореагували. Якщовикористовувализондизрадіоактивноюміткою, результатвизначають за допомогою γ -лічильника. У випадку, коли зонд мічений ферментом (наприклад, пероксидазою), то до такого зонда додають субстрат (наприклад, ортофенілдіамін). Ферментація субстрату призводить до зміни кольору, який можнаспостерігати неозброєним оком.
Полімеразна ланцюгова реакція (ПЛР) – один із найновіших методів вияв-
лення та ідентифікації бактерій і вірусів у досліджуваних матеріалах. Принцип реакції базується на багаточисленному копіюванні (селективній ампліфікації) досліджуваної ДНК ферментом ДНК-полімеразою. Утворені копії ДНК ідентифікують за допомогою методу електрофорезу.
Реакціюпроводятьвтриетапи. Напершомуетапіпритемпературі95 °СпроходитьденатураціядвонитковоїмолекулиДНК, їїрозплетенняірозходженняниток.
78 |
Частина І. Загальна мікробіологія |
На другому етапі (ренатурація) відбувається гібридизація праймерів, тобто утворення дволанцюгових комплексів праймер-матриці, які необхідні для ініціювання синтезу ДНК. Температура суміші при цьому знижується до 55 °С.
Наетапісинтезу(75 °С) проходитьподовженнякомплементарнихнитокДНК за допомогою ферменту ДНК-полімерази. Проводять 15-35 циклів синтезу.
Багаторазове повторення приводить до збагачення ДНК у досліджуваному матеріалі.
Метод ПЛР дуже чутливий. Його використовують для виявлення будь-якого інфекційногоагента, якщовідомануклеотиднапослідовністьгена(абойогофрагмента), специфічного виключно до даного збудника. Доцільно використовувати ПЛР у тих випадках, коли бактерії чи віруси мають високу мінливість і знаходяться у досліджуваному матеріалі в малій кількості (навіть одна молекула геномної ДНК).
ЗаразПЛРналежитьдовисокоефективногомолекулярно-генетичногометоду, який доступний багатьом лабораторіям. Тривалість дослідження становить 2-3 години. Особливодоцільновикористовуватийогопривизначеннітаідентифікації збудників туберкульозу, сифілісу, гонореї, мікоплази, вірусів СНІДу, герпесів, гепатитів, ротата ентеровірусів.
Розділ 5
ЕКОЛОГІЯ МІКРООРГАНІЗМІВ
Живий мікросвіт людини і нашого довкілля зазнав великих змін. Продовжується інтенсивна мікробна корозія землі, колонізація різних об’єктів зовнішнього середовища й харчових продуктів зміненими бактеріями, грибами, вірусами. З рокуврікзростаютьносійствопатогенних бактерійсеред медичного персоналу та різноманітні дисбактеріози відносно здорових і хворих людей. Все частіше виникають шпитальні інфекції, спричинені патогенними й умовно-патогенними мікроорганізмами. Все це вимагає розробки нових і вдосконалення існуючих методівлабораторногодослідженнямікрофлориводи, повітря, грунту, іншихоб’єктів оточуючогосередовища, харчовихпродуктів. Важливогозначеннянабуваєвизначення дисбактеріозів людини, носійства золотистих стафілококів, менінгококів, збудниківдифтерії, холери, черевноготифу, дизентерії. Лікар будь-якого профілю повинен знати, як правильно взяти досліджуваний матеріал, доставити його до профільної лабораторії, провести мікробіологічне дослідження, правильно оцінювати його результати.
Мікробіологічне дослідження води
Мета проведення санітарно-мікробіологічного дослідження води може бути різною:
1. Вибір джерела водопостачання.
Розділ 5. Екологія мікроорганізмів |
79 |
2.Контроль знезараження питної води центрального водопостачання.
3.Визначення придатності для вживання криничної й джерельної води.
4.Перевірка якості і ступеня очищення стічних вод.
5.Розслідування водних спалахів інфекційних хвороб.
6.Контроль знезараження води плавальних басейнів.
7.Спостереженнязасанітарно-епідеміологічнимстаномвідкритихводоймищ. Санітарно-мікробіологічне дослідження води, перш за все, повинно вирішу-
вати питання про наявність або відсутнісфть у ній патогенних бактерій, вірусів і грибів. Алеїхбезпосереднєвиявленнямаєрядметодичнихтруднощів. Узв’язкуз цим широкого розповсюдження набули методи непрямої оцінки її епідеміологічного благополуччя шляхом виявлення так званих санітарно-показових мікроорганізмів і визначення загального мікробного числа (ЗМЧ).
Основним джерелом збудників заразних хвороб є люди й теплокровні тварини, які виділяють їх в оточуюче середовище фекальним або повітряно-краплин- нимшляхомразомзчисленнимипредставникаминормальноїмікрофлорикишечника й верхніх дихальних шляхів. Тому санітарно-показові мікроорганізми для різних об’єктів довкілля відібрані саме з представників нормальної мікрофлори. Дляводитакимисанітарно-показовимимікроорганізмамивусіхлабораторіяхсвіту прийняті бактерії групи кишкової палички (БГКП).
ДокатегоріїБГКПналежатьбактеріїродиниEnterobacteriaceaе, щооб’єднує роди Citrobacter, Enterobacter, Klebsiella. Це грамнегативні, безспорові, оксидазонегативніпалички, якіферментуютьглюкозуілактозудокислотийгазупри37 °С. Вони виділяються в зовнішнє середовище з випорожненнями людей і теплокровнихтваринієкількіснимпоказникомступеняфекальногозабрудненняводи. Тому чимбільшеїїфекальнезабруднення, тимвищаймовірністьконтамінаціїводивідповідними патогенними мікроорганізмами.
Серед БГКП окремо виділяють групу коліформних бактерій, а в ній – фекальні кишкові палички (ФКП), які розкладають лактозу при 44,5 °С. До E. coli відносять бактерії, що не ростуть на цитратному агарі. Саме вони є показником свіжого фекального забруднення. Для його визначення можна використати S. faecalis, який порівняно швидко гине в оточуючому середовищі.
При повноцінному санітарно-мікробіологічному дослідженні води визначають ЗМЧ, БГКП, E. coli, ентерококи, стафілококи, патогенні мікроорганізми (холерні вібріони, сальмонели, шигели, лептоспіри, ентеровіруси та ін.).
Взяття проб води. Для проведення мікробіологічного аналізу відбирають 500 см3 води у стерильні флакони, закриті ватно-марлевою пробкою, покритою зверхупаперовимковпачком. Взяттяпробзводопровіднихкранівпроводятьпісля обпалюванняїхспиртовимфакеломінаступноговипусканняводипротягом10 хв. Проби хлорованої води беруть у флакони з дехлоратором (на 500 см3 води 2 см3 1,5 % розчину гіпосульфіту натрію, простерилізованого в автоклаві).
Якщо дослідження проводять на виявлення не лише індикаторних, а й патогенних мікроорганізмів, потрібно брати пробу об’ємом 2500 см3 води. Коли визначають ще й індекс коліфагів об’єм проби збільшують до 3500 см3.
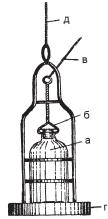
80 |
Частина І. Загальна мікробіологія |
|
У відкритих водоймах проби беруть за допомогою бато- |
|
метра. Цей прилад має металевий каркас із масивним дном- |
|
грузилом, всередині якого вміщують стерильний флакон, за- |
|
критий гумовим або скляним притертим корком (рис. 24). |
|
На потрібній глибині корок відкривають, потягнувши за |
|
шнур. Після заповнення флакона його відпускають, завдяки |
|
чомуємністьавтоматичнозакривається. Післявийманняфла- |
|
кона з батометра притертий корок замінюють ватно-марле- |
|
воюпробкою. Якправило, пробуводиберутьнаглибині15 см, |
|
але не ближче як за 10-15 см від дна водойми. |
|
На флакон із відібраною водою наклеюють етикетку, на |
|
якій вказують місце взяття проби, її номер, дату і час, темпе- |
|
ратуру води й повітря, прізвище санітарного лікаря чи його |
Рис. 24. Батометр: |
помічника, мету дослідження й адресу лабораторії, яка буде |
проводити аналіз. |
|
а – стерильний |
Мікробіологічне дослідження води необхідно провести |
флакон; б – пробка; |
|
в – шнур для відкри- |
не пізніше 2 год після її відбору. Якщо це неможливо, вказа- |
вання флакона; г – |
ний строк може бути продовжений до 6 год, але при умові |
грузило; д – шнур для |
транспортування проби при температурі 1-5 °С, що досяга- |
опусканняприладу. |
ють за допомогою пакетів з теплою водою взимку і льоду – |
влітку. Після доставки проб до лабораторії негайно проводять дослідження, яке включає визначення загального мікробного числа в 1 см3 води, числа бактерій групи кишкових паличок у 1 дм3 (індекс БГКП), число термостабільних кишковихпаличок(фекальнихколіформ– індексФК) у100 см3, числопатогеннихмікроорганізмів у 1 дм3, число коліфагів у 1 дм3 води, що досліджується.
Визначення загального мікробного числа води. Цей показник визначає кількість мезофільних, мезотрофних аеробів і факультативних анаеробів, які виростають на МПА при 37 °С протягом 24 год. Залежно від ступеня ймовірного бактерійногозабрудненняводусіютьізтакимрозрахунком, щобнаагарівчашках виростало від 30 до 300 колоній. Звичайну водопровідну або артезіанську воду сіють у нерозведеному стані в об’ємі 1 см3. Проби з відкритих водойм, криниць, джереліт.п. сіютьпісляпопередньогоїхрозведеннявід10-1 до10-3 ібільше(особливо стічних вод). Для цього в ряд пробірок наливають по 9 мл стерильної води, в першузнихвносять1 см3 досліджуваноїводи, ретельноперемішують, ізцієїпробірки переносять 1 см3 у другу, потім у третю і всі наступні по 1 см3 попереднього розведення. Длявиготовленнякожногорозведеннянеобхіднобратиновустерильну піпетку.
Нерозведенуаборозведенуводувоб’ємі1 см3 вносять, рівномірнорозкапуючи, на дно стерильної чашки Петрі, потім заливають її 10-12 см3 розтопленого й охолодженого до 45 °С м’ясо-пептонного агару. Обережними круговими рухами змішують воду з агаром. Як правило, сіють не менше двох розведень і для кожногознихвикористовуютьдвічашки. Післязастиганнясередовищапосівивирощують у термостаті при 37 °Спротягом24 год. Через добу підраховують число коло-
