
Практична мікробіологія - Климнюк С. І. - 2004
.pdf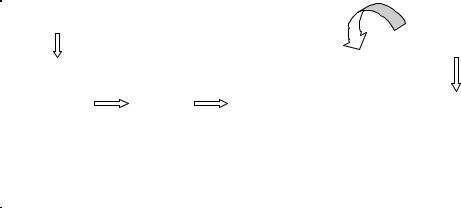
Розділ 9. Імунологічні методи діагностики інфекційних захворювань |
151 |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Антиген |
Перенос (блот) вірусних |
|
|
|
|
|
|
|
Антиглобулінова |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
білків на нітроцелюлозну |
|
|
|
|
|
|
|
мічена ензимом |
|
||||||||||||||
_ _ _ _ |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
мембрану |
|
|
|
|
|
|
|
сироватка |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Субстрат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ + + + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Електрофоретичне |
|
|
|
|
|
Розрізання мембрани |
|
Кольорові смуги утворились в |
|
||||||||||||||||||||||
розділення антигенів |
|
|
|
|
|
|
та інкубація |
місцях з’єднання антитіл сиро- |
|
||||||||||||||||||||||
|
|
|
вірусу |
|
|
|
|
|
|
із сироваткою хворого |
ватки хворого з антигенами вірусу |
|
|||||||||||||||||||
Рис. 57. Схема постановки імуноблотингу.
процесу. З її допомогою можна визначати антитіла не тільки класу IgG, але також анти-IgM, анти-IgA, анти-IgE.
Вестерн блот – методика, яка підтверджує факт зараження ВІЛ на основі виявлення антитіл. Вона використовується для диференціації ВІЛ 1 і ВІЛ 2, а також при змішаній інфекції ВІЛ 1 і ВІЛ 2. Все частіше її застосовують для діагностики захворювань, викликаних іншими вірусами і бактеріями (наприклад, Т. pallidum, B. burgdorferi).
Дослідження імунного статусу організму
Імунологічна система функціонує як багатокомпонентне єдине ціле. Усі її параметривзаємозв’язанііперебуваютьупостійномуколивномуритмі. Постійність імунологічного нагляду організму здійснюється за рахунок балансу між різними рівнямиактивностіструктурнихкомпонентівімунноїсистеми. Алеприрізноманітних патологічних станах показники імунітету можуть відхилятись від нормальних величин, що має як діагностичне, так і велике прогностичне значення і часто вимагає імунокорекції. Тому визначенню стану окремих ланок імунної системи надається велике значення.
Сучасна клінічна імунологія володіє широким арсеналом методів визначенняфункціональноїактивностіімунноїсистеми, яківкомплексімаютьвисокуінформативність, діагностичну і прогностичну цінність.
Згідно з існуючими регламентуючими документами, проводити оцінку імунологічного статусу рекомендується в наступних випадках:
1.При необхідності детального обстеження стану здоров’я людини.
2.При генетичних вадах імунної системи (первинні імунодефіцити).
3.При гострих і хронічних бактеріальних, вірусних і паразитарних інфекціях (вірусні гепатити, сепсис, хронічна пневмонія, лейшманіоз), підозрі на СНІД.
4.При автоімунних і алергічних захворюваннях.
5.При злоякісних новоутвореннях.
152 |
Частина ІІ. Імунологія |
6.При деяких хворобах нервової системи (розсіяний склероз).
7.Обстеження в геронтологічних і ендокринологічних клініках.
8.Обстеження реціпієнтів до і після трансплантації.
9.Дляконтролюцитостатичної, імунодепресивноїтаімуностимулюючоїтерапії. У даний час на практиці використовується двоетапний принцип оцінки
імунологічного статусу.
На першому етапі виявляють загальні характеристики або грубі дефекти у системі клітинного і гуморального імунітету та в системі фагоцитозу з допомогою найбільш простих, орієнтовних тестів. Цим вимогам відповідають наступні
тести першого рівня (орієнтовні):
•визначення відносного і абсолютного числа лімфоцитів у периферичній
крові;
•визначення кількості Т- і В-лімфоцитів крові;
•визначенняконцентраціїсироватковихімуноглобулінівосновнихкласів(М,
G, А);
•визначення фагоцитарної активності лейкоцитів.
Інформативність і надійність цих тестів достатньо висока. Результати можна одержати протягом першої доби.
Більш детальний аналіз імунологічного статусу бажано проводити на другому етапі, якщо мають місце відхилення в орієнтовних тестах або при наявності спеціальних показань.
Для встановлення рівня і вираженості імунологічного дефекту рекоменду-
ють наступні тести, які називаються аналітичними або тестами другого рівня:
•визначення субпопуляцій регуляторних Т-лімфоцитів ( Т-хелперів і супресорних клітин);
•визначення спонтанної міграції лейкоцитів і тест гальмування міграції лейкоцитів з використанням ФГА;
•постановка(привідсутностіпротипоказань) шкірнихтестівгіперчутливості сповільненої і негайної дії на туберкулін, грибкові антигени, алергени;
•дослідження проліферативної активності Т- і В-лімфоцитів в реакції бласттрансформації на мітогени, антигени;
•визначення активізаційних маркерів Т-лімфоцитів;
•оцінка синтезу імуноглобулінів в культурі В-лімфоцитів;
•оцінка активності кілерних лімфоцитів (К- і NК клітин);
•визначення компонентів комплементу;
•оцінка різних етапів фагоцитозу.
Оцінка стану В-системи імунітету
1. Визначення концентрації імуноглобулінів у сироватці (метод радіаль-
ноїімунодифузіїзаМанчіні).Принципполягаєвтому, щодосліджуванусироватку вносять у лунки агару, який містить поліклональні антитіла проти IgM, IgG або IgA у відомій концентрації. Імуноглобуліни дифундують в агар, в місцях їх взає-
Розділ 9. Імунологічні методи діагностики інфекційних захворювань |
153 |
модії з специфічним антитілом утворюються кільця преципітації, розмір яких залежить від кількості імуноглобулінів в сироватці. Іноді використовують імуноферментні тест – системи і моноклональні антитіла. Визначення IgЕ проводять радіоімунним і імуноферментним методами. Рівень сироваткових імуно- глобулінівзалежитьвідфункціональногостануВ-системиімунітету, якапостійно перебуває в стані спонтанної стимуляції різними мікроорганізмами, харчовими антигенами та ін.
2. Антитілоутворення після природної або штучної імунізації. Іншим показником фукціонування В-системи імунітету є дослідження рівня антитіл у крові досліджуваних без попередньої штучної імунізації: ізогемаглютинінівα іβ , антистрептолізинів, антитіл до E. coli.
Приштучнійімунізаціїможутьбутивикористанітакіпрепарати: АКДП, бактеріофаг ϕ Х174, фосфат полірибози та інші. Після введення антигену регулярно (не рідше як 1 раз на тиждень) протягом місяця визначають рівень сироваткових антитіл.
3. СтимуляціябіосинтезуімуноглобулінівВ-лімфоцитамиin vitro. Узв’яз-
кузтим, щоприімунізаціїможутьвиникатиускладнення, сталивизначатиздатність синтезувати антитіла окремими клітинами. Мононуклеари крові культивують in vitro з поліклональним активатором В-лімфоцитів – мітогеном лаконоса. В результаті стимуляції В-лімфоцити, які знаходились в суспензії мононуклеарних клітин, починають виробляти імуноглобуліни. Максимум їх продукції припадає на 7-12 день культивування.
Іншийспосіббазуєтьсянапідрахунку бляшкоутворюючихклітинпротиеритроцитів барана, оскільки при поліклональній стимуляції індукується продукція імуноглобулінів всіма клітинами, в тому числі і тими, які виробляють антитіла проти баранячих еритроцитів.
4.Шкірніпробидлявиявленнягіперчутливості негайноготипу. Результа-
ти оцінюють через 20 хв після введення алергену в шкіру. Позитивною вважається проба, якщо з’являється пухирець діаметром не менше 5-7 мм.
5.КількіснітестивизначенняТ- іВ-лімфоцитів. Великезначеннядлядос-
лідження стану імунної системи має підрахунок Т- і В-лімфоцитів. Лімфоцити виділяють із периферичної крові за допомогою методу градієнтного центрифугу-
вання. Кровхворого берутьізвенивпробіркузгепарином, розводятьізотонічним розчином хлориду натрію у співвідношенні 1:2 і обережно нашаровують на розчин фіколу. Для підвищення його щільності додають верографін або тріозил. Між плазмою і розчином фіколу утворюється ступеневий градієнт щільності. Після центрифугування еритроцити і гранулоцити проходять через фікол і осідають на дно, а моноцити і лімфоцити залишаються у вигляді кільця в інтерфазі. Клітини забирають піпеткою, відмивають і переносять в культуральне середовище.
Для їх підрахунку вживався метод спонтанного розеткоутворення.
Розеткоутворення – це процес взаємодії лімфоцитів і ксеногенних еритроцитів з утворенням клітинних конгломератів, які складаються з лімфоцита і приєднанихдоньогочужоріднихеритроцитів. Останнірозміщуютьсянавкололімфо-
154 |
Частина ІІ. Імунологія |
цита, і на вигляд такі конгломерати нагадують розетки. Спонтанне розеткоутворення спостерігається між лімфоцитами і еритроцитами певних видів тварин.
Т-лімфоцити людини, маючи рецептори до баранячих еритроцитів, утворюютьзнимирозетки. Осьчомуметодспонтанногорозеткоутвореннязеритроцитами барана (метод Е-розеткоутворення, від Е – еритроцити) використовується для виявлення Т-клітин людини. Ці лімфоцити позначають як Е-РУК (Е-розеткоутво- рюючі клітини).
В-лімфоцити людини мають на своїй поверхні рецептори до еритроцитів мишей і формують з ними спонтанні розетки. Цей тест можна використати для підрахунку В-лімфоцитів. Проте для виявлення В-лімфоцитів більш широко використовували методи розеткоутворення з урахуванням інших рецепторів, які є специфічними маркерами. Такими маркерами є рецептори до Fc-фрагменту імуноглобуліну і до С3 компонента комплементу.
При зв’язуванні комплексу антиген-антитіло (еритроцити – антиеритроцитарні антитіла) з рецептором до Fc-фрагменту формуються так звані ЕА-розетки. Коли ж до рецептора С3 приєднується комплекс антиген-антитіло-комплемент (еритроцитиантиеритроцитарніантитіла– С3) утворюютьсяЕАС-розетки. Відповідно В-лімфоцити часто позначають як ЕА-РУК або ЕАС-РУК.
Протеостаннім часом для підрахунку лімфоцитів вживаються більш сучасні і специфічні методики.
Однією із таких методик є цитофлуорометричне дослідження.
Одержані клітини обробляють моноклональними антитілами, кон’югованими з флуорохромами, проти мембранних антигенів лімфоцитів. Якщо одночасно визначають різні клітини, використовують антитіла, зв’язані з флуорохромами різного кольору.
Так, наприклад, В-лімфоцити визначають за допомогою поліклональних антитіл до загальних детермінант імуноглобулінів або моноклональних антитіл до одного з В-клітинних маркерів, найчастіше CD 19, 20 або 72. Для визначення субпопуляції В1 використовують метод подвійної імунофлуоресценції з використанням антитіл до CD 19 і CD 5, мічених різними флуорохромами.
Оцінка клітинного імунітету – стану Т-системи
1. Шкірні проби гіперчутливості сповільненого типу. Показником гіпер-
чутливості сповільненого типу, а відповідно реактивності системи Т-лімфоцитів, є позитивні проби при внутрішньошкірному введенні певних антигенів. По-пер- ше, це класична реакція Пірке, яка характеризується почервонінням, а іноді набряком, в місці введення туберкуліну або його очищеного препарату РРD. Можна вводити правцевий, дифтерійний або стрептококові антигени.
2. Стимуляція лімфоцитів in vitro. У певних ситуаціях лімфоцити крові післяїхстимуляціїin vitro збільшуютьсяврозмірахіперетворюютьсявбластоподібні клітини, які активно синтезують ДНК. Цей феномен називається реакцією бласттрансформації лімфоцитів (РБТЛ). Для її постановки використовують
Розділ 9. Імунологічні методи діагностики інфекційних захворювань |
155 |
специфічні (антигени) і неспецифічні мітогени (ФГА, конканавалін А, мітоген лаконосу).
Максимально виражена реакція після антигенної стимуляції спостерігається на 4-5 добу після культивування, на неспецифічні мітогени – на 3 добу. Порівняння результатів завжди проводять по відношенню до нестимульованого контролю. Найкращий спосіб обліку реакції базується на здатності клітин, що діляться, синтезуватиДНК. Збільшеннямітотичноїактивностіклітин( Т- іВ-лімфоцитів) можна визначитизазростаннямсинтезуДНК, додаючиза4-6 годдокінцякультивування мічені попередники ДНК (наприклад, Н3- тимідин). Кількість захопленого клітинами ізотопу визначають за допомогою сцинтиляційного лічильника. Відношен- нявеличинивключенняН3-тимідинувстимульованихкультурахдовеличинвклю- чення Н3-тимідину в культурах без стимуляції, відображає вираженість бластогенезуіназиваєтьсяіндексомабокоефіцієнтомстимуляції. Чимвищийцейпоказник, тим сильніше виражена РБТЛ. В нормальних умовах у здорових осіб індекс стимуляції складає 10-20 і вище.
3. Кількісні тести визначення Т-лімфоцитів. Т-лімфоцити підраховують за допомогою визначення Е-розеткоутворюючих клітин. Проте, як вже зазначалось, оптимальнимисучаснимиметодамиєметоди, вякихвикористовуютьмічені моноклональні антитіла до основного маркера Т-лімфоцитів – CD3.
4. Визначення субпопуляцій Т-лімфоцитів. Субпопуляції Т-лімфоцитів – Т-хелпери і Т-кілери визначають цитофлуорометричним способом з використанням мічених специфічних моноклональних антитіл відповідно проти CD4 і CD8.
5.Функціональна оцінка Т-хелперів. Із периферичної крові виділяють чисту суспензію В-лімфоцитів, культивують її in vitro з додаванням клітин, хелперну активність яких хочуть визначити. Оцінку хелперного ефекту проводять за величиною приросту синтезу імуноглобулінів по відношенню до культур, в які не додавали лімфоцити із хелперною активністю. Облік синтезу імуноглобулінів ведеться радіоімунним або імуноферментним методом.
6. Визначення медіаторів лімфоцитів (лімфокінів). Активація лімфоцитів антигенами або іншими біологічними стимуляторами (мітогени, АЛС і т.д.) зумовлює синтез лімфоцитами лімфокінів (фактор переносу, фактор, що пригнічує міграцію макрофагів МІФ, хемотаксичний фактор, лімфотоксин, інтерферони, інтерлейкіни, факторнекрозупухлинтаінші). Визначеннякількостітаактивності цихречовиндозволяєробитипевнівисновкипрофункціональнуздатністьлімфоцитів, має значення в діагностиці сепсису й визначенні ефективності протипухлинної терапії.
7. Цитотоксична активність К- і ПК-клітин. Лімфоцити, виділені із крові здорових донорів, можуть руйнувати клітини-мішені, які покриті (сенсибілізовані) специфічнимиантитілами. Цейтипцитотоксичностіодержавназвуантитілозалеж- ноїклітинно-обумовленоїцитотоксичної реакції. Такілімфоцитибули названіК-клі- тинами (К – кілер). Це великі гранулярні клітини, основним маркером яких є CD16.
Для виявлення активності К-клітин використовують еритроцити, які сенсибілізуютьспецифічнимиантитілами. Післятакоїсенсибілізаціїеритроцити(кліти-
156 |
Частина ІІ. Імунологія |
ни-мішені) мітять51Сr таінкубуютьзлімфоцитами. Останні, лізуючиеритроцити, зумовлюють виділення в середовище радіоактивного хрому. Чим більше ізотопу вивільняється в середовище, тим вища величина цитотоксичності К-лімфоцитів. Зміна показників цього тесту може спостерігатися при автоімунних захворюваннях, а також при деяких імунодефіцитних станах.
Природні кілери (ПК-клітини) знищують чужорідні клітини без участі антитіл. Специфічним їх маркером є CD56. Їх можна виявити, якщо змішати лімфоцити із пухлинними клітинами, міченими радіоактивним хромом. За кількістю виходу із зруйнованих клітин радіоактивної речовини, роблять висновок про активність природних кілерів.
Як К-клітини, так і ПК-клітини також можна визначати за допомогою цитофлуорометричного методу, використовуючи відповідні моноклональні антимаркерні антитіла (анти CD16 і CD56).
Слід зауважити, що існує популяція кілерних клітин, яка володіє одночасно двома вищевказаними антигенними маркерами (CD16 і CD56).
Визначення стану системи фагоцитозу
Існуєдекількаметодіввизначенняфагоцитарноїактивностінейтрофілів. Суть одногознихполягаєвтому, щовиділенінейтрофілизмішуютьзрівноюкількістю суспензіїгрибківкандидавприсутностіАВ-сироватки. Клітинипоміщаютьвтермостатпри37 °Сна1 годину. Післяінкубаціїлейкоцитируйнують2,5 % розчином дезоксихолату натрію і фарбують 0,01 % розчином метиленової синьки. Підраховують кількість вбитих клітин грибів.
При іншому способі 0,1 мл крові хворого наносять на знежирене покривне скельце і витримують у вологій камері при 37 °С 45 хв, після чого згусток, що утворився, видаляють пінцетом. Покривне скельце з фіксованими на ньому нейтрофілами промивають в розчині Хенкса, наносять визначену кількість культури стафілококаабокишечноїпаличкиізновуінкубуютьувологійкамері30 хв. Після чогоскельцепромиваютьурозчиніХенкса, препаратвисушують, фіксуютьіфар- буютьзаРомановським–Гімзою. Облікфагоцитарноїактивностіпроводять, визначаючи відсоток нейтрофілів із фагоцитованими бактеріями (фагоцитарне число) і кількість поглинутих мікробів з розрахунку на один нейтрофіл (фагоцитарний індекс). У кожному препараті підраховують не менше 200 клітин.
Бактерицидна активність фагоцитів в основному обумовлена ферментним набором клітини. Тому непрямі показники порушення бактерицидної активності можна одержати шляхом визначення різних клітинних ферментів, які характеризуютьокисніпроцеси(пероксидаза, кислаілужнафосфатаза тощо). Зцієюметою частовикористовуютьреакціювідновленнянітросиньоготетразоліюукольоровій цитохімічній реакції.
Результати визначення дають можливість оцінити генерацію формазану за появою синього забарвлення. Аналогічний результат дають люмінесцентні способи реєстрації утворення метаболічно активних форм кисню і вільних радикалів методами реєстрації хемолюмінесценції, яка підсилюється люмінофорами.
Розділ 9. Імунологічні методи діагностики інфекційних захворювань |
157 |
Існують і інші методи, які дозволяють аналізувати автоматично кількісно в окремих клітинах відновлення нітросинього тетразолію з допомогою цитофотометра, сполученого з мікроскопом, аналізаторів відеозображення тощо.
Рухливість фагоцитів (лейкоцитів або моноцитів) досліджують за величиною спонтанної міграції із капілярів, а також за зміною міграції в присутності хемотаксичних агентів. Найбільш об’єктивним методом оцінки бактерицидної активності фагоцитів є використання бактерій, мічених радіоактивними ізотопами, з наступним радіоактивним обліком зруйнованих бактерій.
Визначають такожкількістьнейтрофілів, щонесутьнасобіFс, С3 рецептори та ін. (в реакції ЕА і ЕАС-розеткоутворення).
Визначення активності системи комплементу
В десять пробiрок вносять сироватку хворого 1:10 (табл. 27), починаючи з 0,05 мл в першу, збiльшуючи кiлькiсть в кожнiй наступнiй на 0,05 мл i до 0,5 мл. Вiдповiдно до загального об’єму 1,5 мл додають в кожну пробiрку визначену кiлькiсть ізотонічного розчину хлориду натрію, а потiм по 1,5 мл попередньо сенсибiлiзованихеритроцитiв. Пiсляiнкубацiїпри37°Спротягомгодинипробiрки охолоджують, еритроцити осаджують центрифугуванням i оцiнюють результати за гемолiзом.
Таблиця 27
Визначення титру комплементу в сироватцi кровi
Компоненти, мл |
|
|
|
|
Пробірки |
|
|
|
|
Контроль |
|||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
||
|
|||||||||||||
Сироватка хворого |
0,05 |
0,1 |
0,15 |
0,2 |
0,25 |
0,3 |
0,35 |
0,4 |
0,45 |
0,5 |
0,5 |
- |
|
(1:10) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ізотонічний розчин |
1,45 |
1,4 |
1,35 |
1,3 |
1,25 |
1,2 |
1,15 |
1,1 |
1,05 |
1,0 |
1,0 |
1,5 |
|
хлоридунатрію |
|
|
|
|
|
|
|
|
|
|
|
|
|
Гемолітична |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
|
система |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Термостат 37 °С - 60 хв
Результат
Окремікомпонентисироватковогокомплементувизначаютьвреакціїпреципітаціїзвикористаннямспецифічнихантисироватокізадопомогоюмоноклональних антитіл імуноферментним методом. Це має велике практичне значення – особливо для виявленнягенетичних дефектів системи комплементу. Тому що, визначаючигемолітичнуактивністькомплементу, можнаматитількизагальнууявупростан комплементу і ні в якому разі не можна зробити висновок про стан імунної системи особи.
Інодідлядослідженняфакторівнеспецифічноїрезистентностіорганізмувизначають в сироватці людини титр лізоциму і бета-лізинів (табл. 28).
В5 пробiрокрозливаютьпо0,5 млфiзiологiчногорозчину. Впершупробiрку вносять 0,5 мл дослiджуваної сироватки (1:5). Починаючи з цiєї пробiрки,

158 |
|
|
|
|
|
Частина ІІ. Імунологія |
|
Визначення активностi лiзоциму в сироватцi кровi |
Таблиця 28 |
||||||
|
|||||||
|
|
|
|
|
|
|
|
Компоненти |
|
|
Пробiрки |
|
|
||
1 |
2 |
|
3 |
|
4 |
5 |
|
|
|
|
|||||
Фiзрозчин, мл |
0,5 |
0,5 |
|
0,5 |
|
0,5 |
0,5 |
Сироватка хворого (1:5), мл |
0,5 |
→ |
|
→ |
|
→ |
↓ |
Одержанерозведення |
1:10 |
1:20 |
|
1:40 |
|
1:80 |
1:160 |
Micrococcus luteus (1 млрд/мл) |
0,5 |
0,5 |
|
0,5 |
|
0,5 |
0,5 |
Експозицiя |
|
15 хв при 45 °С |
|
|
|||
Результати |
|
|
|
|
|
|
|
послiдовно переносять iз пробiрки в пробiрку, закiнчуючи четвертою по 0,5 мл. З четвертої – 0,5 мл виливають. Потiм в усi пробiрки додають по 0,5 мл 1 млрд. суспензiї Micrococcus luteus. Пiсля прогрiвання пробiрок при 45 °С протягом 15 хв. враховуютьрезультати за максимальним розведенням сироватки, що викликало розчинення бактерiй.
Титр бета-лізинів визначають аналогічно вище поданому методу, за винятком того, що в якості тест-мікроба використовують культуру B. subtilis.
Нижченаведеноорієнтовніпоказникистануімунноїсистемиздоровоїлюдини (табл. 29).
Приінтерпретаціїрезультатівімунограмнеобхіднопроводитисукупнийкомплексний аналіз показників. Тільки значнізсуви показників±20-40 % і більше від норми дають реальну інформацію про зміни. Вказані показники завжди потрібно оцінювати в динаміці і виключати можливість їх коливань у зв’язку з фізичним навантаженням, харчуванням, часом доби, сезонністю тощо.
А.М. Земсковзапропонувавуніверсальнийметодвиявленняімуннихрозладів за наступною формулою:
|
Показникконкретногохворого |
|
|
|
|
−1 |
100 |
|
|||
|
Показникприйнятий занорму |
|
|
|
|
|
Колипідрахованавеличинамаєзнак“мінус”, упацієнтаєознакиімунологічноїнедостатності, признаку“плюс” – гіперфункція імунноїсистеми. Коли визначена величина знаходиться в інтервалі від 10 % до 33 %, це відповідає першому ступеню імунних розладів, від 34 до 66 % – другому, більше 66 % – третьому.
Запропоновановиділятилегкийступіньімунодефіциту, якийхарактеризується нормальним або незначним зниженням кількості Т-, В-клітин, нормальною спонтанною міграцією лейкоцитів. При середньому ступені відмічається зменшеннякількостілімфоцитів, Т-клітин, значнезниженняміграціїлейкоцитів. Важкий ступінь дефекту імунітету проявляється значною лейко- і лімфопенією, зменшенням вмісту Т-клітин, пригніченням міграції лейкоцитів.
Останнімчасомзапропонованоновіпідходидооцінкиімунногостатусулюдини. Один з них базується на патогенетичному принципі аналізу імунного статусу.
Цей спосіб передбачає оцінку основних етапів імунної відповіді – розпізнавання, активацію, проліферацію, диференціацію та імунорегуляцію.

Розділ 9. Імунологічні методи діагностики інфекційних захворювань |
159 |
||||||
Показники імунного статусу людини |
|
Таблиця 29 |
|||||
|
|
||||||
|
|
|
|
|
|
|
|
Показники |
|
|
|
Вміст в 1 мкл (%) |
|||
Абсолютне число лейкоцитів |
|
|
4500-7000 (100%) |
||||
У томучислі: нейтрофілів |
|
|
4000 (65%) |
||||
Еозинофілів |
|
|
200-400 (4%) |
||||
Абсолютне число лімфоцитів |
|
|
1500-2000 (25%) |
||||
- CD3 (T-загальні) |
|
|
800-1200 |
||||
- CD4 (Т-хелпери) |
|
|
500-900 |
||||
- CD8 (Т-кілери) |
|
|
400-600 |
||||
- CD16 (NK) |
|
|
170-400 |
||||
- CD20 (В-клітини) |
|
|
200-400 |
||||
HLA II |
|
|
340-720 |
||||
Імуноглобуліни |
|
|
|
|
|
|
|
IgG |
|
|
|
8-12 г/л |
|||
IgM |
|
|
|
0,5-1,9 г/л |
|||
IgA |
|
|
|
1,4-4,2 г/л |
|||
IgE |
|
|
|
20-100 КЕ/л |
|||
ЦІК, (умов. од.) |
|
|
|
|
20-80 |
||
Фагоцитоз |
|
|
|
|
|
|
|
|
Спонтанний |
Стимульований |
|
Індексстимуляції |
|||
НСТ-тест (од. млн.кл.) |
|
70-120 |
150-200 |
|
1,2-2 |
||
Фагоцитоз (%) |
|
48-88 |
|
|
|
|
|
Індекс фагоцитозу |
|
1,3-3 |
|
|
|
|
|
Адгезія (%) |
|
40-55 |
70-80 |
|
|
||
Реакція бласттрансформації |
|
|
|
|
|
||
|
|
ФГА |
|
|
|
|
PWM |
РБТЛ |
|
20-100 |
|
|
|
5-20 |
|
Комплемент |
|
|
|
|
|
|
|
C1q |
|
|
100-250 |
||||
C3 |
|
|
700-1800 |
||||
C4 |
|
|
200-500 |
||||
C5a |
|
|
0,01-0,03 |
|
|
||
|
|
|
|
|
|
|
|
Процес розпізнавання можна вивчати, досліджуючи взаємодію антигенпрезентуючих клітин і лімфоцитів, розпізнавання специфічного антигену, імунну відповідь у змішаній культурі лімфоцитів.
Другий етап – активацію оцінюють за експресією антигенів ГКГ ІІ, рецепторів до ІЛ-2, трансферину тощо.
Третійетап– вивчаютьпроліфераціюлімфоцитівпідвпливоммітогенів(ФГА, ЛПС, КонА) і антигенів.
Четвертий етап – диференціацію клітин досліджують шляхом лізису клітин- мішенейТ-лімфоцитами, природнимикілерами, макрофагами, атакожсинтезімуноглобулінів і продукцію цитокінів.
160 |
Частина ІІ. Імунологія |
Імунорегуляцію оцінюють за синтезом макрофагами цитокінів і дослідженням субпопуляцій Т- і В-лімфоцитів.
Центральне місце в патогенетичному принципі вивчення імунного статусу займає концепція позитивної і негативної клітинної активації.
При позитивному результаті процес активації лімфоцитів, їх проліферація і диференціаціязавершуютьсяреалізацієюїхбезпосередніхфункцій. Додатководо вищенаведених тестів суттєвим є визначення експресії на Т-лімфоцитах молекул CD2, CD28, CD 40L, на В-лімфоцитах – CD23, молекул ГКГ ІІ, синтез інтерлейкіна 13 та ін.
Негативна активація завждизакінчуєтьсяапоптозом. Томуважливе значення має визначенняапоптознихмаркерів на імунокомпетентних клітинах (Fas антигену і ліганд Fas антигену та ін).
Розділ 10
ІМУНОПРОФІЛАКТИКА ТА ІМУНОТЕРАПІЯ ІНФЕКЦІЙНИХЗАХВОРЮВАНЬ
Характеристика вакцинних препаратів. Інфекційні хвороби можна попе-
редити шляхом активної або пасивної імунізації. Активна імунізація проводиться з допомогою вакцинних препаратів.
Вакцини– препарати, одержанізбактерій, вірусівтаіншихмікроорганізмів, їх хімічних компонентів, продуктів життєдіяльності або виготовлені штучним шляхом, якізастосовуютьсядляактивноїімунізаціїлюдейітваринзметоюпрофілактики і лікування інфекційних хвороб.
Усі вакцини за способом одержання й характером антигенів поділяють на живі, вбиті, хімічні, субклітинні, субодиничні, анатоксини, штучні на основі рекомбінантнихДНК, антиідіотипові. Закількістюантигеніврозрізняютьмоно-, ди- , три-, тетравакцини тощо.
Для забезпечення виробництва нешкідливих, стандартних вакцин існує єдина система їх випробування і застосування. Вона передбачає: одержання вакцинного штаму, виготовлення достатньої кількості препарату, експериментальна перевірка його на стерильність, токсичність, реактогенність, імуногенність на тваринах, оцінка ефективності на обмеженому контингенті людей, вивчення ефективності при масовому застосуванні.
Живівакцини– біологічніпрепарати, виготовленізживихбактерійабовірусів ізпониженоювірулентністю, алевираженимиімуногеннимивластивостями. Вони нездатні в звичайних умовах викликати захворювання, але слабкий інфекційний процес при цьому має місце. Тому живі вакцини, як найбільш ефективні препарати для щеплення, індукують довготривалий і напружений поствакцинальний іму-
