
Практична мікробіологія - Климнюк С. І. - 2004
.pdf
Розділ 4. Фізіологія бактерій |
51 |
натрію. Цейметоднезабезпечуєповноїстерилізації, оскільки спори деяких видів бацил і клостридій витримують кип’ятіння протягом декількох годин.
Стерилізацію сухим жаром у сухожаровій шафі проводять при 160 °С протягом 120-150 хв, або при 180 °С – 45-60 хв після досягнення заданої температури (рис. 15). Стерилізують переважно скляний посуд. Перевага цього методу над іншими полягаєвтому, щонепошкоджуєтьсяскло, невідбувається корозії металевих інструментів. Його можна використати для стерилізації термостійких порошків та інших речовин. Одним з недоліків даного методу є достатньо тривалий строк стерилізації.
Крім того, при високих температурах може відбу- Рис. 15. Сухожарова шафа. тися обвуглювання і загоряння ватних пробок, паперу, в який загорнутий посуд.
Стерилізація парою під тиском – найнадійніший метод повного знищення бактерій та їх спор. Він досягається дією пари, температура якої під тиском вища, ніж при кип’ятінні. Таку стерилізацію проводять в автоклаві. Стерилізація парою під тиском більш ефективна, ніж дія сухого жару.
Існують різноманітні електричні автоклави, які відрізняються між собою за розмірами, формою, розташуванням(вертикальнітагоризонтальні), вониможуть бути з ручним керуванням, напівавтоматичні й автоматичні.
Конструктивно всі типи автоклавів представляють собою двостінний міцний металевий котел циліндричної форми з кришкою, яка герметично закривається, що дозволяєвитримативисокийтиск(рис. 16). Внутрішнячастинаавтоклавуєстерилізаційноюкамерою(1), вякувміщуютьматеріал, щостерилізується. Вонамаєспеціальний кран для виходу повітря (2) і манометр (3) із запобіжним клапаном (4). Манометр визначає робочий тиск пари в камері, а запобіжний клапан сприяє виходу надлишку пари з метоюзапобігання розриву автоклава. Дистильовану воду в водопарову камеру заливають через спеціальну лійку (6), стежачи за її рівнем у спеціальнійводомірнійтрубці(7). Параізводопаровоїкамерипоступаєвстерилізаційну камеручерезспеціальніотворивїїверхнійчастині. Сучасніавтоклавимаютьманометриіавтоматичнірегуляторивключенняівідключенняструму, тримаючизаданий тиск, а отже й задану температурувсередині автоклава. Робота з ним вимагає суворого дотримання правил безпеки, які викладені в інструкції до кожного автоклава.
Основні правила роботи з автоклавом
1.Передпочаткомроботислідретельнооглянутиавтоклав, йогоконтрольновимірювальну апаратуру, перевірити пружність резинової прокладки, кріплення кришки стерилізаційної камери.
2.Через спеціальну лійку до рівня відмітки на водомірній трубці в автоклав заливають дистильовану воду і закривають кран.
3.Необхідний матеріал вміщують у стерилізаційну камеру і закривають гер-
метичнокришкоюавтоклава. Бажаностежити, щобпредметинерозташовувались

52 |
Частина І. Загальна мікробіологія |
Схемаавтоклава:
1 – стерилізаційна камера;
2 – кран для виходу повітря;
3 – манометр; 4 – запобіжний клапан; 5 – водопарова камера; 6 – лійка для заливу автоклава водою; 7 – водомірна трубка; 8 – отвори для поступлення пари в стерелізаційну камеру;
9 – захисний кожух;
10 – кришка автоклава;
11 – підставка для розміщення предметів для стерилізації.
Рис. 16. Автоклав.
в автоклаві дуже тісно, оскільки між ним повинна проходити пара. В іншому випадкувониможутьзалишитисьнестерильнимичерезвідсутністьнагрівудонеобхідної температури.
4.Відкривають кран, який з’єднує стерилізаційну камеру з оточуючим середовищем, і включають електричний нагрів.
5.Післятого, якпочавсяпроцес утворенняпари, необхідновидалитиповітря із стерилізаційної камери. Для цього пару і конденсат відводять у спеціальну по-
судину з водою або в каналізацію. Чисту пару, яка виходить з автоклава з рівномірнимшиплячимзвуком, протягом10 хвпропускаютьчерезкамеру, апотімзакривають паровідвідний кран.
6. Доводять тиск пари до рівня, якого вимагає режим стерилізації. Для цього враховують співвідношення показників тиску манометра і температури кипіння води (табл. 1).
7. По завершенні циклу стерилізації автоклав відключають. Тиск в автоклаві поступово падає і зрівнюється з атмосферним. Тоді відкривають випускний кран і поступово випускають надлишок пари у посудину з водою. Недотримання цих правил може призвести до різкого зниження тиску, внаслідок чого рідина в пробірках, колбах, які стерилізувались, бурхливо закипає, змочуючи ватно-марлеві пробки і навіть виштовхуючи їх. Така ситуація порушує стерильність матеріалу.
В автоклаві при 120 °Спротягом 20 хв стерилізуютьпростіживильнісередовища (МПБ, МПА), ізотонічні розчини, білизну, перев’язочний матеріал, а при 134 °С – знешкоджують заразні матеріали, відпрацьовані культури бактерій протягом 40 хв. Середовища з вуглеводами не витримують такої обробки, оскільки вони карамелізуються, у зв’язку з чим їх стерилізують текучою парою.
Стерилізація текучою парою (100 °С) проводиться в автоклаві з незагвинченою кришкою. При нагріванні пара проникає між вкладеними об’єктами й стерилізує їх. Таким способом обробляють середовища з вуглеводами. Оскільки од-

Розділ 4. Фізіологія бактерій |
|
53 |
|
|
Таблиця 1 |
Залежність між надлишковим тиском пари, температурою кипіння води |
||
|
і тривалістю стерилізації |
|
|
|
|
Тиск пари, атм |
Температура, °С |
Час стерилізації, хв |
|
|
|
0 |
100 |
30-60 |
0,5 |
112 |
20-30 |
1,0 |
121 |
15-20 |
1,5 |
127 |
15-20 |
2,0 |
134 |
15 |
|
|
|
норазовадіяпариневбиваєспори, застосовуютьдробнустерилізацію– 3 дніпідряд по 30 хв. Ті спори, які не загинули при першому нагріванні, проростають до наступного дня у вегетативні клітини й гинуть при другій і третій обробці.
Для тих речовин, які не витримують 100 °С (білкові рідини, вітаміни, деякі ліки), застосовують тиндалізацію – стерилізацію на водяній бані при температурі 58-60 °С протягом години 5-6 днів підряд. Однак цей метод зараз широко не застосовується, оскільки вимагає значних затрат часу на його проведення.
Пастеризацією вважають одноразове прогрівання матеріалу до температури нижче 100 °С, при якій знищуються, в першу чергу, вегетативні форми мікроорганізмів. Цей спосіб вперше запропонував Л. Пастер для знищення безспорових форм мікробів, переважно патогенних і умовно-патогенних видів. Спори при цьому залишаються живими, а мікроорганізми, що залишились, стають помітно ослабленими. Методшироко використовуютьухарчовійпромисловості, колипри кип’ятінні можуть втратитись органолептичні властивості продуктів. Так проводять термічну обробку молока, пива, вина, різних соків при 70 °С протягом 30 хв або при 80 °С – 5-10 хв. Пастеризовані продукти зберігаються на холоді.
Згортання (ущільнення) сироватки і яєчних середовищ з одночасною їх стерилізацією проводять у спеціальних згортувачах Коха з електричним підігрівом (рис. 17). Асептично приготовлені сироватки та яєчнісередовищаунахиленомуположенніпрогрівають однократно при 80-90 °С одну годину. При підозрі на мікробну контамінацію їх прогрівають при тій же температурі три дні підряд.
Механічні методи стерилізації широко вико- |
|
|
ристовуються в мікробіологічних лабораторіях. |
|
|
Особливозатихумов, колипідвищенатемпература |
|
|
може зруйнувати субстрати. Це стосується рідких |
|
|
середовищ і рідин, які містять білки, вітаміни, ан- |
|
|
тибіотики, вуглеводи, леткі речовини тощо. Метод |
|
|
можназастосуватидляочищеннябактеріальнихток- |
|
|
синів, бактеріофагіввідмікроорганізмів. Однакцей |
Рис. 17. Апарат для |
|
метод вважається менш надійним порівняно із кла- |
||
стерилізації і згортання |
||
сичною стерилізацією. |
(ущільнення) сироватки. |

54 |
Частина І. Загальна мікробіологія |
Механічна(холодна) стерилізаціяпроводиться задопомогою фільтрування через дрібнопористі антибактеріальні чи антивірусні фільтри. Їх створюють із спеціальних матеріалів, пронизаних порами, які мають різну форму та йдуть через фільтр звивисто. Фільтри можна виготовляти із позитивно зарядженого матеріалу, тоді бактерії, що несуть на поверхні негативний заряд ще й взаємодіють з ним електростатично, анетількимеханічновнаслідок різногодіаметру бактерійі пор. Щоб попередньо перевірити якість фільтрів, використовують дрібні тест-
мікроорганізми (Serratia marcescens або Pseudomоnas aeruginosa). Фільтрат висі-
вають на живильне середовище і витримують при оптимальній температурі протягом5 днів. Привідсутностіростутест-бактерійможназастосовуватифільтрдля стерилізації.
Промисловістьрізнихкраїнвипускаєнайрізноманітнішіфільтри, якірізняться заматеріалом виготовленняйдіаметромпор. Мембранніабоколоїдніфільтри, які виготовляють із нітроцелюлози, представляють собою диски діаметром до 35 мм. Нижче наведено характеристики різних фільтрів (табл. 2).
|
|
Типи фільтрів |
|
Таблиця 2 |
|
|
|
|
|
||
|
|
|
|
|
|
Фільтри країн СНД |
Фільтри фірми „Мілліпор” |
Фільтри фірми „Синпор” |
|||
номер |
діаметр пор, |
тип фільтра |
діаметр пор, |
тип фільтра |
діаметр пор, |
фільтра |
мкм |
|
мкм |
|
мкм |
1 |
0,35 |
VF |
0,01 |
1 |
4,0 |
2 |
0,5 |
VM |
0,05 |
2 |
2,5 |
3 |
0,7 |
VC |
0,10 |
3 |
1.5 |
4 |
0,9 |
SLGS |
0,22 |
4 |
0,85 |
5 |
1,2 |
SLHA |
0,45 |
5 |
0,60 |
6 |
3,5 |
DA |
0,65 |
6 |
0,40 |
|
|
AA |
0,8 |
7 |
0.30 |
|
|
RA |
1,2 |
8 |
0,23 |
|
|
SS |
3,0 |
9 |
0,17 |
|
|
SM |
5,0 |
10 |
0,12 |
У мікробіологічних лабораторіях часто використовують фільтри Зейтца (рис. 18). Вони представляють собою пластини (диски або квадрати) товщиною 4-6 мм, які виготовляють із суміші азбесту і целюлози.
Однакціфільтримаютьряднедоліків, якіслідвраховуватиприроботізними. По-перше, можливе забруднення фільтратів сторонніми речовинами, які попадають у нього з фільтра (луги, солі лужних металів, волокна азбесту). По-друге, азбест внаслідок свого негативного заряду зв’язує деякі речовини з рідини, що фільтрується. Крім того, слід ретельно перевіряти фільтри передроботою, щобне використовувати ті, які мають механічну деформацію (тріщини, надломи тощо).
Крім азбестових, широко використовуються фарфорові фільтри, вперше запропоновані Пастером і Шамберланом. Їх інакше називають свічки Шамберлана. Виготовляють їх із каоліну й кварцового піску та надають форми порожнистого

Розділ 4. Фізіологія бактерій |
55 |
циліндра, якийзакритийзодного кінця. Величина пор позна-
чається L1-L13. Фільтри L5-L13 є антибактеріальними.
Іншийтипфільтрів, яківиготовляють з інфузорної землі (діатомітуабокізельгуру), одержав назву свічок Беркефельда. За своїм зовнішнім виглядом вони подібні до циліндрів, замкнутихзодногозкінців. Свічки маркуютьлітерамиV, N i W, що відповідаєдіаметрупорвмежах
відповідно 8-12, 5-7 і 3-4 мкм. Рис. 18. Фільтр Зейтца. Свічки Шамберлана.
Випускаються ще й стерилізуючі фільтри із скла „Пірекс” у вигляді двошарових дисків. Поділяють фільтри
за розміром пор на три основних типи: С, М і Р. Розмір пор у них відповідно становить понад 1,7, від 1 до 1,7 і менше 1 мкм.
Перед роботою фільтр закріпляють у спеціальному тримачі. Зокрема, азбестові пластинки вміщують між циліндричною й опорною частиною металевого корпусу апарата Зейтца. Обидві частини з’єднують гвинтами. Зібраний фільтр вставляютьугумовийкорокколбиБунзеназбоковимвідростком. Повністювмонтованийфільтрзагортаютьупапірістерилізуютьвавтоклаві. Рідинудляфільтруванняналиваютьуметалевийциліндр, з’єднуютьбоковийвідростокколбизвакуумнимнасосом, щобстворитивакуумуколбійприскоритифільтрування. Фільтрат у колбі буде стерильним.
Хімічним способом стерилізують вироби з гумових і полімерних матеріалів. Дляцього використовують6 % розчинперекисуводню, вякийзанурюютьвироби на 6 год при 18 °С і на 3 год при 50 °С. Можна застосувати розчин дексона з експозицією 45 хв при 18 °С. Після закінчення стерилізації вироби двічі прополіскуютьустерильнійдистильованій воді, кожногоразу змінюючи її, тапереносять корнцангом у стерильний бікс.
Інструменти для ендоскопії й автоматичні піпетки можна також стерилізувати спиртом.
Газовий метод стерилізації парами формальдегіду, хлороформу, β -пропіо- лактону, окисом етилену, окисом пропілену, метилброміду, озоном використовують для знезараження ендоскопічних інструментів, апаратів для штучного кровообігу, радіоелектронного обладнання, пластмасовихвиробів, кетгутутощо. Ефективною зарекомендувала себе суміш окису етилену і бромистого метилу в співвідношенні 1:1,44. Для проведення стерилізації газом використовують спеціальні щільні камери, які герметично закриваються. Для кожного діючого фактора розроблено свої режими стерилізації. Після завершення процедури газова суміш викачується з камери і замінюється стерильним повітрям. Предметами, які було
56 |
Частина І. Загальна мікробіологія |
простерилізовано вказаним способом, рекомендується користуватись не раніше, ніж через 24 год, для того, щоб видалився весь газ.
Одним із методів стерилізації є застосування різних типів опромінення. У практиці використовуються для цього електрони, гамма-промені, ультрафіоле-
тові промені, радіочастотне опромінення.
Електронні прискорювачі дозволяютьфокусувати електрони у вузький спрямований пучок високої потужності. Цей метод використовують для стерилізації в промислових масштабах хірургічного перев’язочного і шовного матеріалів ще на етапі їх виробництва. Недоліком даного методу стерилізації є низька проникність променів.
До гамма-опромінення чутливі вегетативні та спорові форми різноманітних бактерій, грибів, дріжджів, віруси. Опроміненняпотужністю2,5 Мрадвикористовується для знезараження антибіотиків, вітамінів, стероїдних та інших гормонів, пластмасового одноразового устаткування (чашок Петрі, шприців), хірургічного перев’язочного та шовного матеріалів тощо.
Стерилізацію за допомогою ультрафіолетового опромінення проводять для знешкодження бактерій в повітрі операційних, палат, боксів, мікробіологічних лабораторійтощо. Дляцьоговикористовуютьспеціальнібактерициднілампирізної потужності – БУВ-15, БУВ-30 та ін. Однак слід пам’ятати, що мікроби можуть бути захищені від дії ультрафіолетового опромінення численними органічними речовинами, пиломтаіншимифакторами. Вегетативніформибактерійу3-10 разів більш чутливі до УФО, ніж спори.
Методирадіочастотногоопроміненнянасьогодніпочинаютьінтенсивнорозроблятись, особливо у харчовій промисловості. Складність їх полягає внебезпеці для обслуговуючого персоналу (наприклад, перешкоди систем зв’язку, різна частота опромінення, яка застосовується для знешкодження мікроорганізмів).
Для перевірки ефективності стерилізації, надійності роботи автоклавів застосовують хімічний та біологічний контроль. Відомі хімічні речовини з певною температуроюплавлення: бензонафтол– 110 °С, антипірин– 115 °С, сірка– 119 °С, бензойна кислота – 120-122 °С, манноза і сечовина – 132-133 °С. Саме при таких температурах найчастіше здійснюють стерилізацію. Хімічні речовини вміщують усклянітрубки, додаютьневеликукількістьаніліновогобарвника(сафранін, фуксин або метиленовий синій), запаюють і кладуть між об’єктами, що стерилізуються. Рівномірне забарвлення препарату в колір барвника в трубці свідчить про належну температуру в автоклаві, а отже й надійність стерилізації. Для біологічного контролю стерилізації в автоклав вміщують спеціальні біотести – смужки фільтрувального паперу, марлі тощо, на яких знаходяться спори бактерій з відомою термостійкістю, спори відомої чисельності та ін. (табл. 3).
Вони розкладаються в біксах, які підлягають стерилізації. Після завершення циклу в пробірки з смужками заливають живильне середовище та інкубують при оптимальній температурі. Відсутність проростання спор бактерій свідчить про ефективну стерилізацію.
У таблиці4 наведеноосновніспособистерилізаціїрізнихмедичнихоб’єктів.

Розділ 4. Фізіологія бактерій |
|
|
57 |
|
|
|
|
|
Таблиця 3 |
Спори бактерій, які найчастіше використовують як індикатори |
||||
|
|
|
|
|
Вид мікробів |
|
Метод стерилізації |
Величина D, хв |
|
|
|
|
Окис етилену (600 мг/л) при 54 °С |
3,0 хв |
Bacillus subtilis |
|
і 50 % відносній вологості |
0,8 хв |
|
|
|
|
Сухий жар (170 °С) |
|
Bacillus steatothermophilus |
|
Волога пара (≥ 121 °С) |
1,5 хв |
|
Clostridium sporogenes |
|
Волога пара (≤ 121 °С) |
0,2-0,8 хв |
|
Способи стерилізації медичних об’єктів |
Таблиця 4 |
|||
|
||||
|
|
|
|
|
Спосіб стерилізації |
|
|
Об’єкти стерилізації |
|
Сухий жар |
|
Скляний посуд, олія, інструменти, голки, порошки |
||
Волога пара |
|
Розчини для парентерального введення, інструменти, |
||
|
|
середовища, резинові пробки |
|
|
Фільтрування |
|
Живильні середовища, що не витримують нагрівання, |
||
|
|
із білками, деякими вітамінами, амінокислотами, гази, |
||
|
|
рідини, мазі, олії з низькою в’язкістю |
|
|
Окис етилену |
|
Обладнання для наркозу, катетери, діагностичне |
||
|
|
обладнання, протези, лабораторне устаткування, допоміжні |
||
|
|
хірургічні матеріали, оптичні інструменти, пластмасові |
||
|
|
вироби, пакувальні матеріали |
|
|
Іонізуюче опромінення |
|
Порошки, перев’язочний матеріал, пробірки для забору |
||
|
|
крові, щітки, мазі від опіків, центрифужні стакани, шовний |
||
|
|
матеріал, хірургічний одяг |
|
|
Дезінфекція. Дезінфекція – це сукупність заходів для повного, часткового абоселективногознищенняпотенційнопатогеннихдлялюдинизбудниківнарізних об’єктах довкілля з метою попередження передачі збудника від джерела інфекції до сприйнятливого організму.
Оскільки мікроорганізми мають різну чутливість до дезінфікуючих засобів, виділяютьчотириступенідезінфекції: A, B, C, D. ДезінфекційнізаходиступеняA передбачають знищення аспорогенних форм мікробів, рикетсій, мікоплазм, найпростіших. Заходи ступеня B використовуються для ліквідації грибів, деяких вірусів, бактерій, що мають підвищену стійкість (стафілококи, мікобактерії). Боротьба із збудниками особливо небезпечних інфекцій (чуми, холери, висипного тифу, меліоїдозу, сапу) вимагаєзаходівступеняС. Знищенняспормікроорганізмів і найпростіших – заходів ступеня D.
Заходи дезінфекції, щовикористовуютьсявклініках, мікробіологічних, вірусологічнихтаіншихлабораторіяхдоситьрізноманітні. Їхумовноможнаподілити на 2 групи: фізичні та хімічні.
До першої групи можна віднести спалювання використаного перев’язочного матеріалу, відходів, сміття, пропалювання в полум’ї пальника, дію сухого жару, автоклавування зарізнихрежимів, використання ультразвуку. Ефективними захо-
58 |
Частина І. Загальна мікробіологія |
дами є кип’ятіння предметів особливо з поверхнево активними речовинами, дезінфекція повітря за допомогою ультрафіолетового опромінення. Постійно використовуються такі елементарні заходи, як вологе прибирання, миття, очищення, витріпування ковдр, простирадл тощо. Такі заходи хоча й не знищують мікроорганізмів, однак сприяють суттєвому зниженню їх популяцій на різних об’єктах.
Потужним комплексом дезінфекційних заходів виступають численні хімічні препарати – дезінфектанти. До них пред’являють певні вимоги: 1) протимікробнийефектширокогоспектрадії; 2) високарозчинністьуводі, здатністьутворюватизводоюабоповітрямактивнітастійкісуспензії, емульсії, аерозолі; 3) здатність не втрачати протимікробних властивостей при наявності в середовищі органічних домішок; 4) низькатоксичність; 5) відсутність алергізуючоїдії; 6) відсутність пошкоджуючого ефекту щодо предметів, які ними обробляються; 7) доступність сировини, з якої виготовляються дезінфектанти, її дешевизна тощо.
Існує декілька сотень дезінфікуючих засобів різних груп. Серед них алкоголі, альдегіди, четвертинно-амонієвісполуки. Найширшевикористаннязнайшли хлоромісткі препарати. До них належать 0,2-1,0 % хлорне вапно, яке виготовляють ex tempore з 10 % освітлених розчинів цієї речовини; 0,2-1,0 % розчини хлораміну В або Т; 5 % водні розчини гіпохлориду кальцію; 0,05-0,1 % розчин трихлоізоцианурової кислоти (диконіту); 0,1-0,2 % розчин сульфохлорантину. Окислювачі представлені 1-10 % розчином перекису водню, фенолами та їх похідними – 3-5 % розчинами лізолу, карболової кислоти, фенолу. До групи препаратів із солей важких металів належать мертиолят натрію, сулема. Широке засто- суваннянабули2-3 % розчинформальдегіду, 3-10 % розчинкрезолутаінші. Використовуються в практиці й газоподібні дезінфектанти – 40 % водний розчин формальдегіду, сумішіокисуетиленузвуглекислимгазом(1:10) іокису етилену з бромідметилом (1:1).
Напрактицівиділяютьпоточну тазаключнудезінфекцію. Поточнудезінфекціюпроводятьдлязменшеннямікробноїконтамінаціїувогнищахінфекції. Їйпідлягають ліжка, постільна і натільна білизна, рушники, матраци, подушки, меблі, килими, посуд, інструменти, прилади, щознаходятьсянаповерхнірізнихоб’єктів, повітря, виділення, стічні води тощо.
Зокрема, поверхні столів, вікон, стелі, стіни, меблі дезінфікують протиранням і миттям з допомогою дезінфікуючих розчинів, постільну та іншу білизну перутьуцихрозчинах. Ліжка, матраци, подушкиобробляютьуспеціальнихкамерахтермохімічнимиметодами, м’якімеблі– задопомогоюспеціальнихаерозолів, посуд – зануренням у дезінфікуючі розчини. Обробка виділень і стічних вод проводитьсятермічнимиіхімічнимиметодами. Повітряприміщеньможнадезінфікувати пропусканням через спеціальні антибактеріальні фільтри, як це роблять в палатахгнотобіологічноїізоляції, абоопромінюючийого ультрафіолетовимипроменями. Медичніінструменти, приладиспочаткуочищають, дезінфікують, апотім, у разі потреби, стерилізують відомими способами.
Заключна дезінфекція проводиться з метою знищення збудників інфекційних захворювань у приміщенні, де перебував інфекційний хворий, і предметах, з
Розділ 4. Фізіологія бактерій |
59 |
якимивінбувуконтакті. Такаситуаціяскладаєтьсяпіслявиписуванняйогозінфекційного стаціонару, переводу із соматичного відділення в інфекційне тощо.
Длязабезпеченнядоглядузапроведеннямдезінфікуючихзаходіврозроблену спеціальнусистемуконтрою. Вонавключаєвсебе: а) зовнішнійівнутрішнійконтроль відділами дезінфекції санітарно-епідеміологічних станцій та лабораторій лікувально-профілактичних закладів, який здійснюється візуальним, бактеріологічним, біологічним, хімічнимтаіншимиметодами; б) бактеріологічнийконтроль проводять, виявляючи у вогнищах інфекції індикаторних бактерій: при кишкових захворюваннях– кишковіпалички, прикрапельнихінфекціях, туберкульозі– стафілококи, улікувально-профілактичнихзакладах– умовно-патогеннімікроорган- ізми; контроль здійснюється 1 раз у місяць – один раз у кварталзалежно від рангу лабораторії; в) забір контрольних проб (10-30 штук) проводять не раніше, ніж через 30-45 хвилин після закінчення дезінфекції; площа змивів не повинна бути меншою, ніж 200 см2; г) змиви беруть стерильними ватними тампонами і засівають на живильні середовища з дотриманням всіх правил асептики з метою запобігання контамінації сторонньою флорою; для виділення бактерій групи кишкової палички і золотистих стафілококів користуються спеціальними наборами живильних середовищ і схемами ідентифікації, визначених відповідними інструкціями.
Дезінфікуючі заходи вважаються ефективними, якщо у пробах не визначаютьсябактеріїгрупикишковоїпалички, умовно-патогеннімікроби, золотистістафілококи.
Бактеріологічнедослідження
Бактеріологічнийметоддослідженняєнайважливішимупрактичнійдіяльнос- тібудь-якоїмікробіологічноїлабораторії. Відправильногойоговиконаннязалежить визначенняетіологічногочинника, щовикликавзахворювання, і, відповідно, вибір тактики лікування інфекційного хворого. Важливість цього методу пояснюється тим, що в багатьох випадках лікарі мають справу з мікробними асоціаціями, тоді необхідно встановлювати роль кожного з мікробів у виникненні хвороби.
Томуперед освоєннямосновнихпринципівіметодіввиділеннячистихкультур необхідно оволодіти технікою посівів і пересівів бактерій в рідкі й на щільні живильні середовища.
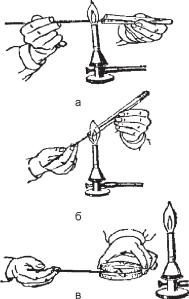
Технікапосівівмікроорганізмів. Посівипроводятьякзметоювиділеннязбудників із досліджуваного матеріалу від хворих, так і для нагромадження чистих культур з метою подальшого їх вивчення та ідентифікації. Техніка посівів у рідкі та на щільні живильні середовища має свої особливості (рис. 19).
У ліву руку беруть дві пробірки. В одній знаходиться живильне середовище (щільне або рідке), в іншій – досліджуваний матеріал. Пробірки затискають великим та вказівним пальцями. Для того, щоб можна було спостерігати за вмістом пробірок, їх тримають зверху кисті руки. Пробірки повинні бути дещо нахиленими, і потрібно стежити, щоб при відкриванні їх матеріал або сторонні мікроби з
60 |
Частина І. Загальна мікробіологія |
|
|
повітря та навколишніх предметів з однієї не по- |
|
|
трапиливіншу. Коркизпробіроквиймають, три- |
|
|
маючиїх4 і5 пальцямиправоїруки. Трьомаінши- |
|
|
ми пальцями правої руки, як олівець, тримають |
|
|
бактеріологічну петлю або піпетку, якими розпо- |
|
|
діляють досліджуваний матеріал. |
|
|
Спочатку стерилізують петлю у верхній |
|
|
частині полум’я газового пальника. Пробірки |
|
|
відкривають і край їх проносять через полум’я |
|
|
пальника. Петлю опускають у пробірку, де є до- |
|
|
сліджуваний матеріал, і, обережно торкаючись |
|
|
стінки, охолоджують. Уподальшомупетлюопус- |
|
|
каютьупробірку інабираютьматеріал. Якщовін |
|
|
знаходиться у рідкому стані, для посіву достат- |
|
|
ньо краплі рідини, яка затримується в кільці бак- |
|
|
теріологічної петлі. Коли використовують мікро- |
|
|
би, щовирослинаповерхнісередовища, обереж- |
|
|
но плавним рухом набирають невелику кількість |
|
Рис. 19. Посіви бактерій на |
їх, стежачи, щоб не ушкодити живильне середо- |
|
середовище: а – бактеріальною |
вище. Петлю повільно виймають з пробірки, не |
|
петлею на скошений агар; |
торкаючисьїїстінок, іпереносятьвіншупробірку |
|
б – уколом в сповпчик агару; |
||
з середовищем. Штриховими рухами від однієї |
||
в – шпателем на агар у чашці Петрі. |
||
|
стінки пробірки до іншої, починаючи з нижньої |
частинисередовища, проводятьпосівматеріалупоскошенійповерхніагарузнизу догори.
Петлювиймають з пробірки, корки і краї пробірок проносятьчерезполум’я і закривають. Петлю прожарюють у полум’ї, щоб знищити мікроорганізми.
При посіві матеріалу на рідке живильне середовище петлю з матеріалом занурюють у рідину. Якщо він не знімається з петлі, його обережно розтирають на стінці пробірки й омивають середовищем.
Матеріал, який набирали пастерівською або градуйованою піпеткою, виливають у живильне середовище, а для рівномірного розповсюдження його пробірку обережно, щобнезамочитикорок, струшуютьабообертають, затиснувшивдолонях.
Для посіву матеріалу на щільне живильне середовище у чашках Петрі невелику кількість матеріалу набирають стерильною петлею і втирають у поверхню середовища біля краю чашки. Після цього петлю стерилізують у полум’ї, щоб знищити надлишок матеріалу, охолоджують. Наступний етап посіву починають з місця, де закінчився попередній. Петлю кладуть горизонтально на поверхню агару, дебулозробленопосів, проводятьодин-дваразипоповерхнііроблятьпосівпо решті середовища. Необхідно намагатись, щоб штрихи посіву тривали від краю докраючашки, непошкоджувалиповерхніагаруірозташовувались близькоодин до одного. Цим штучно подовжується лінія посіву і створюються можливості для одержання ізольованих колоній.
