
Практична мікробіологія - Климнюк С. І. - 2004
.pdfРозділ 10. Імунопрофілактика та імунотерапія інфекційних захворювань |
171 |
стовується також при введенні специфічної плазми (антистафілококової, антисинєгнійної, антипротейної), а також за життєвими показниками і гетерологічних сироваткових препаратів.
Нашкірний (скарифікаційний) метод застосовують для щеплення деякими живимибактеріальнимивакцинами(бруцельозна, Ку-лихоманки, сибіркова, туляремійна, чумна). На шкіру внутрішньоїповерхніпередпліччя наносять необхідну кількість крапель вакцини і через них скарифікатором роблять неглибокі надрізи. Кількість крапель, число надрізів, їх довжина і відстань один від одного визначаються інструкцією по застосуванню конкретного препарату.
Пероральнийспосібвакцинаціївикористовуютьприщепленніпротиполіомієліту, чуми, холери. Ці препарати слід вживати натщесерце.
Гібридоми і моноклональні антитіла. Гібридоми – клітини, одержані в результатізлиттялімфоцитіввідімунізованоїпевнимантигеноммишізгістогенетично близькою пухлиною (мієломою). Ці клітини здатні нескінченно ділитись і продукувати специфічні антитіла. Антитіла, що синтезуються одним клоном гібридних клітин, одержали назву моноклональних. Вперше здійснили цей процес Г. Келлер і Ц. Мільштейн у 1975 році. До моменту одержання гібридом в імунології не було препаратів специфічних антитіл такої чистоти.
Гібридоми– нетільки «фабрики» антитіл іn vitro, вони– новийштучно створений об’єкт, на якому стало можливим проводити різноманітні дослідницькі роботи, що недавно вважались фантастикою. Клонова гібридома – це самовідтворююче джерело генетично ідентичного матеріалу, яке дозволило виділяти й клонувати гени антигенспецифічних антитіл.
Етапи одержання гібридоми. 1. Імунізація мишей антигеном, проти якого потрібніантитіла. 2. Виділенняклітинселезінкиімунізованихтварин. 3. Одержання клітин мієломи у мишей, уражених цією пухлиною. 4. Злиття клітин селезінки з клітинамимієломи. 5. Тестуваннянеобхіднихклітиніїхклонування. 6. Культивування гібридом в організмі тварин або в культуральних середовищах. 7. Очистка гібридомних антитіл.
Моноклональні антитіла, які виробляються гібридомами, набули широкого застосування в біології й медицині. Вони використовуються для ідентифікації і очистки молекул і клітин, які несуть специфічний антиген, для імуноаналізу біологічних рідин і клітин організму, для лікування і дослідження етіології й патогенезу різних захворювань.
Частина ІІІ
СПЕЦІАЛЬНА МІКРОБІОЛОГІЯ
Розділ 11
МІКРОБІОЛОГІЧНАДІАГНОСТИКА ОКРЕМИХІНФЕКЦІЙНИХЗАХВОРЮВАНЬ
Стафілококовіінфекції
PідStaphylococcus охоплює кулясті нерухомі аспорогенні грампозитивні фа- культативно-анаеробнібактерії, щоналежатьдородиниMicrococcacеae. УвизначникубактерійД.Бергінаведенідиференціальніознаки29 видівстафілококів. Вони поділяються на дві групи – коагулазопозитивні й коагулазонегативні. До першої групи належать S. aureus, S. intermedius i S. hyicus. Їх роль в інфекційній патології нерівнозначна. Найчастіше різноманітнізахворювання у людейітваринвикликає S.aureus, значно рідше – S. hyicus. S. intermedius патогенний тільки для тварин. Впродовж багатьох років коагулазонегативні стафілококи вважали непатогенними. Але тепер ця точказору змінилася. У зв’язку з погіршенням екологічної ситуації в більшості країн та пов’язаним з нею пониженням природного імунітету почастішали випадки гнійно-септичних уражень тканин і органів, викликаних коагулазонегативними видами, які зустрічаються на шкірі та слизових оболонках людини (S. epidermidis, S.auricularis, S.capitis, S.cohnii, S.haemolyticus, S.hominis, S.lentus, S.saprophyticus, S.schleiferi, S.simulans, S.warneri, S.xylosus та ін.).
Середепідеміологів, мікробіологівіклініцистівдоситьпоширенепереконання, щосьогоднінепатогеннихстафілококівнеіснує. Всечастішаютьвипадкивиділеннязкрові, тканиніорганівкультурстафілококівбезбудь-якихмаркерівпатоген- ності. Однак, при елімінації їх з організму зникають всі симптоми захворювання. Все це необхідно враховувати при проведенні лабораторної діагностики стафілококовихінфекцій. Нажаль, урутиннихбактеріологічнихлабораторіяхнашоїкраїни поки що можлива ідентифікація лише S.aureus, S.epidermidis i S.saprophyticus.
Стафілококинайчастішеуражаютьшкіру, їїпридаткитапідшкірнуклітковину. Вонивикликаютьфурункули, карбункули, панариції, пароніхії, абсцеси, флегмони, мастити, лімфаденіти, нагноєння ран, в тому числі й операційних. У дітей стафілококи є збудниками стафілодермій, епідемічних пухирчаток, імпетиго. Їх виділяютьприплевритах, бронхітах, пневмоніях, перитонітах. Вониможутьспричинити ангіни, тонзиліти, гайморити, отити, кон’юнктивіти, дещо рідше – менінгіти, абсцеси мозку, міокардити, ендокардити, артрити, інфекції судинних про-
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
173 |
тезів. Дуже небезпечні харчові токсикоінфекції, ентероколіти, холецистити, цистити, пієліти, пієлонефрити. При проникненні в кров або кістковий мозок викликаютьсепсис, остеомієліт, синдромтоксичногошоку. Протевсізахворюваннястафілококової етіології не розглядаються як гострозаразні.
Взяття матеріалу для дослідження. При стафілококових інфекціях досліджують гній, кров (при сепсисі), виділення слизових оболонок, харкотиння, запальнийексудат, ліквор, рановийвміст, плевральнийвипіт, жовч, сечу. Вразіпідозри на токсикоінфекцію – блювотні маси, промивні води шлунка, випорожнення, залишки їжі (особливо сир, молоко, тістечка, торти, креми, морозиво та ін.). При санітарно-бактеріологічних контролях досліджують змиви з рук, столів та інших предметів. У бактеріоносіїв матеріал забирають тампоном окремо з глотки та носових ходів.
Із відкритих гнійних уражень матеріал беруть стерильним ватним тампоном після видалення ранового нальоту, в якому може бути сапрофітна мікрофлора з повітря, шкіри тощо. При закритих гнояках роблять пункцію шприцом. Слиз із рото- й носоглотки беруть стерильним тампоном. Харкотиння й сечу забирають у стерильні пробірки, банки. Кров (10 мл), взяту із ліктьової вени, й ліквор – при пункції спинномозкового каналу, з дотриманням асептики сіють біля ліжка хворого в 100 мл цукрового бульйону. Кров рекомендують швидко (до її згортання) вноситипрямоізшприцауфлаконзбульйоном, ретельноперемішати, запобігаючи утворенню згустка. Проби крові не можна заморожувати. У 25 % випадків при стафілококовому сепсисі кількість бактерій в крові (КУО) може бути менше 1/мл. При підозрі на такий стан необхідно сіяти 25-30 мл крові.
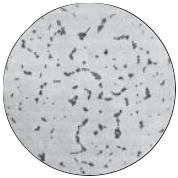
Бактеріоскопічне дослідження. Майже з усіх досліджуваних матеріалів (гній, рановий вміст, ексудат, харкотиння, осад сечі тощо) за допомогою бактеріологічноїпетлівиготовляютьмазки, забарвлюютьзаГрамомімікроскопують. Лише з крові та змивів мазки не роблять оскільки в них мала кількість мікроорганізмів. У типових випадках стафілококи мають кулясту форму, фіолетовий колір, розташовуються несиметричними гронами, але зустрічаються й одинокі клітини, пари або тетради (рис. 60).
Останнім часом у зв’язку з широким використаннямантибіотиківморфологіястафілококівзмінилась і типового їх розташування в мазках із гною часто не спостерігають. У зв’язку з цим відрізнити стафілококи від стрептококів за їх морфологією та взаємним розташуванням часто практично неможливо. Тому потрібно робити посів, виділяти чисту культуру та ідентифікувати її.
Але й первинна мікроскопія може дати попередню відповідь в разі виявлення типових грампозитивнихкоківправильноїкруглоїформи, розташованих гронами і при великій кількості бактерій у полі зору. Вона також дає змогу вибрати необхідні
174 |
Частина ІІІ. Спеціальна мікробіологія |
дляпосівуелективнісередовища, провестипрямевизначеннячутливостідоантибіотиків мікрофлори гною ще до виділення чистої культури (див. вкл., рис. 9).
Бактеріологічнедослідження.Матеріалвідхворихібактеріоносіївзасівають негайно або не пізніше 3-4 год після взяття при умові зберігання його на холоді.
В перший день петлею, шпателем або безпосередньо тампоном роблять посіви на кров’яний агар та елективні для стафілококів середовища (жовтково-со- льовий (ЖСА) або молочно-жовтково-сольовий агар (МЖСА). Чашки з посівами інкубують при 37 °С протягом 48 год, або одну добу в термостаті й додатково 24 годприкімнатнійтемпературі при хорошому освітленні. Якщовдосліджуваному матеріалі бактерій мало (дані мікроскопії) – посів для збагачення роблять ще й у тіогліколеве середовище.
На другий день проводять висів із цукрового бульйону на вказані елективні середовища, досліджуютьмасивністьростуйхарактерколонійпісляпосівівінших матеріалів. На кров’яному агарі стафілококи утворюють непрозорі, злегка опуклі колоніїсередніхрозмірівзгладенькою, блискучою, немовбиполірованоюповерхнею, чітко окресленим краєм, маслянистої консистенції. Патогенні штами утворюють навколо колоній прозорі зони гемолізу (див. вкл., рис. 8). На елективнодиференціальнихсередовищах, якправило, виростаютьлишеколоніїстафілококів. Зокрема, нажовтково-сольовомуагарівониутворюютьколоніїіззоноюпомутніння навколо них і характерним райдужним вінчиком по периферії (лецитовітелазна реакція). Намолочно-жовтково-сольовомуагарівиявляютьнаявністьпігменту, який може бути золотистим, палевим, білим, жовтуватим, оранжевим та ін.
Ізвсіхтипівколонійвиготовляютьмазки, забарвлюютьзаГрамомімікроскопують, виявляючи типові грампозитивні стафілококи. Не менше двох типових чи підозрілих щодо стафілококів колоній пересівають на скошений агар. У першу чергу відсівають колонії з гемолізом і ті, що дали позитивну лецитовітелазну реакцію. При відсутності таких колоній досліджують не менше двох пігментованих колоній, при мікроскопії яких виявили типові стафілококи. Пробірки з посівами вміщують у термостат при 37 °С на 18-20 год.
В наступні дні проводять ідентифікацію виділених чистих культур, для чого перевіряютьїхморфологічнійтинкторіальнівластивості(забарвленнязаГрамом), плазмокоагулюючу активність та інші властиві для стафілококів тести.
Плазмокоагулазувиявляютьшляхомвнесеннявиділеноїкультуриупробірку з цитратною плазмою кролика. Її можна приготувати в будь-якій лабораторії. У кролика із серця беруть 8 мл крові, вносять у пробірку з 2 мл стерильного 5 % лимонно-кислогонатріюіставлятьухолодильник. Післяповногоосіданняформених елементів плазму відсмоктують у стерильну пробірку. Вонаможе зберігатись у холодильнику 8-10 днів. Перед використанням її розводять 1:5 (1 мл плазми і 4 мл ізотонічногорозчину хлориду натрію) ірозливаютьваглютинаційні стерильні пробірки по 0,5 мл. Повну петлю культури стафілококів емульгують у плазмі і вміщують у термостат на 3 год, потім залишають при кімнатній температурі на 18-20 год. Попереднійоблікзгортанняплазмипроводятьчерез3 год, остаточний – на другий день. Дуже зручно користуватись стандартною сухою цитратною плаз-
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
175 |
моюкроля. Передвживаннямвампулудодають1 млізотонічногорозчинухлориду натріюйпісляповногорозчиненняїїрозводять1:5. Плазмалюдинималопридатна дляпостановкиреакціїплазмокоагуляції, оскількивнійможутьбутиконсерванти, лікарськіречовини, антитіла, якіможутьпригнічуватиутворенняплазмокоагулази.
Якщо виділена культура викликає гемоліз, коагулює плазму і дає позитивну лецитовітелазну реакцію, вженатретійденьможнавидатирезультатнанаявність S.aureus. Якщо ж культура має лише плазмокоагулазу або тільки вітелазну активність, для остаточноговстановлення виду стафілококапотрібно визначити додаткові критерії патогенності: ферментацію маніту в анаеробних умовах, ДНКазнуактивність, продукціюлізоциму, фосфатази, атакожвизначитичутливістьдо новобіоцину.
Ферментацію маніту в анаеробних умовах можна визначати, використовуючистандартне сухесередовищезманітом йіндикаторомВР. Післяйоговиготовлення й регенерації впробірки добавляють по1 мл стерильноговазелінового масла і засівають культуру уколом у стовпчик. Посіви інкубують у термостаті протягом 5 діб. При розкладі маніту середовище синіє. Ця проба позитивна у 94-96 %
штамів S.aureus.
Визначення ДНК-ази. До сухогоживильногоагару додають наважку ДНК із розрахунку 2 мг на 1 мл середовища, яке потім стерилізують текучою парою 30 хв. Його можна зберігати в холодильнику протягом 2-х місяців. Перед використанням агар розплавляють, додають хлористий кальцій (0,8 мг на 1 мл). На підсушене середовище в одній чашці можна засіяти смужками до 16-20 культур. Після інкубації посівів протягом 18-20 год їх заливають 5 мл 1N HCl. Через 7-10 хв кислоту зливають і проводять облік. Соляна кислота, реагуючи з ДНК, утворює непрозорий білий преципітат. Якщо культура продукує ДНК-азу, остання деполімеризує ДНК і при додаванні соляної кислоти навколо смужок культур виникає прозора зона, що свідчить про наявність фермента ДНК-ази.
Гіалуронідазнуактивністьвизначають, додаючидо0,5 млбульйонноїкультури стафілокока 0,5 мл препарату гіалуронової кислоти з пупочних канатиків. Суміш інкубують 30 хв при 37 °С і 10 хв при 4 °С. У пробірку додають 4 краплі 15 % оцтовоїкислоти, струшуютьічерез5 хвроблятьоблікрезультатів. Відсутність згусткасвідчитьпронаявністьгіалуронідази, наявністьзгустка– проїївідсутність. Для виготовлення гіалуронової кислоти свіжу пуповину новонароджених подрібнюють, заливають подвійною кількістю дистильованої води. Суміш витримують 24 год у холодильнику, потім нагрівають і кип’ятять до згортання шматочків пуповини. Отриманийгіалуронатфільтруютьчерезватно-марлевийфільтріпере- віряють на утворення згустка.
Лізоцимну активність стафілококів визначають за допомогою посіву виділених культур у вигляді бляшок на щільний живильний агар, до якого додають густу завись культури Micrococcus luteus. При виділенні лізоциму навколо бляшок виникають зони лізису (просвітління агару).
Визначення фосфатази проводять засівом культур на живильний агар, до якого заздалегідь додають паранітрофенілфосфат (0,5 мг на 1 мл середовища).
176 |
Частина ІІІ. Спеціальна мікробіологія |
Інкубація протягом 18-20 год при 37 °С. Поява навколо посівів інтенсивного жовтого забарвлення свідчить про виділення фосфатази.
Стійкість до новобіоцину визначають посівом культури на м’ясо-пептон- ний агар з новобіоцином (1,6 мкг/мл). Золотисті й епідермальні стафілококи чутливі до цього антибіотика, а S.saprophyticus – стійкий.
Реакція Фогес-Проскауера. Виділену чисту культуру сіють у глюкозо-фос- фатний бульйон Кларка. Через три дні інкубації при 37 °С до 1 мл культури додають 0,6 мл альфа-нафтолу та 0,2 мл КОН і струшують. При позитивній реакції через 3-5 хв з’являється рожеве забарвлення.
Біологічне дослідження. Патогенні стафілококи, що викликають харчові токсикоінфекції, виділяють та ідентифікують так само, як і стафілококи взагалі. Вони відрізняються здатністю продукувати ентеротоксини А, В, С1, С2, С3, D, Е, F, які характеризуються термостабільністю та антигенною специфічністю. Найчастіше зустрічаються типи А і D. Вказані токсини отримують шляхом посіву культури в спеціальне напіврідке середовище, інкубують 3-4 доби при 37 °С в ексикаторах з 20 % СО2. Середовище з токсином пропускають через мембранні фільтри№3 і4. Отриманий фільтратпрогріваютьпри100°С30 хвівводятькоше- нятам-сисунам внутрішньоочеревинно або череззонд у шлунок. Через 30-60 хв у тварин виникає блювання, пізніше пронос і загальна прострація. Щоб виявити ентеротоксини у харчових продуктах, що спричинили токсикоінфекцію, ними годують кошенят. Останнім часом ідентифікацію і типування ентеротоксинів проводять за допомогою реакції імунопреципітації в агаровому гелі. Це найпростіший і найчутливіший метод виявлення ентеротоксинів.
Серологічне дослідження при стафілококових інфекціях проводиться лише тоді, колизбудникавиділитиневдається, наприклад, прихронічнихпроцесах(остеомієліт, септикопіємія) особливо якщо вони довго лікуються антибіотиками. Серед сучасних серологічних реакцій найчастіше використовують РНГА та ІФА, зокрема для визначення антитіл до рибіттейхоєвої кислоти або інших видоспецифічних антигенів. Але ідентифікація антитіл до тейхоєвої кислоти вирішального значеннянемає, арезультатичастосуперечливі. Дотогож, реактивидляїхвизначення поки що малодоступні.
Дослідженнянабактеріоносійствосередмедичногоперсоналупроводиться двічінарік. Приплановихбактеріологічнихобстеженняхобов’язководосліджують слизізноса. Дослідження слизуізротоглоткипроводятьвибірково, принаявності запальних процесів у зіві. Матеріал беруть із передніх відділів носа стерильним ватним тампоном і ним же сіють на ЖСА не пізніше, як через 2 год після взяття. Виділення та ідентифікацію S.aureus проводять так само, як і при дослідженні інших матеріалів.
При визначенні масивності обсіменіння стафілококами слизової носа тампоніздосліджуваним слизом вносять у пробірку з 0,5 мл стерильного ізотонічного розчину хлориду натрію, прополіскуютьйого в рідині струшуванням протягом 10 хв, відтискуютьобстінкийвидаляють. Рідинубагаторазовоперемішуютьпіпеткою. Окремопіпеткоюнаносять0,1 млзмивуначашкуізЖСАіретельнорозтира-
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
177 |
ютьшпателем. Чашки зпосівами інкубують при 37 °С протягом 48 год, післячого підраховуютькількістьколоній. Якщоз50 колонійS.aureus, щовиросли, двівіднесені до одного й того ж фаготипу, правомірно вважати, щойвсі інші колонії, ідентичні за морфологією та пігментом, належать до S.aureus аналогічного фаготипу.
Приклад для розрахунку: після посіву 0,1 мл змиву виросло 50 колоній S.aureus. Отже, у 0,5 мл буде 50·5 = 250 колоній або 2,5·102.
Масивністьстафілококовогообсіменіння, якевиражаєтьсячислом102 мікробних клітин, є помірною, при ній збудник в оточуюче середовище не виділяється. При виділенні >103 бактерійних клітин рівень обсіменіння визначають як високий, при якому збудник виділяється у зовнішнє середовище не лише при кашлі та чханні, а й при спокійному диханні. За таких обставин треба обов’язково проводити санацію бактеріоносіїв.
Визначення фаговарів золотистих стафілококів має важливе значення для встановленняджерелаінфекції. Методика фаготипуваннянаводитьсявінструкції для використання стафілококових бактеріофагів. Штами S.aureus, виділені із слизових оболонок дихальних шляхів медперсоналу хірургічних стаціонарів і пологових будинків, треба фаготипувати в обов’язковому порядку, виділені від хворих – лишезаепідпоказаннями. Длявизначенняфаговаріввикористовуютьміжнародний набір із 23 помірних фагів, які розділені на 4 групи:
1група – фаги 29, 52, 52А, 79, 80;
2група – фаги 3А, 3С, 55, 71;
3група – фаги 6, 42Е, 47, 53, 54, 75, 77, 84, 85;
4група – фаги 94, 95, 96;
поза групою – фаги 81, 187.
За допомогою вказаних фагів вдається типувати 60-80 % виділених культур. Встановлені особливі епідемічні штами S.aureus, які найчастіше циркулюють у стаціонарі при внутрішньолікарняних інфекціях (напр. фаготипи 77 і 80). Отримані також набори специфічних бактеріофагів для типування S.epidermidis.
У чистих культур стафілококів, виділених від хворих, обов’язково визначають антибіотикограми з метою застосування адекватних препаратів для лікуванняабоінтраіпередопераційноїантибіотикопрофілактики. Устафілококовихносіїв визначення чутливості культур до антибіотиків проводять лише за показаннями, наприклад, при необхідності вибирати препарат для санації. При цьому використовують дискодифузійний метод або спосіб серійних розведень.
Останнімчасомубактеріологічнихлабораторіяхширокосталивикористовувати СІБ та ПБДС для швидкої та більш економічної уніфікованої ідентифікації бактерій.
Стрептококовіінфекції
Родина Streptococcaceae об’єднує в своєму складі сім родів: Streptococcus, Enterococcus, Aerococcus, Pediococcus, Peptostreptococcus, Lactococcus, Leuconostoc.
Серед них в інфекційній патології людини найбільше значення мають стрептоко-
178 |
Частина ІІІ. Спеціальна мікробіологія |
ки та ентерококи. Загальновизнаною є класифікація стрептококів за Ленсфільд. Наосновіспецифічнихполісахаридівіповерхневихбілковихантигеніввиділяють 20 серологічних груп, які позначаються великими літерами латинського алфавіту від А до V. Патогенні види належать до серогруп А, В, С і D, значно рідше – до груп F i J. Їх визначають за допомогою реакції преципітації з відповідними антисироватками. Однак, із-за відсутності преципітуючих сироваток бактеріологічні лабораторії не мають змоги проводити серологічну ідентифікацію стрептококів. Томувсучасних умовахвикористовуютьіншікритеріїїхдиференціації(табл. 33).
Таблиця 33
Диференціація найважливіших стрептококів і ентерококів
Види
Гноєрідні
стрептококи
1. S.pyogenes
2. S.agalactiaе
3. S.equi
Ротові
стрептококи
4. S.pneumoniаe
5. S.salivarius
6. S.mutans
Анаеробні
стрептококи
7. S.morbillorum
8.S.parvulus
9.S.pleomoрhus
Ентерококи
10. S.faecalis
11.S.faecium
12.S.durans
Група |
Ріст у |
гемоліз-β |
гемоліз-α |
Гідроліз ексуліну |
|
Ферментація |
|
|||
присутностi |
|
|
||||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
|
6,5 % |
40 % |
|
|
|
лак- |
маніт |
салі- |
сор- |
трега- |
|
NaCl |
жовчі |
|
|
|
тоза |
|
цин |
біт |
лоза |
A |
– |
– |
+ |
– |
– |
+ |
– |
+ |
– |
+ |
B |
+ |
+ |
+ |
– |
– |
+ |
– |
+ |
– |
+ |
C |
– |
– |
+ |
– |
– |
– |
– |
+ |
– |
– |
– |
– |
– |
– |
+ |
+ |
+ |
– |
– |
– |
+ |
K |
– |
+ |
– |
+ |
+ |
+ |
– |
+ |
– |
+ |
– |
– |
+ |
– |
– |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
– |
– |
+ |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
+ |
+ |
– |
+ |
– |
+ |
– |
? |
? |
– |
– |
? |
– |
– |
– |
– |
– |
D |
+ |
+ |
+ |
– |
|
+ |
+ |
+ |
+ |
+ |
D |
+ |
+ |
– |
+ |
|
+ |
+ |
+ |
– |
+ |
D |
+ |
+ |
+ |
+ |
|
+ |
– |
+ |
– |
+ |
Основою лабораторної діагностики захворювань, спричинених стрептококами, є бактеріологічні та серологічні методи.
Взяттяматеріалудлядослідження.Присепсисі, остеомієлітітаіншихвидах генералізованоїстрептококовоїінфекціїберутькров. Приіншихзахворюванняхзабирають гній, виділення слизових оболонок, харкотиння, ліквор, жовч, сечу, випорожнення тощо, залежно від локалізації патологічного процесу. Правила взяття й доставки матеріалу до лабораторії такі ж самі, що й при стафілококових інфекціях.
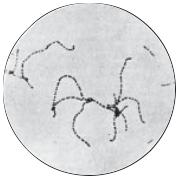
Первиннамікроскопіямазківізгною, рановоговмісту, секретуслизовоїтощо (окрім крові) проводиться після забарвлення їх за Грамом. Стрептококи мають фіолетовий колір, виглядають короткими ланцюжками, диплококами чи поодинці
(рис. 61; див. вкл., рис. 10).
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
179 |
|
Частозахарактеромрозташуванняклітинумаз- |
|
|
ку важко або й взагалі неможливо визначити належ- |
|
|
ність бактерій до стрептококів. Тому необхідно вид- |
|
|
іляти чисту культуру і встановлювати вид збудника. |
|
|
Бактеріологічне дослідження. Для встанов- |
|
|
лення діагнозу при гострих стрептококових інфек- |
|
|
ціях (за винятком скарлатини з типовою клінічною |
|
|
картиною) потрібнопроводитибактеріологічнедос- |
|
|
лідження. При підозрі на сепсис сіють біля ліжка |
|
|
хворого 10-15 мл крові у флакон, що містить 100- |
|
|
150 млцукровогобульйону(співвідношеннякровіі |
|
|
середовища1:10). Кращійнадійнішірезультатида- |
Рис. 61. Стрептококи |
|
ють посіви крові в середовище Кітта-Тароцці з на- |
(мазок із бульйонної культури). |
|
піврідкимагаром. Уньомубудутьростийанаеробні стрептококи. Посіви крові інкубують у термостаті при 37 °С. При рості стрепто-
коківнаднісередовищаз’являєтьсяосад. УсередовищіКітта-Тароцціможе утворюватисяйгаз. Умазкахізосаду виявляютьгрампозитивністрептококиувигляді довгихланцюжків. Пневмококирозташовуютьсякороткимиланцюжкамиабопарноувигляділанцетоподібнихклітин, повернутиходнадоодноїпотовщенимикінцями. Дляентерококіввластивепарнерозташування, рідшететрадамиабокупками, але не гронами. Окремі клітини ентерококів поліморфні (великі й малі).
При відсутності росту посіви витримують у термостаті протягом 3-4 тижнів, періодично проводячи бактеріоскопію.
Культуру, що виросла, після бактеріоскопії пересівають у чашку з кров’яним агаром для визначення типу гемолізу. Через 18-20 год виростають типові колонії, оточені світлоюзоною (бета-гемоліз) абозоноюпозеленіння(альфа-гемоліз). Хоч здатністьдогемолізунемаєабсолютногодіагностичногозначення, всежпридослідженні стрептококів, виділених від людини, можна відкидати негемолітичні колонії гамма-стрептококів. За дуже рідким винятком вони не пов’язані з інфекційними захворюваннями.
Щоб краще й точніше ідентифікувати виділені гемокультури стрептококів колонії з кров’яного агару рекомендують відсівати на простий МПА, молоко з метиленовим синім, жовчний бульйон (або жовчно-кров’яний агар). Гемолітичні стрептококи серогрупи А не ростуть на простих і жовчних середовищах, не знебарвлюють метиленовий синій у молоці. Ентерококи добре ростуть на агарі з жовчю. Далі різні види стрептококів можна диференціювати за біохімічними властивостями (табл. 33). Але біохімічні ознаки стрептококів не є постійними, що до деякої міри знецінює використання цих тестів.
Гній, рановий вміст, слиз із зіва та носа, зібрані ватними тампонами, а також харкотиння, ліквор, сечу тощо сіють на кров’яний агар. Матеріал наносять на середовищевневеликійкількості, апотім петлеючишпателемрозсіваютьйоголегкими штрихами повсій поверхні. Не рекомендують втирати досліджуваний матеріал в агар.
180 |
Частина ІІІ. Спеціальна мікробіологія |
Для підвищення частоти висівання стрептококів тампони після посіву на кров’янийагарщебіляліжкахворогозанурюютьупробіркузсередовищемКіттаТароцці, до якого додають напіврідкий агар та 2-3 краплі дефібринованої крові кролика. Посів інкубують 3-4 год при 37 °С, а потім висівають на чашки з кров’я- ним агаром, виділяють та ідентифікують за звичайною схемою.
Для швидкої ідентифікації бета-гемолітичних стрептококів серогрупи А використовують експрес-метод за допомогою реакції імунофлуоресценції. Для цього мазок із виділеної культури фіксують у 95 % спирті протягом 15 хв, забарвлюють відповідними люмінесцуючими сироватками ірозглядають під люмінесцентним мікроскопом. Практично всі гемолітичні стрептококи групи А чутливі до бацитрацину і дають позитивний ПІР-тест, тобто гідролізують пірролідоніл-бета- нафтіламід. Ще швидше стрептококи цієї групи визначають у мазках із ротота носоглотки, обробляючиїхсучаснимикомерційнимитест-наборами. ГруповіА-ан- тигени стрептококів екстрагують за допомогою ферментів або інших хімічних реагентів івизначають їхвреакціяхлатекс-аглютинації, коаглютинації або імуноферментним аналізом.
Стрептококи групи В, як правило, нечутливі до дії бацитрацину, розкладають гіппурат і дають позитивний САМР-тест (посилення гемолізу під впливом дисків, що містять стафілококовий бета-гемолізин).
Подальшуідентифікаціюпроводятьсеротипуваннямуреакціяхлатекс-аглю- тинаціїабокоаглютинаціїзкомерційнимиреагентамиабоміченимимоноклональними антитілами. Стрептококи в мазках із вагіни можна швидко ідентифікувати за допомогою таких самих тест-систем, як і для стрептококів групи А.
Для визначення вірулентності виділених культур стрептококів використовують біопробу на білих мишах або встановлюють концентрацію поверхневого М-протеїну, властивого лише для патогенних штамів. Для цього отримують солянокислі екстрактизмолодихкультурстрептококівівизначають унихвмістМ-ан- тигену.
При визначенні альфа- і бета-гемолітичних стрептококів у повітрі операційних, пологовихзалів, кімнатдляновонароджених, маніпуляційнихтаіншихлікарняних приміщень роблять посіви повітря седиментаційним методом або за допомогою апаратаКротова на середовище Гарро(дорозтопленогоМПАдодають5 % дефібринованої крові та 0,2 % водного 0,1 % розчину ганціанвіолету). Ентерококи та сапрофітна мікрофлора на цьому середовищі не ростуть.
Серологічне дослідження. При хронічних стрептококових інфекціях виділитизбудника, якправило, невдається, особливопритриваломулікуванніхворих антибіотиками та іншими протимікробними препаратами. В такому разі проводять серологічні дослідження: визначення стрептококового антигена в сироватці крові та сечі, титрування антитіл до О-стрептолізину, гіалуронідази і ДНК-ази.
Антиген стрептококів визначають в РЗК. Необхідні для цього антистрептококові сироватки отримують шляхом гіперімунізації кроликів вбитою культурою бета-гемолітичних стрептококів серогрупи А. Титром антигену вважають те найбільше розведення сироватки, яке затримує гемоліз. Кращі результатиотримують
