
Практична мікробіологія - Климнюк С. І. - 2004
.pdfРозділ 6. Експериментальна інфекція |
101 |
2.Виділення та ідентифікації чистої культури, визначення її токсигенності чи токсичності.
3.Визначеннявірулентностімікроорганізмів, встановленнямінімальнихсмертельних доз мікробів, екзотоксинів та ендотоксинів.
4.При наукових дослідженнях з проблем механізму розвитку інфекційних хвороб, формування імунітету, специфічного лікування і профілактики.
5.При контролі імуногенності, токсичності, стерильності, нешкідливості,
пірогенності біологічних медичних препаратів (вакцин, анатоксинів, ліків тощо). 6. Для отримання діагностичних імунних сироваток.
Дуже важливим етапом є вибір відповідних тварин для експериментального зараження. Найчастіше в лабораторній практиці використовують білих мишей, гвінейських свинок, білих щурів і кроликів. Деякі спеціальні лабораторні дослідженняпроводятьнамавпах, собаках, котах, хом’яках, ховрахах, тхорах, бавовнянихщурах, мишах-полівках, атакожнаптахах(голуби, кури, папугитаін.). Вибір виду тварин оснований на знанні чутливості їх до тих чи інших мікроорганізмів.
Білі миші високочутливі до пневмококів, клебсієл, деяких видів сальмонел, збудниківсибірки, чуми, туляремії, лістеріозу, меліоїдозу, правця, ботулізму, газової анаеробної інфекції, коклюшу, орнітозу, висипного тифу, сказу, лейшманіозу, токсоплазмозу. Новонародженімишічутливідоарбовірусів, поліовірусів, коксаківірусів. На білих мишах визначають силу екзо- і ендотоксинів.
Гвінейські свинки чутливі до збудників туберкульозу (M.hominis), псевдотуберкульозу, дифтерії, чуми, туляремії, бруцельозу, сапу, холери, сибірки, лептоспірозу, меліоїдозу, лістеріозу, орнітозу, ботулізму, правця, газовоїгангрени, кашлюка, висипного тифу, ящуру.
Білих щуріввикористовують для експериментального відтворення сказу, содоку, амебіазу, меліоїдозу, токсоплазмозу, туберкульозу (M.bovis).
Кроликичутливідостафілококів, стрептококів, деякихвидівсальмонел, збудниківтуберкульозу, сибірки, пастерельозу, лістеріозу, ботулізму, правця, сифілісу, амебіазу, токсоплазмозу, вірусів сказу й простого герпесу.
Мавпизрідка використовують як експериментальну модель при сифілісі, туберкульозі, дизентерії, лістеріозі, меліоїдозі, цереброспінальному менінгіті, черевному тифі, кашлюку, поліомієліті та ін.
Коти чутливі до збудників амебної дизентерії, сапу, кашлюку, стафілококових інфекцій, дії ентеротоксинів (кошенята-сисуни).
Сірійських хом’яків використовують для відтворення бруцельозу, сапу, лейшманіозу, токсоплазмозу, амебіазу, лептоспірозу, рикетсіозів, сказу, геморагічних гарячок.
Птахи (голуби, кури, папуги) чутливі до збудників туберкульозу (M.avium), анаеробної газової інфекції, риносклероми (курчата), ботулінового екзотоксину.
Для отримання високостандартних і легковідтворюючих стабільних результатів, а також в наукових дослідженнях, особливо вірусологічних, у лабораторній практиці використовують генетично стандартизованих лінійних (гомозиготних) тварин. Їхотримуютьуспеціальнихвіваріяхшляхомбагаторазовогоблизькоспорід-
102 |
Частина І. Загальна мікробіологія |
неного схрещування (інбридінга). Уже виведено біля 700 ліній білих мишей, 170 лінійщурів, 16 лінійгвінейськихсвинок, біля70 лінійхом’яків, 7 лінійкурчат таін. Такі тварини і птахи мають чітко запрограмовані біологічні властивості, такі як висока чутливість до певних збудників, здатність до імунологічної відповіді тощо.
У лабораторних тварин можуть виникати спонтанні захворювання бактеріальноїчивірусноїприроди, латентніінфекції. Вонитакож маютьсвоюнормальну мікрофлору. Все це ускладнює виділення чистих культур від заражених тварин і визначення їх етіологічної ролі. Цього недоліку позбавлені безмікробні лабораторні тварини – гнотобіоти, а також тварини, вільні від спеціальних патогенних збудників (СПЗ-тварини). Їх використовують для проведення важливих експериментів з проблем вивчення ролі нормальної мікрофлори в інфекції, імунітеті, утворення вітамінів, ферментів та інших біологічно активних речовин.
Способи зараження експериментальних тварин
Для постановки біологічної проби або відтворення інфекційного захворювання у лабораторних тварин використовують різні методи введення мікроорганізмів, їх токсинів або іншого досліджуваного матеріалу: нашкірний, внутрішньошкірний, підшкірний, внутрішньом’язовий, внутрішньовенний, внутрішньоочеревинний. Матеріал можна ввести в носові ходи, рот, шлунок, пряму кишку, серце, мозок, піхву, яєчко, кон’юнктиву, порожнину суглобів. Спосіб зараження залежить від типу матеріалу, ймовірних збудників чи їх токсинів і виду тварин.
Нашкірний спосіб – втирання матеріалу в депільовану (позбавлену шерсті) або скарифіковану ділянку шкіри. Втирання проводять тупим кінцем скальпеля обережно (краще під прикриттям скляної лійки). Тварину фіксують до повного висиханняматеріалу. Цейспосібвикористовуютьрідко, здебільшогодлявиявленнязбудників, щопроникаютьчерезнеушкодженушкіру(паличкичуми, туляремії, лептоспіри).
Внутрішньошкірнийспосібчастовикористовуютьпривведенніекзотоксинів (стафілококовий, дифтерійний) для виявлення їх дермонекротичної дії, або при постановці алергічних проб. Матеріал вводять в об’ємі 0,1-0,2 мл тонкоюголкою, користуючись туберкуліновим шприцом. Шкіру, позбавлену шерсті, протирають спиртом, розтягують великим і вказівним пальцями, голку вводять під гострим кутомзрізомдоверху, матеріалтребавводитиповільно. Вмісціін’єкціїутворюється характерний пухирець, що нагадує лимонну кірку, але він досить швидко розсмоктується (рис. 30).
Підшкірний спосіб використовується найчастіше. У місці введення після депіляції шкіру обробляють спиртом, захоплюють і підіймають двома пальцями лівої руки і в основу утвореної складки правою рукою вколюють голку шприца. Пройшовши голкою кілька міліметрів, її відхиляють в один чи другий бік, проходять глибше і повільно вводять матеріал, що міститься в шприці (рис. 31). Це робиться для того, щоб введений матеріал не витікав через прокол шкіри назовні. Складку опускають, на голку кладуть вату, змочену спиртом або розчином йоду і

Розділ 6. Експериментальна інфекція |
103 |
Рис. 30. Внутрішньошкірне зараження |
Рис. 31. Підшкірне зараження гвінейської |
гвінейської свинки. |
свинки. |
швидко виймаютьголку. Найбільшзручнемісцедляпідшкірноговведенняматеріалу в мишей і щурів – на спині біля кореня хвоста, а в гвінейських свинок та кроликів – у ділянці спини чи живота. Мишам вводять 0,5-1,0 мл матеріалу, щурам і свинкам – 1,0-1,5 мл, кроликам – не більше 3,0 мл.
Внутрішньом’язове зараження проводять у ділянку тіла з найбільш розвиненим м’язовим шаром. У кроликів, гвінейських свинок, щурів і мишей – це м’я- зи верхньоїтретинизадньої лапи, у курей і голубів– груднийм’яз. Ділянку шкіри в місці ін’єкції обробляють так само, як і при підшкірному введенні. Потім великимівказівнимпальцямилівоїрукизахоплюютьтовстум’язовускладкуівводять голку майже під прямим кутом в глибину м’язів (рис. 32).
Часто цим методом користуються для експериментального відтворення анаеробних клостридіальних інфекцій.
Внутрішньоочеревинне зараження. Спочатку вистригають шерсть на жи-
вотівнижніййоготретині, протираютьспиртомаборозчиномйоду. Для попередження ушкоджень кишечника тварину тримають вниз головою. З цією ж метою використовують короткі голки з притупленим кінцем. У кроликів і гвінейських свинок роблять маленький надріз шкіри (2-3 мм) у нижній третині живота збоку від середньої лінії. Під гострим кутом вводять голку між шкірою і м’язами, потім переводятьїївперпендикулярнеположеннядоочеревини, буравлячимрухомпроколюють її, відчуваючи ніби “провал” у черевну порожнину, і вводять досліджуваний матеріал. На місце розрізу накладають шов або хірургічну скрепку. При зараженні мишей і щурів шерсть не голять і надріз не роблять (рис. 33).
Максимальні дози дослі- |
|
джуваного матеріалу для вве- |
|
дення білим мишам – 1 мл, |
Рис. 32. Внутрішньом’язове зараження. |

104 |
Частина І. Загальна мікробіологія |
Рис. 33. Зараження миші в черевну порожнину: а – фіксація; б – введення.
щурам– 3 мл, гвінейським свинкам– 5 мл і кроликам – 10 мл. Цей метод застосовують для швидкого відтворення інфекційного процесу. Його не слід використовувати, якщо досліджуваний матеріал містить багато сторонніх мікробів (грунт, вміст кишечника тощо), щоб не викликати смертельний перитоніт.
Внутрішньовенний спосіб введення. У різних видів тварин при цьому кори-
стуютьсярізнимивенами: кроликівзаражаютьукрайовувенувуха, мишейіщурів
– увенухвоста, гвінейськихсвинок– увенустегна, попередньонадрізавшишкіру та відсепарувавши її. Для внутрішньовенних ін’єкцій використовують голки з довгим косим зрізом. Найлегше цей спосіб здійснюється на кроликах завдяки поверхневомурозташуваннювушнихвен. Передвведеннямматеріалутваринуфіксують у спеціальному боксі (рис. 34) або обгортають рушником. Впродовж зовнішньогокраю вухавищипуютьшерсть, злегка вдаряють кінчиками пальців, абозмазують ксилолом, щоб вени краще набрякли, протирають 70° спиртом. Помічник великим пальцемлівої рукинатискаєнавену біля основивуха, щобвикликати ще більший застій крові. Голку вколюють у вену в напрямку від периферії до центру, тримаючи її майже паралельно до поверхні вуха (рис. 35).
Спочатку вводять невелику кількість матеріалу, щоб перевірити чи правильно вставлена голка. Якщо вона дійсно знаходиться у вені, рідина вводиться легко. Якщожпривведенніневеликоїкількостіматеріалувиникаєздуттянавколовени– голка в неї не потрапила. Тоді її виймають і знову вводять у вену ближче до основи вуха. Після ін’єкції рідини вену нижче проколу злегка притискають, на місце
Рис. 34. Бокс для фіксації кроля. |
Рис. 35. Внутрішньовенне введення. |

Розділ 6. Експериментальна інфекція |
105 |
уколуприкладаютьвату, змоченуспиртом, голкувиймають. Кровотечаприпиняється досить швидко.
При внутрішньовенному зараженні щурів і мишей користуються тонкими короткими (туберкуліновими) голками з косим зрізом. Перед введенням матеріалухвісттваринизанурюютьутеплуводу(50°С), щобвикликатигіперемію. Корінь хвоста затискають пальцями, голку вколюють в одну з бокових вен у нижній її третині, тримаючи шприц майже паралельно осі хвоста. Голку повертаютьзрізомнаверх. Коливона введена у вену, перестають натискати на корінь хвоста і вводять матеріал. Цей спосіб дуже часто викорис-
товують при визначенні сили ток-
синів (рис. 36). Рис. 36. Введення токсину миші.
Укурейіголубівзручновикористовувативени, якірозташованінавнутрішній поверхні крил. Після вищипування пір’я вони стають чітко видимі.
Ентеральнезараження. Найпростішепровестизараженнячерезротприродним шляхом, добавляючи інфекційний матеріал до корму тварин. Але при цьому доситьважкоточновизначитиінфікуючу дозу. Узв’язкузцимчастішезараження проводять примусово. Мишу чи щура тримають вертикально (рис. 37). Культуру бактерій або інший заразний матеріал вводять за допомогою шприца, голка якого має незначну кривизну й напаяну на кінці оливу. Рот відкривають пінцетом. Кількістьматеріалу, щовводятьушлунокмишей, становить0,5-0,7 мл, длящурів –
2-3 мл.
Кроликам і гвінейським свинкам заразний матеріал вводять через рот спеціальним катетером або гумовою трубкою довжиною 7-8 см і шириною 0,3-0,5 см. Перед введенням трубки в рот вставляють дерев’яну планку з отвором посередині. Через цей отвір обережно вводять у стравохід катетер, змазаний вазеліном. Щобполегшитийогопроходженняпостравоходувроттваринипіпеткоювливають декілька крапель фізіологічного розчину хлориду натрію. Це викликає ковтальні
а |
б |
Рис. 37. Ентеральне зараження миші (а) і кролика (б).
106 |
Частина І. Загальна мікробіологія |
рухи, під час яких трубка легко рухається по стравоходу й потрапляє до шлунка. Зовнішній кінець катетера приєднують до шприца, наповненого певною дозою заразного матеріалу. Його повільно вводять безпосередньо у шлунок в об’ємі 2,5-3,5 мл гвінейським свинкам і 3,5-5,0 мл кроликам.
Інтраназальне зараження. Існує декілька способів зараження тварин через дихальнішляхи, приякихматеріал вводятьабозадопомогоюінгаляції, абоспеціальними зондами безпосередньо в трахею чи бронхи. Однак їх використовують рідко. Найпростішим способом, який можна відтворити в будь-якій баклабораторії, є закапування заразного матеріалу або культури бактерій в носові ходи тварин під легким ефірним наркозом. За допомогою шприца матеріал вводять краплями в носові ходи мишей на глибину 1,0-1,5 мм, білих щурів– 2-3 мм, кроликів і гвінейських свинок – 3,5-4,0 мм. Щоб не пошкодити слизову оболонку, використовують абсолютно тупі голки. За допомогою цього методу можна заражати мишей збудником кашлюку, міксовірусами, гвінейських свинок – рикетсіями та ін. Максимальнийоб’ємматеріалу, щовводиться, становитьдлямишей0,03-0,05 мл, для щурів – 0,05-0,1 мл, для кроликів і гвінейських свинок– до 2 мл.
Інтрацеребральне зараження. Кроликам і гвінейським свинкам роблять трепанацію черепа й заразний матеріал вводять через трепанаційний отвір безпосередньо в мозок або під тверду мозкову оболонку (субдурально). Шкіру в місці трепанації вистригають від шерсті, протирають спиртовим розчином йоду. Потім її зміщують вбік і роблять розріз довжиною 1-3 см, паралельно осі черепа трохи вище задньої орбітальної лінії. Спеціальним інструментом – трепаном – роблять у кістці круглий отвір, через який вставляють голку і легким повільним натиском на поршень шприца вводять 2-3 краплі матеріалу. Отвір у кістці закривають, змістивши на місце шкіру, на яку накладають шви.
Зараження щурів і мишей проводять без трепанації за допомогою туберкулінового шприца з тонкою, тупо обрізаною голкою. На останню надівають металеву муфточку, яка обмежує проникнення голки в мозок лише на глибину 1,5-2 мм. Мишу тримають лівою рукою так, щоб великий і вказівний пальці відтягували шкіру голови в напрямку до шиї, а між мізинцем і безім’яним пальцями утримувався хвіст. У місці проколу шкіру обробляють спиртовим розчином йоду, потім повільно вводять матеріал щоб не викликати раптово підвищення внутрішньочерепного тиску. Цей спосіб на мишах-сисунках використовують для діагностики вірусних енцефалітів, геморагічних гарячок, коксакі-інфекції та ін.
При визначенні результатів дослідів тварин, які загинули протягом першої доби, не враховують, оскільки їх загибель виникла від травматичних ушкоджень.
Зараження в передню камеру ока. При цьому способі матеріал вводять на кон’юнктиву або в передню камеру ока. Найкраще цю операцію виконати на кроликах. Попередньо в кон’юнктивний мішок закапують 2 % розчин новокаїну. Тварину фіксують спиною доверху. Через1-2 хвтонкимочним пінцетомзахоплюють складку кон’юнктиви зовні від поверхневого краю рогівки. Потім вводять тонку голку в рогівкубіляїїкраю(лімба) іпросуваютьуцентральномунапрямку дотих пір, покивпросвітіголкинепоявитьсярідиназпередньоїкамериока. Післявито-
Розділ 6. Експериментальна інфекція |
107 |
ку 2-3 крапель рідини на голку насаджують шприц і вводять інфікуючий матеріал в об’ємі не більше 0,05 мл. Голку швидко виймають, маленька ранка сама закривається. Око промивають стерильною водою або 3 % розчином борної кислоти.
З діагностичною метою часто ставлять так звану кератокон’юнктивну пробу на гвінейських свинках. Зцією метою у кон’юнктивний мішок вводятьпетлюагаровоїкультури(абокраплюбульйонної), нетравмуючирогівку. Однібактерії(шигели) викликають кератит, інші (сальмонели) – кон’юнктивіт. Поява виразки на рогівці або її помутніння виникають на 2-5 добу. Пробу використовують для визначення належності культури до роду шигел. Такий спосіб на кролях використовують для відтворення герпетичної інфекції.
Утримання заражених тварин. Після зараження лабораторні тварини називаються “піддослідними”. Їх утримують в ізольованому приміщенні (віварії), окремо від розплідника, де розміщені здорові тварини. Приміщення для піддос- ліднихтваринповиннобутитеплим(10-15 °С) ісухим. Слідпам’ятати, щокроликичутливідовогкості, білімиші– дохолоду, агвінейськісвинкиідовогкості, ідо холоду. Дрібнихтваринпіслязараженнявміщуютьувисокісклянібанки, якізакриваютьметалевими сітками, акроликівісвинок– уклітках. Банкиікліткиповинні мати етикетки з позначенням дати зараження або номер експерименту, під яким він записаний в лабораторному журналі. Тварини повинні регулярно отримувати корм із достатнім вмістом вітамінів, воду або молоко. При спостереженні за ними відмічають в’ялість, відсутність апетиту, понос, які є ранніми симптомами захворювання. Приоглядітваринзмушуютьрухатись, щобнепропуститипаралічі. Щоденне спостереження дає змогу своєчасно відібрати захворілих тварин для розтину і подальших досліджень.
Мікробіологічне дослідження трупа
Розтин і мікробіологічне дослідження загиблих тварин має велике, часом вирішальне діагностичне значення. Воно проводиться з метою виявлення і визначення локалізації збудника інфекційного захворювання. Трупний матеріал досліджують за допомогою бактеріоскопічних (вірусоскопічних) і бактеріологічних методів. Досліджуваний матеріал беруть під час розтину трупа, яке проводять, дотримуючись встановлених правил.
Розтин трупа та його мікробіологічне дослідження потрібно робити якомога скорішепіслясмерті. Доцьогойогонеобхіднозберігатинахолоді, оскількимікрофлоракишечникапринизькійтемпературіповільнішепроникаєвкров, тканиний паренхіматозні органи. Розтин трупа та забір матеріалу необхідно проводити в умовах, які виключають його забруднення сторонніми мікроорганізмами. Взятий матеріалдопосівунеповиненконтактуватиздезінфікуючимиречовинами, апісля посіву – знезаражуватись. Результати досліджень обов’язково протоколюються. Підчасрозтинутрупата дослідженняйогоматеріалівнеобхідноабсолютнопопередити всіляку можливість інфікування як самих працюючих, так і інших осіб, а також контамінації оточуючого середовища.
108 |
Частина І. Загальна мікробіологія |
Тварин, що загинули від експериментальної інфекції, також досліджують з дотриманням правил асептики. При цьому використовують лише стерильні інструменти. Їх переносять із стерилізатора в склянку зі спиртом і ватою на дні, перед кожним використанням обпалюють на вогні.
Загиблу тваринузахоплюютьпінцетом, кладутьспиноюдонизунадерев’яну дощечку, вміщенувметалевуклюветуздезрозчином. Додощечкиїїприкріплюють булавкамиабогостримигвіздочкамизачотирилапки, широкорозтягуючиїї. Шкіру в місці розтину змочують дезінфікуючим розчином, щоб не розліталась шерсть, якаміститьавтохтоннумікрофлору. Трупи тварин, якізагинуливідчумитаінших особливо небезпечних інфекцій, перед розтином занурюють у керосин для інактивації комах – перенощиків хвороби. Перед першим розрізом шкіру ретельно протирають дезрозчином, спиртом або обпалюють полум’ям газового пальника.
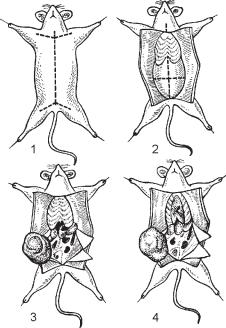
Розтинідослідженнятрупатваринипроводятьупевнійпослідовності: спочаткурозрізаютьідосліджуютьзовнішніпокриви, потімгруднуйчеревнупорожнини.
Розтин зовнішніх покривів починають з розрізу шкіри від нижньої щелепи до лобка, потім роблять бокові надрізи в напрямку до лапок. Шкіру відсепаровуютьівідкидаютьвобидвабоки, відкриваючивсюпереднюповерхнютіла(рис. 38). В підшкірній клітковині відмічають такі зміни як гіперемію судин, крововиливи, набряки, стан лімфатичних вузлів. При їх збільшенні або нагноєнні роблять посіви на живильні середовища та мазки-відбитки, притискаючи поверхню розрізу вузла до предметного скла.
Рис. 38. Послідовні етапи розтину
білої миші.
Перед розтином грудної порожнини її відкриту від шкіри поверхню змочують спиртом і запалюють. Пінцетом захоплюють мечоподібний відросток, роблять поперечний надріз під ним, вставляють ножицііпроводятьдвабоковірозрізивмісцях сполученняреберізгрудноюкісткою. Утворений лоскут відкривають доверху й оглядаютьлегенітасерце, відмічаютьнаявність ексудату. Обов’язково роблять посів крові зсерця. Для цього розжареним скальпелем припікають стінку шлуночка або передсердь і в даній ділянці роблять прокол пастерівською піпеткоюзтонковідтягнутим у полум’ї пальника кінцем. Кров, що потрапила в капіляр, сіють в цукровий бульйон і наагар, аіззалишкуроблятьмазки. Припотребі проводять також посіви та роблять мазки-відбиткизлегень, плевритаексудату.
Розтинідослідженнячеревноїпорожнинипроводятьдужеобережно, щобнепошкодити кишечник. Черевну стінку захоп-
Розділ 6. Експериментальна інфекція |
109 |
люють і трохи підіймають вверх, ножицями розрізають її від діафрагми до лобка
іпо два бокових надрізи в напрямку до лапок. Утворені лоскути відвертають в обидвабоки. Оглядаютьвнутрішніоргани, відмічаючивпротоколівеличину, колір
іконсистенціюпечінки, селезінки, нирок, наднирковихзалоз, лімфатичнихвузлів брижі та наявність ексудату.
Вразі потреби роблять посіви тканин вказаних органів та ексудату. Для цього припікають поверхню органа розжареним скальпелем і в цій ділянці проводять
розріз. Бактеріологічною петлею з поверхні розрізу роблять зскрібок паренхіми і сіють на живильні середовища. Для виготовлення мазків-відбитків вирізають шматочокорганайповерхнеюрозрізу притискаютьдопредметногоскла, аборозмазують по ньому тонким шаром.
Трупи тварин і залишки органів після бактеріологічного дослідження спалюють або стерилізують. Якщо тварини загинули від особливо небезпечних інфекцій, їх розтини й посіви проводять у спеціальних режимних лабораторіях із дотриманням особливо пильних заходів безпеки.
Вирощування посівів, виділення чистих культур та визначення видів збудників проводять за загально прийнятими методами.
Визначення вірулентності мікроорганізмів, смертельної дії екзотоксинів та ендотоксинів
Майже в усіх бактеріологічних лабораторіях в дослідах на тваринах часто визначають патогенні й вірулентні властивості збудників інфекційних захворювань. Патогенність – це потенційна здатність певного виду мікроорганізмів викликатиінфекційнийпроцес. Вонанеєабсолютноюістабільною. Ступіньабоміру патогенності визначають вірулентністю. Для її кількісного визначення запропоновані три умовні одиниці вірулентності.
1.Dosis letalis minima (DLM) – мінімальна смертельна доза, тобто найменша кількість живих мікроорганізмів або найменша доза токсину, яка здатна викликати загибель 95 % тварин стандартної маси і віку через певний проміжок часу. Ця величина відносна й залежить від виду тварин. DLM для мишей, щурів, гвінейських свинок і кроликів буде різною.
2.Dosis certa letalis (DCL) – безумовно смертельна доза, яка викликає заги-
бель 100 % взятих у дослід тварин; вона також є відносною.
3. Dosis letalis50 (DL50) – кількість мікроорганізмів (або токсину), яка викликає загибель 50 % взятих у дослід тварин. Остання величина є статистично найбільш достовірною летальною дозою. Вона визначається на основі обробки конкретних результатів загибелі тваринзаметодом РідаіМенча, уякому реалізуються кумулятивні принципи обліку результатів.
Інколи визначають і мінімальну інфікуючу дозу (ІД50), тобто найменшу кількість мікробів, яка викликає захворювання у 50 % заражених тварин.
Титрування мінімальних смертельних доз, як правило, проводять на білих мишах як найбільш доступних і дешевих тваринах (рідко на гвінейських свинках

110 |
Частина І. Загальна мікробіологія |
і кроликах). Мікроби (токсини) вводять внутрішньоочеревинно або внутрішньовенно. Щоб отримати стабільні результати використовують тварин стандартної маси і віку. Мишей відбирають масою 16-18 г, гвінейських свинок – 200-250 г, кроликів – 1500 г.
Завись бактерій для зараження готують із молодих агарових культур після 18-20 год їх вирощування в термостаті. Для цього в пробірку з культурою на скошеному агарі вносять 5 мл ізотонічного розчину хлориду натрію й ретельно струшують. Частину густого змиву переносять в іншу пробірку такого ж діаметру як і пробірка зі стандартом мутності. Завись розводять 0,85 % розчином хлориду натрію до мутності, яка відповідає вибраному стандартові.
Централізованим шляхом готують такі еталонні стандарти мутності: № 5 – на п’ять одиниць мутності, що відповідає 500 млн мікробів у 1 мл; № 9 – 900 млн мікробів у 1 мл; № 10 – 1 млрд мікробів у 1 мл; № 11 – 1,1 млрд мікробів у 1 мл. Виготовляютьтакожстандартимутностідлякоклюшнихбактерійна9, 10 і11 млрд мікробів у 1 мл.
При визначенні вірулентності мікроорганізмів, як правило, виготовляють вихідну завись, в якій знаходиться 1 млрд бактерій в 1 мл. Тоді длявведення миші 100 млн мікробів беруть 0,1 мл зависі, для введення 200 млн – 0,2 мл і т.д. Стандартизовані зависі готують так, щоб бажані дози бактерій містились в однакових об’ємах, а загальної кількості їх повинно вистачити на всюгрупу тварин(наприклад, по 0,2 мл на 4-6 тварин).
Через 24-48 год після зараження відмічають кількість тварин, що загинули в кожній групі і вираховують DL50 за методом Ріда і Менча.
Наприклад, із наведених в таблиці даних видно, що DL50 знаходиться між розведеннями зависі мікробів 10-5 і 10-6. Для точного підрахунку DL50 визначають величину х, яку додають до логарифму того розведення, яке менше 50 % дози (у наведеному прикладі 5) за формулою:
X = A − 50 , A − B
де А – % тварин, які загинули від розведення менше 50 % (у даному випадку 66,7 %); В – % тварин, що загинули від розведення більше 50 % дози (за даними таблиці – 33,3 %). Підставивши у формулу отримані числові значення, одержимо
|
X = |
66,7 − 50 |
|
= 0,5 . |
|
|
|
|
|
66,7 − 33,3 |
|
|
|
||||
|
|
|
|
|
|
|||
|
Обчислення DL50 за методом Ріда і Менча |
Таблиця 11 |
||||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
Розведення |
Кількість |
|
|
|
З них |
|
% тварин, |
|
зависі мікробів |
зараженихтварин |
загинуло |
|
вижило |
що загинули |
|||
10-4 |
6 |
|
6 |
|
|
0 |
100 |
|
10-5 |
6 |
|
4 |
|
|
2 |
66,7 |
|
10-6 |
6 |
|
2 |
|
|
4 |
33,3 |
|
10-7 |
6 |
|
0 |
|
|
6 |
0 |
|
|
|
|
|
|
|
|
|
|
