
Практична мікробіологія - Климнюк С. І. - 2004
.pdfРозділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
311 |
Вже розроблено й впроваджено в практику багато діагностичних тест-сис- тем для ІФА. Досліджуваний матеріал вносять на адсорбовані в лунках планшети антитіла. Оцінкарезультатівпроводитьсязадопомогою імуноферментногоаналізатора згідно з інструкцією до кожної тест-системи. Чутливість ІФА для виявлення хламідій коливається в межах 50-70 % у чоловіків і 88-100 % у жінок.
Виділення хламідій в культурах клітин. Найбільш точним і доказовим ме-
тодом діагностики хламідіозу є виділення збудника на культурі клітин (золотий стандарт). Найчастіше використовують культури клітин L-929, McСoy, Hela, BHK-21. У стерильні плоскодонні пробірки діаметром 14 мм вносять на дно покрівні скельця, додають по 1 мл клітинної суспензії в живильному середовищі (1·105 клітин/мл) і ставлять на 24-48 год у термостат при 37 °С для утворення моношару клітин на покрівних скельцях. Потім середовище виливають, вносять інфекційний матеріал, оброблений антибіотиками, центрифугований протягом години при 3000 об/хв, інкубують у термостаті 2 год при 37 °С. Досліджуваний матеріал виливають, замінюють його свіжим живильним середовищем, інкубу- ютьутермостаті48-72 год. Покрівніскельцязмоношаромклітинвиймають, фіксують 10 хв метанолом, промивають фосфатнимбуфером і забарвлюють заметодом Романовського-Гімзи. Покрівні скельця монтують на предметному склі моношаром клітин донизу в канадському бальзамі.
Підімерсійнимоб’єктивомвиявляютьнаявністьцитоплазматичнихвключень. Елементарні тільця хламідій забарвлюються у червоний, а ретикулярні тільця – у синій колір.
При обробці препаратів флуоресцентними антитілами моношар клітин також монтують на предметному склі в гліцерині й досліджують за допомогою люмінесцентного мікроскопа. Метод високоспецифічний (100 %) і чутливий (75 %), але доситьскладний, дорогий, результатотримуютьчерез72-96 год. Окрімтого, євеликийризикзараженняперсоналу. Дляпрактичнихлабораторійвінщемалодоступний.
Імунологічна діагностика. У сучасній практиці серологічних досліджень сечостатевих хламідіозів використовують 4 імунологічні реакції: непрямої імунофлуоресценції, непрямої гемаглютинації, зв’язування комплементу та метод імуноферментного аналізу. Матеріалом для дослідження в усіх 4-ох реакціях є сироватка крові хворих, секрети статевих залоз.
З метою виявлення хламідійних антитіл у реакції непрямої імунофлуоресценції застосовують специфічний хламідійний антиген, який забезпечує реакції з антитілами до всіх варіантів C. trachomatis.
При постановці цієї реакції на предметному склі готують слайд-антигени. Скловміщуютьнатрафаретіззазначеннямзоннанесенняантигенів(контрольного і специфічного). Слайди висушують 15-20 хв і фіксують в охолодженому ацетоні. Потім на слайд-антигени наносять відповідні розведення сироватки, інкубують 40 хв при 37 °С у вологій камері. Після цього препарат тричі промивають фосфатним буферним розчином, додають антивидову люмінуючу сироватку, ще раз витримують 40 хв у вологій камері й знову тричі промивають. Висушені слайди досліджують під люмінесцентним мікроскопом. Техніку постановки ре-
312 |
Частина ІІІ. Спеціальна мікробіологія |
акціївиконуютьзгіднозінструкцією, щододаєтьсядокожноїдіагностичноїтестсистеми.
Оцінку результатів проводять за ступенем специфічної флуоресценції комплексів елементарних і ретикулярних тілець з антитілами, використовуючи класичну чотириплюсову систему. Титром хламідійних антитіл сироватки хворого вважають те найбільше її розведення, при якому спостерігається чітке яскравозелене світіння не менше, ніж на 2+. При хламідійному ураженні сечостатевої системи він дорівнює 1:64 і вище. Постановка РІФ методом парних сироваток повинна виявити наростання титру антитіл у 4 рази від початкового рівня.
Рекціюнепрямоїгемаглютинаціївикористовують, восновному, длядіагностикизоонозниххламідіозівіпервинногосерологічногоскринінгузахворюваньулюдей.
Реакція зв’язування комплементу дає змогу виявити антитіла до родоспецифічного антигену хламідій. Ставлять її за звичайною схемою. Діагноз вважають позитивнимпрититрікомплементзв’язуючихантитіл1:64 івище. РЗКмалопідходить для діагностики хламідійних інфекцій генітальної системи.
Виявлення хламідійних антитіл імуноферментним методом базується на взаємодії антигену з хламідій на поверхні лунок полістирилових планшет з IgM і IgG у сироваткаххворихлюдей. Ужевиготовленавеликакількістьдіагностичнихнаборів.
Спочатку сироватку хворого розводять у допоміжному ряді пробірок, потім проводять сорбцію антитіл у лунках мікротитрувального планшета. Детальна методика постановки ІФА викладена в інструкції, що додається до діагностичної тест-системи. ІФА рекомендують ставити за допомогою парних сироваток. Оцінку результатів здійснюють за допомогою імуноферментного аналізатора за величиною оптичної щільності розчинів у лунках полістирилового планшета.
Мікоплазмози
Мікоплазмози– інфекційнізахворюваннялюдини, яківикликаютьрізнівиди мікоплазм, представники родів Mycoplasma і Ureaplasma з родини Mycoplasmataceae. Розрізняютьреспіраторниймікоплазмоз(пневмонія, фарингіт, трахеобронхіт, бронхіт), урогенітальний мікоплазмоз (уретрит, цистит, простатит, пієлонефрит; у жінок – вагініт, кольпіт, цервіцит, ендометрит) і ураження суглобів (артрит). Більшість мікоплазмозів мають глобальне розповсюдження й переважно хронічнийперебіг. Уокремихвипадкахмікоплазмипричетнідовиникненняендокардитів, патології вагітності й ураження плода.
Респіраторний мікоплазмоз найчастіше викликає Mycoplasma pneumoniaе,
значно рідше M. hominis. Матеріалом для виділення збудника служить харкотиння, слиз із носоглотки, плевральний ексудат, біоптати легеневої тканини, лаваж (змиви з поверхні бронхіол і альвеол, отримані при бронхоскопії); для серологічної діагностики беруть кров.
Досліджуваний матеріал можна зберігатипритемпературі 4 °С у середовищі нагромадження (триптиказний соєвий бульйон з бичачою сироваткою). Посіви роблять на щільні середовища (наприклад, серцево-мозковий агар), що містять

Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
313 |
всікомпоненти, необхіднідляростумікоплазм, танадвофазнесередовище(короткий стовпчик селективного агару з налитим поверх нього сироватко-глюкозним бульйоном). Виділити збудника найчастіше вдається саме на двофазному середовищі. Для пригнічення росту супутньої мікрофлори до середовищ попередньо добавляють пеніцилін і ацетат талію, до яких мікоплазми пневмонії стійкі.
Ознаки росту (ферментація глюкози і зміна кольору рідкої частини двофазного середовища та ріст дуже дрібних колоній на щільному агарі) появляються у строки від одного до семи тижнів. Колонії мікоплазм діаметром 0,1-0,2 мм мають щільний зернистий центр, який вростає в агар, та розпливчасту прозору периферичну зону (у вигляді “випускної яєшні”) (див. вкл., рис. 26).
Довготривалість росту мікоплазм на щільних середовищах обумовила розробку швидкого методу їх ідентифікації на чашках без додаткових пересівів для виділеннячистихкультур. Найпоширенішимметодомідентифікаціїколонійєтест епіфлуоресценції. Він полягає в тім, що на поверхню колонії наносять люмінуючі мікоплазменніантитілайвиявляютьспецифічнеїхсвітінняпримікроскопіївультрафіолетових променях.
Розроблено також метод вирощування мікоплазм пневмонії в органній культурі трахеї курчат, який дає позитивні результати вже через 3-5 днів.
Остаточну ідентифікацію культур проводять на основі морфологічних, культуральних властивостей та деяких інших ознак (табл. 67).
|
|
|
|
|
|
Таблиця 67 |
Диференціальні ознаки патогенних для людини мікоплазм |
||||||
|
|
|
|
|
|
|
Вид |
Виділення ферментів |
Ферментація |
Відношення |
|||
уреази |
аргінази |
фосфа- |
глюкози |
манози |
до еритро- |
|
|
|
|
тази |
|
|
міцину |
M. pneumoniaе |
- |
- |
- |
+ |
+ |
чутливі |
M. hominis |
- |
+ |
- |
- |
- |
стійкі |
M. arthritidis |
- |
+ |
+ |
- |
- |
? |
M. fermentans |
- |
+ |
- |
+ |
- |
стійкі |
U. urealyticum |
+ |
- |
+ |
- |
- |
чутливі |
|
|
|
|
|
|
|
Значношвидшеможнавиявитимікоплазмипневмоніїабоїхантигенивдосліджуваному матеріалі за допомогою реакцій імунофлуоресценції, непрямої гемаглютинації, агрегат-аглютинаціїтаІФА. Однак, широкеїхвикористанняобмежене відсутністю або недостатньою кількістю відповідних діагностичних тест-систем.
Дуже ефективним методом діагностики респіраторного мікоплазмозу є методгібридизації ДНКзадопомогоюспеціальнихзондів, якієприроднимиплазмідами мікоплазм або штучно синтезованими олігонуклеотидами.
Однимізперспективнихінайчутливішихметодівдіагностикимікоплазмозів єполімеразналанцюговареакція. ДлявиявленняM. pneumoniaерозробленаівпроваджена тест-система, яка дозволяє виявити поодинокі мікоплазми, які іншими способами виділити неможливо.
Упрактичнихлабораторіяхдіагностику респіраторногомікоплазмозунайчастіше проводять на основі результатів серологічних досліджень. Найбільш широ-
314 |
Частина ІІІ. Спеціальна мікробіологія |
ко використовують реакції зв’язування комплементу, непрямої гемаглютинації, непрямої імунофлуоресценції та метод ІФА з використанням гліколіпідних антигенів M. pneumoniaе зарубіжних фірм.
Серед усіх серологічнихметодівнайбільш стандартизована постановка РЗК. Високі титри комплементзв’язуючих антитіл виявляють впродовж 3-7-го тижнів після видужування. Підвищення титру антитіл за допомогою РНГА виявляють раніше, ніж в РЗК. Ще чутливішим методом є діагностика за допомогою імуноферментного аналізу з використанням стандартного антигену, адсорбованого в лунках мікротитраційних полістирилових планшет. Діагностичним титром сироватки вважають 1:64.
Мікоплазменний артрит найчастіше викликає M. arthritidis, рідше M. fermentans, M. pneumoniaе, і U. urealyticum. Джерелом збудників, що уражають су-
глоби, є хворі люди або безсимптомні носії мікоплазм. Матеріалом для лабораторних досліджень є синовіальна рідина, кров, тканини суглобових хрящів.
Мікробіологічна діагностика зводиться до посіву досліджуваних матеріалів на щільні і двофазові середовища, виділення та ідентифікації чистих культур (табл. 67). Збудники абоантигениможна виявити в клінічному матеріалі за допомогоютихжеметодів, щовикористовуютьсядлядіагностикиреспіраторнихмікоплазмозів.
При проведенні серологічних досліджень найчастіше вживаютьреакції зв’я- зування комплементу, агрегат-аглютинації та імуноферментний аналіз.
Уреаплазмози – гострі або хронічні запальні процеси сечостатевих органів, викликані Ureaplasma urealyticum. Ці захворювання значно рідше може спричиняти іM. hominis. Підчасвагітностіуреаплазменнаінфекціяактивізуєтьсяйможе статипричиноюпередчаснихпологівтаспонтаннихабортів, апривнутрішньоутробному зараженні може викликати загибель плода. У зв’язку з неможливістю відрізнитизаклінічноюкартиною уреаплазмозвідторпідноїчихронічноїгонореї особливого значення набуває етіологічна діагностика, тобто виділення збудника.
Лабораторнідослідженнямаютьвирішальнезначенняврозпізнаванніурогенітальних запальних процесів, тим більше, що серед людей досить часто зустрічаєтьсябезсимптомненосійствомікоплазміуреаплазм. Найчастішевикористовують бактеріологічний та серологічний методи діагностики, а також мікроскопічне виявлення уреаплазм у препаратах сперми. Переваги надають культуральним методам.
Дуже важливо правильно взяти досліджуваний матеріал. У чоловіків його беруть з уретри не раніше як за 4-6 год до сечовипускання. Зовнішній отвір уретри ретельно очищають ватним тампоном, змоченим стерильною дистильованою водою. Перші краплини вільно витікаючих виділень при надавленні на уретру відкидають, а наступні використовують для посівів на рідкі та щільні середовища. При відсутності або незначних виділеннях проводять масаж уретри, а потім роблять зскрібок зі слизової оболонки ложечкою Фолькмана чи жолобкуватим зондом на глибині 2-3 см. Для посіву можна також використовувати секрет простати, сперму, осад із 10 мл першої ранкової порції сечі після її центрифугування.
Розділ 11. Мікробіологічна діагностика окремих інфекційних захворювань |
315 |
Ужінок матеріал для посіву беруть із уретри, каналу шийки матки і заднього склепіння вагіни перед чи відразу після менструацій.
Длякультивуванняуреаплазмвикористовуютьстандартнірідкійщільнісередовища, що виробляють в Українському НДІ дерматології та венерології (м. Харків). Посіви проводять відповідно до інструкції, що додаються до середовищ.
Пробіркиічашкизпосівами вміщують у термостатнепізніше30-60 хвпісля взяттяіпосіву клінічного матеріалу. Облікрезультатів посівів у рідкесередовище проводять через 24-48 год. Посіви на щільне середовище інкубують при 37 °С в атмосферіпідвищеноговмістуСО2 протягом5 діб, проводячищоденнийконтроль за ростом колоній.
При посіві в рідке середовище уреаплазми змінюють його колір від початкового жовтого до рожевого при відсутності каламуті. Сумнівним вважаютьрезультат при зміні кольору середовища та наявності каламуті. Якщо колір середовища не змінився, результат оцінюють як негативний. На щільному середовищі уреаплазми утворюють характерні дуже дрібні колонії (0,1-0,2 мм) округлої форми із зубчастим краєм і зморщеною поверхнею. Їх досліджують під мікроскопом при малому збільшенні з використанням об’єктива 40× .
Ідентифікацію виділених культур проводять на основі їх морфології, характеру ростутаіншихознак. ВідіншихвидівмікоплазмU. urealyticum відрізняється здатністю гідролізувати сечовину, оскільки вона єдина продукує уреазу. Отже, метод визначення уреазної активності є основним при діагностиці уреаплазмозу.
Мікроскопічне визначення уреаплазм у препаратах сперми базується на виявленні ДНК збудника при забарвленні флуорохромом олівоміцином. Для цього використовують тест-систему, що виробляється в Українському НДІ дерматології та венерології.
Краплю сперми наносять на предметне скло, розподіляють її до розмірів покрівногоскельця, висушуютьіфіксуютьпротягом3 хвухолодному70° спирті. На мазок наносять робочий розчин олівоміцину на 30 хв, промивають дистильованою водою, додають краплю забуференого гліцерину і накривають покрівним скельцем. При мікроскопії під люмінесцентним мікроскопом уреплазми мають вигляд яскраво-зеленої зернистості на темному фоні препарату. Інші види бактерій також яскраво світяться, але вони легко відрізняються від уреаплазм за розмірами і формою. Інтенсивність зараження сперми уреаплазмами оцінюють за чотириплюсовоюсистемою: 4+ – максимальнакількістьуреаплазмувиглядіскупчень на більшості сперматозоїдів; 3+ – окремі уреаплазми і їх скупчення у двохтрьох полях зору; 2+ – невеликі скупчення уреаплазм на окремих сперматозоїдах; 1+ – поодинокі уреаплазми в препараті.
Для серологічної діагностики можна використати постановку реакцій зв’я- зування комплементу, непрямої імунофлуоресценції, непрямої гемаглютинації, агрегат-аглютинації та метод імуноферментного аналізу. Однак реактиви для цих реакційпокищомалодоступнідляпрактичнихлабораторійієлишеупрофільних науково-дослідних центрах.
Частина ІV
ВІРУСОЛОГІЯ
Розділ 12
БУДОВА І КЛАСИФІКАЦІЯ ВІРУСІВ
Відомо тисячі видів різноманітних вірусів людини, тварин, комах, рослин, бактерій. Вони відіграють надзвичайно велику роль у природі: виступають як фактор, що об’єднує складні живі системи органічного світу, служать переносникамигенетичної інформації. Саме за допомогою вірусів зроблені фундаментальні відкриття з розшифрування структури нуклеїнових кислот, механізмів реплікації ДНК та синтезу білка. Фундаментальне вивчення вірусів та бактеріофагів увінчалосяграндіознимиуспіхамигенної інженерії. Отже, вонидаютьключдорозуміння функціонування нуклеїнових кислот і сутності життя.
Понад 500 вірусів викликають різноманітні захворювання людини. Грип, інфекційні гепатити, жовта гарячка, геморагічні гарячки Ебола та Ласса, сказ, поліомієліт, СНІД.
Віруси – неклітинні форми живих істот, які характеризуються малими розмірами, відсутністю власних білоксинтезуючих та енергієгенеруючих систем, а також облігатним внутрішньоклітинним паразитизмом.
За ступенем небезпеки для людини віруси поділяють на чотири групи. До першої групи належать збудники гарячки Ебола, Ласса, Марбурга, Мачупо, натуральної віспи, до другої входять арбо- і аренавіруси, віруси сказу, гепатитів А і В, ВІЛ. До третьої групи належать віруси грипу, поліомієліту, енцефаломіокардиту, вісповакцини. Четвертагрупапредставленаадено-, корона-, герпес-, реотаонковірусами. Цей поділ певною мірою умовний, так як внаслідок генетичної мінливості можуть з’являтися штами вірусів з підвищеною вірулентністю.
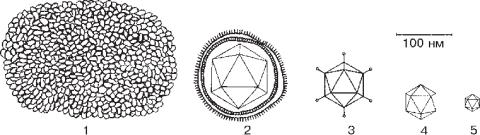
Структуравірусів. Окремавірусначастинкаодержаланазвувіріон. Вінскладаєтьсязоднієїмолекулинуклеїновоїкислоти(ДНКабоРНК) табілкового футляра, що її оточує, – капсида. Разом вони формують нуклеокапсид. Капсиди утворені з білкових субодиниць (поліпептидів), які називаються капсомерами. Їх кількість стабільна для кожного виду вірусів і використовується як таксономічна ознака. Віруси з таким типом будови називають простими. До них належать найдрібнішізпатогеннихвірусівлюдини: поліовіруси, аденовіруси, паповавіруси.
Протебільшістьвірусівмаєщеоднуоболонку – суперкапсидну, якамістить ліпіди. Вона пронизана вірусспецифічними білками-глікопротеїдами, які на поверхніоболонкиутворюютьособливістуктури, щоназиваютьсяшипами. Таківіруси називають складними або оболонковими. Структурною одиницею суперкап-
Розділ 12. Будова і класифікація вірусів |
317 |
сидної оболонки єпепломер. До них належать віруси сказу, герпесу, грипу, енцефалітів, імунодефіциту людини та ін.
Віріонихарактеризуютьсяпоняттямсиметрії. Типсиметріїзалежитьвідспособу укладки нуклеїнової кислоти і, відповідно, розташування капсомерів навколо неї. Виділяють ізометричний (або кубічний), спіральний та змішаний типи симетрії. Кубічний тип характеризується тим, що капсомери утворюють багатогранник(найчастішеікосаедр– 20-гранник). УсівідоміДНК-геномнівірусимають складні капсиди (аденовіруси, герпесвіруси, парвовіруси), а також деякі віруси, що містять РНК – пікорнавіруси, тогавіруси.
У віріоні зі спіральною симетрією молекула нуклеїнової кислоти закручена разом із капсомерами в тугу спіраль. Такий тип симетрії мають віруси мозаїчної хвороби тютюну, грипу, кору, епідемічного паротиту та ін.
Комбінованийтипсиметріїспостерігаєтьсяудеякихбактеріофагів. Прицьому головка бактеріофага має кубічний тип симетрії, а нуклеопротеїд, розміщений у хвості, укладається спірально.
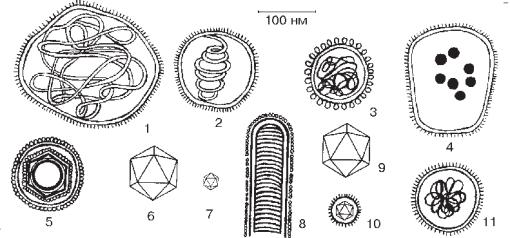
Форма вірусів може бути найрізноманітнішою: паличкоподібна (віруси мозаїчної хвороби тютюну), кулеподібна (віруси сказу), сферична (віруси грипу, папіломи), кубоїдальна (віруси натуральної віспи), головчаста або сперматозоїдна (бактеріофаги), ниткоподібна (вірусиЕбола, вірусибактерій). Нарис85 і86 представленіосновніформиіструктуринайпоширенішихРНК- іДНК-геномнихвірусів.
Класифікація вірусів. В основі сучасної класифікації вірусів лежать ознаки, щохарактеризуютьтип нуклеїновоїкислоти, їхморфологію, особливостірепродукції, антигенні властивості тощо. За наявністю нуклеїнової кислоти їх поділяють на ДНК-геномні та РНК-геномні віруси. Із 71 відомої родини вірусів 20 родин містять віруси, патогенні для людини (табл. 68).
Хімічний склад вірусів. Віруси містять лише один тип нуклеїнової кислоти (ДНК або РНК), яка становить від 1 до 40 % маси віріона. Вірусні геноми містять інформацію, достатню для синтезу лише декількох білків. Їх маса сягає 10-15 мг, щов1 млнразівменше, ніжуклітини, адовжина– до0,093 мм. Числонуклеотиднихпарколиваєтьсявід3150 (вірусгепатитуВ) до230000 (віруснатуральноївіспи). Віруси характеризуються надзвичайним розмаїттям форм геному. Він може бути представлений як односпіральними, так і двоспіральними молекулами, бути лінійним, циркулярним або фрагментованим.
Рис. 85. Форма, розміри і структура деяких ДНК-геномних вірусів:
1 – Poxviridae; 2 – Herpesviridae; 3 – Adenoviridae; 4 – Papovaviridae; 5 – Parvoviridae.
318 |
Частина ІV. Вірусологія |
Рис. 86. Форма, розміри і структура деяких РНК-геномних вірусів:
1 – Paramyxoviridae; 2 –Orthomyxoviridae; 3 – Coronaviridae; 4 – Arenaviridae; 5 – Retroviridae; 6 – Reoviridae; 7 – Picornaviridae; 8 – Rhabdoviridae; 9 – Orbiviridae; 10 – Togaviridae;
11 – Bunyaviridae.
Білки вірусів (70-90 % маси віріона) поділяються на структурніта неструктурні. Структурними називають такі білки, які входять до складу зрілих позаклітинних віріонів. Вони виконують ряд важливих функцій: захищають нуклеїнову кислоту від зовнішнього пошкодження, взаємодіють з мембранами чутливих клітин, і забезпечують проникнення вірусу в клітину, мають РНК- і ДНК-поліме- разну активність та ін. Неструктурні білки не входять до складу зрілих віріонів, однак утворюються під час їх репродукції. Вони забезпечують регуляцію експресії вірусного геному, є попередниками вірусних білків, здатні пригнічувати клітинний біосинтез. Залежно від розташування у віріоні, білки поділяються на капсидні, суперкапсидні, матриксні, білки серцевини та асоційовані з нуклеїновою кислотою.
Ліпіди містяться в складних вірусах і входять до складу суперкапсидної оболонки, утворюючи її подвійний ліпідний шар. Вони стабілізують вірусну оболонку, забезпечують захист внутрішніх шарів віріонів від гідрофільних речовин зовнішнього середовища. Віруси мають до 15-35 % ліпідів. Ліпопротеїди – комплекс вірусних суперкапсидних білків та ліпідів клітинної мембрани яких віруси набувають при виділенні з клітини під час репродукції.
Молекули вуглеводів входять до складу глікопротеїнів, гліколіпідів, сягаючи 3,5-9 %. Вони відіграють важливу роль, забезпечуючи захист відповідних молекул від дії клітинних протеаз.
Різні групи вірусів мають неоднакову стійкість до дії факторів зовнішнього середовища. Найчутливіші до них віруси, що мають ліпопротеїнову оболонку. Наприклад, віруси грипу, парагрипу, епідемічного паротиту інактивуються на поверхнях за декілька годин, проте аденовіруси зберігають інфекційні властивості декілька днів. Чутливість вірусів до дії рентгенівського та ультрафіолетового оп-
Розділ 12. Будова і класифікація вірусів |
|
|
319 |
|||
|
|
Класифікація вірусів |
Таблиця 68 |
|||
|
|
|
||||
|
|
|
|
|
|
|
|
Наявність |
Тип |
Розміри |
Структура |
Віруси, |
|
Родина, рід |
суперкап- |
патогенні |
||||
симетрії |
(нм) |
РНК |
||||
|
сиду |
|
|
|
для людини |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
РНК-геномні віруси |
|
|||
Picornaviridae |
Ні |
Кубічний |
28 |
Однониткова, |
Поліовіруси, |
|
|
|
|
|
лінійна, несегмен- |
Коксаки-, |
|
|
|
|
|
тована, “плюс” |
ЕСНО-, рино- |
|
|
|
|
|
|
віруси, віруси |
|
|
|
|
|
|
ящура, віруси |
|
|
|
|
|
|
гепатиту А |
|
Caliciviridae |
Ні |
Кубічний |
38 |
Однониткова, |
Вірус Норвoлк, |
|
|
|
|
|
лінійна, несегмен- |
вірус гепатиту Е |
|
|
|
|
|
тована, “плюс” |
|
|
Astroviridae |
Ні |
Кубічний |
28-30 |
Однониткова, |
Астровіруси |
|
|
|
|
|
лінійна, несегмен- |
людини |
|
|
|
|
|
тована, “плюс” |
|
|
Togaviridae |
Так |
Кубічний |
60 |
Однониткова, |
Віруси Синдбіс, |
|
|
|
|
|
лінійна, |
Чикунгунья, |
|
|
|
|
|
несегментована, |
віруси східного |
|
|
|
|
|
“плюс” |
американського, |
|
|
|
|
|
|
західного |
|
|
|
|
|
|
американського і |
|
|
|
|
|
|
везикулярного |
|
|
|
|
|
|
енцефаломієлітів |
|
|
|
|
|
|
коней, віруси |
|
|
|
|
|
|
краснухи |
|
Flaviviridae |
Так |
Кубічний |
45-60 |
Однониткова, |
Віруси кліщо- |
|
|
|
|
|
лінійна, несегмен- |
вого та японсь- |
|
|
|
|
|
тована, “плюс” |
кого енцефалітів, |
|
|
|
|
|
|
жовтої гарячки, |
|
|
|
|
|
|
гарячки |
|
|
|
|
|
|
Західного Нілу, |
|
|
|
|
|
|
гепатиту С |
|
Coronaviridae |
Так |
Спіраль- |
80-220 |
Однониткова, |
Коронавіруси |
|
|
|
ний |
|
лінійна, несегмен- |
|
|
|
|
|
|
тована, “плюс” |
|
|
Paramyxoviridae |
Так |
Спіраль- |
120-150 |
Однониткова, |
Віруси пара- |
|
|
|
ний |
|
лінійна, |
грипу, кору, |
|
|
|
|
|
несегментована, |
паротиту, респі- |
|
|
|
|
|
“мінус” |
раторно-синци- |
|
|
|
|
|
|
тіальний вірус |
|
Rhabdoviridae |
Так |
Спіраль- |
75-180 |
Однониткова, |
Вірус сказу, |
|
|
|
ний |
|
лінійна, несегмен- |
везикулярного |
|
|
|
|
|
тована, “мінус” |
стоматиту |
|
|
|
|
|
|
|
|
320 |
|
|
|
Частина ІV. Вірусологія |
|
|
|
|
|
Продовження табл. 68 |
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
Filoviridae |
Так |
Спіраль- |
80-14000 |
Однониткова, |
Віруси Ебола і |
|
|
ний |
|
лінійна, несегмен- |
Марбург |
|
|
|
|
тована, “мінус” |
|
Orthomyxo- |
Так |
Спіраль- |
80-120 |
Однониткова, |
Віруси грипу |
viridae |
|
ний |
|
лінійна, 8 сегментів, |
|
|
|
|
|
“мінус” |
|
Bunyaviridae |
Так |
Спіраль- |
80-120 |
Однониткова, |
Хантавіруси, |
|
|
ний |
|
циркулярна, 3 |
вірусКримської- |
|
|
|
|
сегменти, “мінус” |
Конго гарячки, |
|
|
|
|
|
вірускаліфор- |
|
|
|
|
|
нійського |
|
|
|
|
|
енцефаліту |
Arenaviridae |
Так |
Спіраль- |
110-130 |
Однониткова, |
Вірус |
|
|
ний |
|
циркулярна, 2 |
лімфоцитарного |
|
|
|
|
сегменти, “мінус” |
хоріоменінгіту, |
|
|
|
|
|
віруси гарячки |
|
|
|
|
|
Ласса, Мочупо |
Reoviridae |
Ні |
Кубічний |
70-80 |
Двониткова, 10-11 |
Реовіруси, |
|
|
|
|
сегментів |
орбівіруси, |
|
|
|
|
|
ротавіруси |
Retroviridae |
Так |
Кубічний |
80-100 |
Однониткова, |
ВІЛ, вірус Т- |
|
|
|
|
лінійна, несегмен- |
клітинної |
|
|
|
|
тована, “плюс” |
лейкемії людини |
|
|
Некласифіковані |
РНК- |
геномні віруси |
|
Bornaviridae |
Так |
Кубічний |
До 100 |
Однониткова, |
Віруси хвороби |
|
|
|
|
лінійна, несегмен- |
Борна |
|
|
|
|
тована, “мінус” |
|
Deltavirus |
Так |
Невідомо |
37 |
Однониткова, |
Вірус гепатиту |
|
|
|
|
циркулярна, кільце, |
Дельта |
|
|
|
|
“мінус” |
|
|
|
ДНК-геномні віруси |
|
||
Hepadnaviridae |
Так |
Кубічний |
40-48 |
Частково |
Вірус гепатиту В |
|
|
|
|
двониткова, |
|
|
|
|
|
циркулярна |
|
Parvoviridae |
Ні |
Кубічний |
18-26 |
Однониткова, |
Віруси |
|
|
|
|
лінійна |
ревматоїдного |
|
|
|
|
|
артриту, |
|
|
|
|
|
інфекційної |
|
|
|
|
|
еритеми, |
|
|
|
|
|
гемолітичної |
|
|
|
|
|
анемії |
Papovaviridae |
Ні |
Кубічний |
45-55 |
Двониткова, |
Віруси папіломи, |
|
|
|
|
циркулярна |
поліоми |
Adenoviridae |
Ні |
Кубічний |
85-110 |
Двониткова, |
Аденовіруси |
|
|
|
|
лінійна |
|
|
|
|
|
|
|
