
Практична мікробіологія - Климнюк С. І. - 2004
.pdf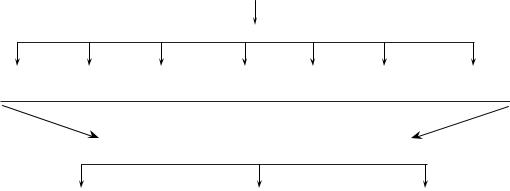
Розділ 14. Шпитальні інфекції |
381 |
Схема бактеріологічного дослідження при захворюваннях дихальних шляхів
Досліджуваний матеріал (мазки з носа, зіва, харкотиння, промивні води бронхів)
Мікроскопія
ЖСА Шоколадний |
Кров’яний |
Середовище |
Агар |
Триптиказо- |
Тіогліколеве |
агар |
агар |
Ендо |
Сабуро |
соєвий агар |
середовище |
Мікроскопія підозрілих колоній
Посів на середовища для одержання чистих культур
Мікроскопічне дослідження |
Ідентифікація |
Визначення чутливості |
виділених чистих культур |
|
до антибіотиків |
гень, аспірати трахеї. Мазки беруть тампонами натще до чищення зубів, полоскання рота, носа і глотки. Синтетичну гігроскопічну вату для виготовлення тампонів використовувати не слід, оскільки вона містить альгінат натрію, який згубно впливає на мікрофлору. Для кожної ніздрі беруть окремий тампон. При заборі матеріалу з ротоглотки не можна торкатись тампоном до слизової рота і язика. Матеріал із носоглотки беруть спеціальним задньоглотковим тампоном.
Ранкову порцію харкотиння збирають у стерильну банку. Перед цим хворий чистить зуби і прополіскує рот кип'яченою водою для видалення залишків їжі, епітеліальних клітин та мікрофлори ротової порожнини.
Досліджуваний матеріал спочатку мікроскопують у мазках, забарвлених за Грамом, й одночасно проводять посів. Мікроскопія є важливим орієнтиром для вибору оптимальних живильних середовищ.
При перегляді мазків оцінюють загальну картину мікрофлори наявність ста- філо-, мікроістрептококів, нейсерій, капсульнихпневмококівіклебсієл, грамнегативних паличок, міцелію і бластоспор грибів При гострій інфекції в харкотинні виявляють бактерії, розміщені поблизу лейкоцитів. Мікроорганізми з ротової порожнини розташовуються навколо епітеліальних клітин, їх до уваги не беруть Скоріше всього вони свідчать про порушення техніки забору В таких випадках взяття матеріалу необхідно повторити.
Посіви проводять на кров'яний і шоколадний агар, ЖСА, середовища Ендо і Сабуро, які попередньо підігрівають у термостаті. При посіві тампоном матеріал спочаткувтираютьвсередовищенаневеликійділянці(2-3 см2), апотімштрихами по всій поверхні середовища,
Перед посівом харкотиння спочатку виливають у чашку Петрі, вибирають 2-3 гнійні грудочки, тричі відмивають їх від супутньої мікрофлори в стерильному
382 |
Частина ІV. Вірусологія |
ізотонічному розчині хлориду натрію і наносять на середовище. Посів проводять стерильнимсклянимшпателем, рівномірнорозтираючиматеріалпоповерхнісередовища. Через 18-24 год інкубації в термостаті підраховують кількість колоній, виділяють чисті культури та проводять їх ідентифікацію загальноприйнятими методами. Обов'язкововизначаютьїхчутливістьдоантибактеріальнихпрепаратів
Якдодатковийвикористовуютьікількіснийметодвизначеннябактерійухаркотинні. Для цього 1 мл харкотиння гомогенізують в 9 мл бульйону чи пептонної води за допомогою скляних бусинок у колбі протягом 20 хв, або в ступках із стерильним кварцевим піском. Потім із гомогенізованого матеріалу готують серійні розведення від 10-1 до 10-7 і по 0,1 мл із останніх трьох розведень висівають на кров’яний агар. На середовища Ендо і Сабуро сіють 0,1 мл початкового розведення (1:10) Через 24 год інкубації в термостаті підраховують кількість колоній кожного виду мікроорганізмів. Діагностично значущим є виявлення S.рпеитоniае і Н.influenzae в концентрації 106 і більше бактерій в 1 мл. Для умовно-патогенних мікроорганізмів така концентрація має значення при 2-3-кратному їх виявленні з інтервалом у 3-5 днів.
Важливе значення має кількісна оцінка колоній і при первинному посіві на щільні середовища. При цьому використовують такі критерії (ступені): перший – ріст поодиноких колоній (до 10); другий – ріст від 10 до 25 колоній; третій – ріст 50 і більше колоній; четвертий – суцільний ріст, колонії не можна підрахувати.
Третій-четвертий ступінь, як правило, свідчить про етіологічну роль даного мікроорганізму, перший і другий – про носійство або контамінацію.
При підозрі на вірусні інфекції дихальних шляхів досліджуваний матеріал направляютьдовірусологічноїлабораторії, де проводятьвідповідні вірусологічні дослідження.
Гнійно-запальні, ранові та опікові інфекції. Збудниками ранових і гнійних післяопераційних ускладнень є стафіло- і стрептококи, грамнегативні бактерії, клостридії, бактероїди, фузобактерії та ін. Остеомієліти, мастити, омфаліти, отити найчастіше викликають золотистий і епідермальний стафілококи, апендицити і перитоніти – ешерихії, протей, бактероїди, ентерококи, клебсієли, часто в асоціаціях зі стафілококами. Опікові інфекції спричиняють стафілококи, псевдомонадитаіншіграмнегативнібактерії, представникинормальноїмікрофлори шкірита слизових оболонок.
Матеріал із рани або поверхні опіків беруть двома стерильними тампонами (один – для виготовлення мазків, другий – для посіву). Гній, шматочки видалених тканин, промивну рідину з дренажів забирають у стерильні пробірки при дотриманні правил асептики і протягом годинидоставляють до лабораторії. При ураженні зовнішнього вуха проводять спочатку обробку шкіри 70 % спиртом, потім беруть матеріал стерильним ватним тампоном. Якщо запальний процес локалізується в середньому або внутрішньому вусі, досліджують пунктат і матеріал, взятий під час операцій. Матеріал із кон’юнктиви, рогівки і повік беруть бактеріологічною петлею(абомаленьким тампоном). Забірматеріалу проводить лікар-окуліст.
Розділ 14. Шпитальні інфекції |
383 |
Виготовлені для мікроскопії мазки фарбують за Грамом (в разі потреби за Романовським-ГімзоюабоЦілем-Нільсеном). Привиявленнімікроорганізмівописують їх морфологічну характеристику і густину обсіменіння За результатами мікроскопії вибирають живильні середовища і вносять корективи в хід мікробіологічного дослідження.
Посіви матеріалу роблять на 5 % кров’яний агар, цукровий бульйон та середовище для контролю стерильності. Посів на щільні середовища проводять за методом“тампон-петля”. Спочаткутампономпроводятьдоріжкуподіаметручашки, потім другою стороною тампона засівають ще одну “доріжку” паралельну першій. Після цього матеріал розсівають петлею штрихами, перпендикулярними до “доріжок”. Такий посів дає можливість виділити бактерії у вигляді окремих колоній навіть із мікробних асоціацій.
Посіви на щільні та в рідкі середовища інкубують при 37 °С протягом доби. При виявленні росту окремі колонії відсівають на елективні середовища з метою їх ідентифікації. Обов'язково відмічають чи мікроби ростуть у вигляді монокультури, чи в асоціації. При наявності асоціацій відмічають переважний ріст того чи іншогопредставникаасоціації. Врядівипадківрекомендуютьпроводитиікількісні дослідження, визначаючи концентрацію мікробів в 1 мл гною, ексудату чи в 1 г видаленої тканини.
Припідозрінанаявністьудосліджуваному матеріалігрибів, посівдодатково проводять ще й на середовище Сабуро і вирощування здійснюють при температурі 22-25 °С протягом 5 діб. При підозрі на виділення нейсерій посіви проводять на сироватковий агар і тіогліколевий бульйон. Інкубацію проводять при 37 °С в ексикаторі при 5-10 % СО2.
Виділені чисті культури ідентифікують за морфологічними, культуральними, біохімічними та антигенними їх властивостями, як це описано у відповідних розділах спеціальної мікробіології.
Урогенітальні інфекції. Цистити, уретрити, пієлонефрити, уросепсис та ін. можуть викликати стафіло- і стрептококи, протей, ешерихії, псевдомонади, клебсієли, мікоплазми. При бактеріологічному дослідженні важливо правильно взяти пробу, провести якісне і кількісне визначення мікроорганізмів в 1 мл сечі ще до початку антимікробної терапії.
Безпосередньо перед забором сечі необхідно обмити з милом зовнішні статеві органи. У стерильний посуд беруть 3-5 мл середньої порції сечі і засівають біля ліжка хворого або доставляють до лабораторії протягом 30 хв. У разі неможливого негайного дослідження сечу зберігають у холодильнику не більше 24 год.
Для посіву сечі біля ліжка хворого рекомендують метод “предметного скла”. Стерильне предметне скло покривають шаром розтопленого агару і після застигання середовища занурюють у стаканчик із сечею, виймають, дають сечі стекти, інкубують скельце в чашці Петрі18-24 год при37 °С. Ізольованіколоніїідентифікують.
Зметоюкількісногомікробіологічного дослідження сечінайчастішевикористовують метод каліброваної петлі, якою проводять секторні посіви (рис. 95).

384 |
|
Частина ІV. Вірусологія |
А |
|
Платиновою петлею, діаметром 2 мм(ємність |
|
|
0,005 мл), проводять посів сечі (30-40 штрихів) на |
|
1 |
агар в секторі А. Петлю стерилізують у полум'ї |
|
|
пальника і проводять нею 4 штрихових посіви з |
|
|
сектора Авсектор1, ізсектору 1 у сектор 2, із сек- |
|
|
тору 2 в сектор 3. Чашки інкубують протягом доби |
|
|
при 37 °С, після чого підраховують кількість ко- |
|
|
лоній, що виросли в різних секторах. Ступінь бак- |
3 |
2 |
теріурії визначають за методом Гоулда (табл. 74). |
|
|
Метод секторних посівів дає можливість не |
Рис. 95. Схема повторних |
тільки визначати ступінь бактеріурії, а й виділяти |
|
посівів каліброваною петлею. |
збудника в чистій культурі. |
|
В 1 мл сечі здорової людини міститься не більше 104 бактерій (критичне число 105 мікробів) При виявленні 106-108 і більше бактерій в 1 мл сечі наявність інфікування сечовивідних шляхів вважають безсумнівним.
Длявизначеннялокалізаціїінфекційногопроцесувниркахчисечовомуміхурі проводятькатетеризаціюостаннього. Задопомогоюкатетеравипускаютьвсюсечу іпромиваютьсечовийміхуррозчиномантибіотика(неоміцин), потімтричізінтервалом 10 хв беруть проби сечі для бактеріологічного дослідження. Якщо інфекційнийпроцесуражуєнирки, вусіхтрьохпробахсечібудутьзнаходитисьбактерії, кількість яких зростає в кожній наступній порції. При інфекції тільки сечового міхура сеча залишається стерильною.
Гнійно-запальні процеси жіночих статевих органів (уретрити, вульвовагініти, цервіцити, ендометрити, бартолініти та ін.) можуть викликати як облігатні
Таблиця 74
Визначення інтенсивності бактеріурії за Гоулдом
Кількість колоній в секторах |
|
Кількість бактерій |
|||
|
|
|
|
в 1 мл сечі |
|
А |
1 |
2 |
3 |
||
|
|||||
|
|
|
|
|
|
1-6 |
- |
|
|
<1000 |
|
8-20 |
- |
- |
- |
3000 |
|
21-30 |
- |
- |
- |
5000 |
|
31-60 |
- |
- |
- |
10000 |
|
70-80 |
- |
- |
- |
50000 |
|
100-150 |
5-10 |
- |
- |
100000 |
|
He підраховуються |
20-30 |
- |
- |
500000 |
|
-“- |
40-60 |
- |
- |
1 млн |
|
-“- |
100-140 |
10-20 |
- |
5 млн |
|
-“- |
не підрахо- |
30-40 |
- |
10 млн |
|
вується |
|||||
|
|
|
|
||
-“- |
-“- |
60-80 |
поодинокі |
100 млн |
|
колонії |
|||||
|
|
|
|
||
|
|
|
|
|
|
Розділ 14. Шпитальні інфекції |
385 |
анаероби(бактероїди, пептострептококи, трепонеми, клостридії, гарднерели), так і факультативні анаероби (ентерококи, стафілококи, ешерихії, клебсієли, протей, псевдомонади, гриби кандида та ін.).
Основоюмікробіологічноїдіагностикицихзахворюваньєвиділеннятаідентифікація мікроорганізмів і встановлення їх етіологічної ролі. Бактеріологічні дослідженнямікрофлорижіночихстатевихорганівмаютьпевнітруднощі, оскільки вона часто змінюється в різні періоди життя жінки. Лише порожнина і придатки матки в нормі стерильні.
Взяття матеріалу для дослідження проводить акушер-гінеколог. Взірці матеріалу з уретри беруть ранком до сечовипускання бактеріологічною петлею або ложечкою Фолькмана. З вульви, піхви і шийки матки матеріал забирають ватним тампоном до проведення мануального дослідження. Для взяття матеріалу з порожнини матки використовують пристрої, що можуть розкриватись і закриватись на певній глибині (напр. шприц-аспіратор). При запаленні придатків матки матеріал беруть за допомогою пункції або при оперативному втручанні. Слід пам'ятати, що більшість збудників швидко гине в зовнішньому середовищі. У зв'язку з цим посіви необхідно проводити негайно або вносити проби в тіогліколеве чи гліцеринове середовище.
Одночасноізвзяттямматеріалу для посіву готуютьокремимитампонами2-3 мазки для мікроскопії, обережно розподіляючи матеріал на стерильних скельцях м’якими рухами, не вживаючи грубого втирання, висушують при кімнатній температурі. Мазки направляють до лабораторії в чашках Петрі або покривають чистими предметними скельцями. При такій техніці виготовлення мазків зберігається справжній розподіл і кількісне співвідношення компонентів досліджуваного матеріалу, дає можливість виявляти внутрішньоклітинне розташування бактерій (нейсерії).
Мазки фарбують за Грамом і мікроскопують під імерсійним об'єктивом. Відмічають кількість епітеліальних клітин, лейкоцитів, характер мікрофлори та визначають ступені чистоти вагінального секрету. Виявлення в мазках трихомонад, мікоплазм, уреаплазм, міцелію або бластоспор грибів має важливе діагностичне значення.
Для виділення факультативних анаеробів посіви проводять тампоном за допомогою штрихового методу на кров'яний агар і середовище Ендо, потім сіють тим же тампоном у цукровий бульйон. При підозрі на наявність анаеробів посіви проводять у тіогліколевий бульйон та середовище Кітта-Тароцці. В разі виявленняміцеліюабобластоспоргрибів, посівироблятьнаагарСабуро. Придослідженнішматочківтканинїхспочаткурозтираютьуступцізпіском, добавляютьбульйон або 0,85 % розчин хлориду натрію. По 0,1 мл гомогенату засівають на щільні середовища, а також у цукровий бульйон.
Посіви вирощують у термостаті при 37 °С (на агарі Сабуро при 22-25 °С), щодня перевіряючи наявність росту. Підраховують кількість різних видів колоній та їх співвідношення. При помутнінні бульйону виготовляють мазки й за результатами мікроскопії роблять висіви на щільні середовища (кров'яний агар, Ендо,
386 |
Частина ІV. Вірусологія |
ЖСА) Потім виділяють чисті культури, ідентифікують їх і визначають чутливість до антибіотиків.
При дослідженні матеріалу з ділянок, де в нормі вегетує своя мікрофлора, важливе значення має кількісна оцінка різних видів бактерій при первинному посіві. При цьому використовують такі критерії (ступені):
І – дуже слабкий ріст – ріст тільки в рідких середовищах, на щільних середовищах росту немає.
II – слабкий ріст – на щільному агарі ріст до 10 колоній.
III – помірний ріст – на щільному агарі ріст більше 100 колоній. IV – дуже густий (суцільний) ріст.
Перший і другий ступені росту вказують частіше на стороннє забруднення, третій і четвертий – на етіологічну роль даного мікроорганізму.
Негативний результат дослідження видають при відсутності росту на всіх середовищах протягом 72 год (на агарі Сабуро – впродовж 5 діб).
Гострі кишечні інфекції. Збудниками харчових інтоксикацій є ентеротоксигенні стафілококи, палички ботулізму та інші види клостридій. Харчові токсикоінфекції здатні викликати численні види ентеробактерій, псевдомонад, вібріонів, бацил, кампілобактерії та ін. Особливо часто виникають внутрішньолікарняні випадкисальмонельозів. Окрім того, їхможуть викликатиротавіруси та криптоспоридії.
Для виявлення збудників захворювань в різних ділянках кишечного тракту використовують переважно бактеріологічний метод дослідження. При ураженні шлунка найоптимальнішим вважають забір біоптатів під час фіброгастроскопії. Взяті пробивміщують у стерильний ізотонічний розчин і направляють до лабора-
Схема бактеріологічного дослідження при кишечних інфекціях
Досліджуваний матеріал (біоптати, фекалії, блювотні маси, промивні вода шлунка, жовч)
Мікроскопія
Середовище |
|
ЖСА |
|
|
|
Середовище |
|
Кров’яний |
Тіогліколеве |
|||||||||||||||
збагачення |
|
|
|
|
|
|
Ендо |
|
МПА |
середовище |
||||||||||||||
|
|
|
|
|
|
|
Мікроскопія підозрілих колоній |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Середовище |
|
|
|
|
Середовище Олькеницького |
|
|
Агар |
|
|||||||||||||||
Ендо |
|
|
|
|
|
|
Цейслера |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мікроскопія |
|
Мікроскопія |
|
|
|
Визначення |
|
Ідентифікація |
|
|
|
|
Середовище |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
чутливості до |
|
|
|
|
|
|
|
|
|
для |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
антибіотиків |
|
|
|
|
|
|
|
|
|
анаеробів |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розділ 14. Шпитальні інфекції |
387 |
торії. Але найчастіше в якості досліджуваного матеріалу для діагностики кишкових інфекцій забирають фекалії, блювотні маси і промивні води шлунка.
Бактеріологічнедослідженняпотрібнорозпочинатинепізніше0,5-1 годпісля взяттяматеріалу. Якщоценеможливо, пробислідзаморозитиідослідитинепізніше 24 год. Іноді для транспортування доцільно вживати консервуючі рідини (30 % гліцерин, селенітовий бульйон тощо). Промивні води необхідно досліджувати негайно. При великій кількості їх краще процентрифугувати і дослідити осад. Жовч беруть за допомогою зондування окремими порціями (А, В, С) у три стерильні пробірки. Взяті проби направляють до лабораторії не пізніше 1-2 год. Матеріал із тонкоїкишкивідбирають за допомогоюфібродуоденоскопіі абоспеціальним зондом, що відкривається і закривається в заданому місці. Мікроорганізми товстої кишки вивчають при дослідженні фекалій. Мазок із прямої кишки беруть тампономаботрубкоюЦімана. Приураженнінижніхвідділівтовстогокишечникаможнавзятиматеріал безпосередньозмісцяураженнязадопомогоюректороманоскопа, але цей метод останнім часом використовують рідко. Частіше для цього застосовують фіброколоноскопію.
Посіви досліджуваного матеріалу проводять на щільні та рідкі елективні середовища, виділяють чисті культури, визначають їх чутливість до антибіотиків.
При оцінці результатів бактеріологічного дослідження необхідно звертати увагунетількинавидовийскладмікробіоценозукишечникауданогохворого, ай кількісне співвідношення окремих його співчленів.
Якщо з випорожнень виділяють патогенні ентеробактерії, гемолітичні ешерихії та гемолітичні стафілококи, які у здорових людей відсутні, це має важливе діагностичнезначення. Длявизнанняетіологічноїроліпредставниківнормальногомікробіоценозуважливопорівнюватиїхтитрзконцентрацієювідповіднихмікроорганізмів у здорових дітей і дорослих. При ураженнях, викликаних іншими видами, необхідно проводити дослідження у відповідності з методикою виділення кожного збудника.
Частина V
МІКОЗИ
Захворювання, що викликаються патогенними та умовно-патогенними грибами, називаютьсямікозами. Длялюдинихвороботворнимиєбіляставидівгрибів, які входять до семи класів: хітрідіоміцетів, гіфохітрідіоміцетів, ооміцетів, зигоміцетів, аскоміцетів, базидіоміцетів і дейтероміцетів. Розрізняють такі основні групи грибкових захворювань людини:
1.Поверхневі мікози або сапрофітії, при яких уражається роговий шар епідермісу і поверхні волосяних стержнів.
2.Дерматомікози – ураження шкіри, її придатків, волосся і нігтів.
3.Підшкірні мікози – патологічний процес первинно локалізується в тканинах під шкірою, рідко у м’язах, кістках і суглобах.
4.Системні (респіраторні) мікози – первинне вогнище розмноження грибів у легенях, рідше зустрічаються диссеміновані форми з ураженням будь-яких внутрішніх органів (глибокі мікози).
5.Опортуністичні мікози (аспергільози, пеніцильози, кандидози) – виникають у осіб з імунодефіцитами.
Розділ 15
МЕТОДИ ЛАБОРАТОРНОЇ ДІАГНОСТИКИ МІКОЗІВ
Для мікробіологічної діагностики мікозів використовують мікроскопічні, мікологічні (культуральні), імунологічні (серологічні, алергічні та ін.), біологічні тагістологічніметодидослідження. Примікозахуражуютьсярізнітканиниіоргани: шкіра і слизові оболонки, органи дихання і кишечного тракту, серцево-судин- на і нервова системи, органи кровотворення, селезінка й печінка, лімфатична і сечостатева системи та ін. Залежно від клінічних проявів патологічного процесу матеріаломдлядослідженняможебутигній, харкотиння, зскрібкизішкіриінігтів, пунктати лімфовузлів і кісткового мозку, уражене волосся, кров, ліквор, шлунковий сік, жовч, сеча, випорожнення, біоптати тканин та ін.
Забірпатологічногоматеріалу. Успіхлабораторногодослідженнязалежить відправильноговзяттяматеріалу. Приураженнішкірилусочкизпериферіїсвіжого вогнищаураженняберутьскальпелем, апушковіволоски– пінцетом. Привисипках наступняхікистяхїхверхівкизрізаютьножицямичибритвою. Зскрібкизповерхневих уражень нігтів проводять скальпелем, а стовщені їх ділянки зрізають манікюрнимикусачками. ГнійізвідкритихураженьтавиразокберутьложечкоюФольк-
Розділ 15. Методи лабораторної діагностики мікозів |
389 |
мана, жолобкуватимзондом, пастерівськоюпіпеткою; іззакритихвогнищ, порожнин, абсцесів, лімфатичних вузлів – шприцом. Пробихаркотиння, жовчі, випорожнень вміщують у стерильні баночки з притертими пробками. Спинномозкову рідину беруть шляхом пункції шприцом, сечу – катетером при дотриманні правил асептики. Кровберутьізліктьовоївениукількості10 млівносятьуфлакониізрідким живильним середовищем. Біоптати вміщують у стерильну чашку Петрі.
Досліджуваний матеріал беруть з таким розрахунком, щоб його вистачило для виготовлення нативних і забарвлених препаратів, посіву в живильні середовища, постановки біопроби та гістологічного дослідження. У направленні до лабораторії вказують прізвище та ініціали хворого, його вік, попередній діагноз, локалізацію уражень, дату. При підозрінні на гістоплазмоз і кокцидіоїдоз матеріал направляють до спеціальних лабораторій.
Мікроскопічнедослідження. Доставленідолабораторіїпробиможнавивчати як у нативних (нефарбованих), так і в забарвлених препаратах.
Нативні препарати, виготовлені з лусочок шкіри, зскрібок із нігтів, волосся попередньопросвітлюютьу10-30 % КОНабоNa OH, лактофенолітаіншихрозчинах, бажанозпідігріванням надполум’ямпальника. Оброблений такимспособом матеріал наносять на предметне скло в краплю гліцерину, накривають покрівним скельцем і досліджують під звичайним світловим мікроскопом, використовуючи сухі об’єктиви (8× , 40× ). Кращі результати отримують при фазово-контрастній або аноптральній мікроскопії. При дослідженні гною, харкотиння, осаду спинномозкової рідини, жовчі та сечі виготовляють препарат надавленої краплі в ізотонічномурозчиніхлоридунатрію. Дослідженнянативнихпрепаратівдаєзмогувизначитихарактеррозташуванняспоргрибівуволосках, міцеліювураженихшкірних лусочкахізскрібкахізнігтів, удеякихвипадкахнавітьродовуналежністьзбудника. Остаточневизначеннявидугрибівможливелишепіслявиділеннятаідентифікації чистих культур.
Виготовлення забарвлених препаратів необхідно при дослідженні виразковоговмісту, виділень із нориць, грануляцій тощо. Такий в’язкий і рідкий матеріал розмазують на предметному склі тонким шаром. Зскрібки із грануляцій попередньо розділяють препарувальними голками. Потім мазки фіксують формаліном, сумішшю Никифорова або Карнуа чи 5 % розчином хромової кислоти, висушуютьнаповітрійзабарвлюютьоднимізрекомендованихспособівзалежновідмети дослідження і гаданої форми. Найчастіше використовують методи Грама-Вель- ша, Романовського-Гімзи, Мак-Мануса, Аравійського, Адамсона та ін. Вони детальноописані у спеціальних монографіях і посібниках (див. список літератури в кінцікниги). Узабарвленихмазкахкращевиявляютьокреміелементигрибівтаїх тонкі структури, ніж у нативних препаратах.
У ряді випадків проводять і електронно-мікроскопічні дослідження, особливо коли необхідно дослідити ультраструктуру грибів або механізм дії протигрибкових препаратів.
Мікологічні (культуральні) дослідження спрямовані на виділення чистих культургрибівприпосівахпатологічногоматеріалунаживильнісередовища, вив-
390 |
Частина V. Мікози |
ченняїхмакроімікроскопічноїбудовитародовоїівидовоїідентифікації. Взятий матеріал необхідно якомога швидше посіяти, щоб попередити розвиток у ньому сторонньої мікрофлори. Виключення становлять шкірні лусочки, які краще сіяти через 1-2 дні, коликокова флора відмирає на їх поверхні. Однак звільнити матеріалвідсапрофітнихгрибівпрактичнонеможливо. Дляцього необхідновикористати спеціальні елективні і селективні середовища.
Найчастіше посіви проводять на рідкі (пробне середовище Сабуро, пивне сусло, м’ясо-пептонний глюкозний бульйон) та щільні середовища (агар Сабуро, сусло-агар, глюкозо-кров’яний агар, картопляний і кукурудзяний агар, середовища Чапека і Френсіса).
Додавання до середовищ антибіотиків (пеніцилін, стрептоміцин, хлорамфенікол по 50-100 ОД/мл) та протигрибкових препаратів дезертоміцину і циклогексаміду (відповідно 0,1 і 0,5 мг/мл) робить вказані середовища селективними і є надійним захистом первинних посівів від проростання бактеріями і пліснявою.
Лусочки шкіри, частинки нігтів і волосків при посіві розташовують на агарі в пробірці трьома точками; харкотиння, гній та інший рідкий матеріал сіють точкою або штрихом у пробірках та чашках Петрі. Дуже часто результати посівів залежать від кількості засіяного матеріалу. Як правило, з однієї проби сіють матеріал в 3-4 пробірки або 2 чашки Петрі. Вирощування (інкубацію) посівів проводять у термостаті при порівняно низьких температурах (22-28 °С) протягом 2-3 тижнів.
Нарідких середовищах багатовидівгрибівростуть у вигляді повстяноподібного утворення спочатку на дні, а потім на стінках пробірки або ж у вигляді суцільної плівки на поверхні бульйону. На щільних середовищах окремі види утворюють різноманітні колонії: блискучі, гладенькі, щільної консистенції, пухнасті, ватоподібні, що погано знімаються петлею, оксамитово-ворсинчасті, гіпсота борошноподібні, крупнобугристі, що вростають у товщу агару тощо.
Виділені культури грибів ідентифікують за зовнішнім виглядом і формою колоній, їх консистенцією, кольоромта мікроструктурою, тобто характером міцелію, розташуваннямконідієносців, спортаіншимиознаками. Удеякихвидівгрибів вивчають і їх ферментативні властивості.
Недавно запропоновано новий метод ідентифікації патогенних грибів, особ- ливозбудниківтакихсистемнихмікозівякбласто-, крипто-, кокцидіоїдозів, гістоплазмозу шляхом визначення нуклеїнових кислот. Із культури екстрагують РНК і вносять одноланцюгові молекули ДНК, мічені флуоресцеїном. При наявності в культуріодногоізвказанихгрибівпроходитьгібридизаціявідповідноїДНКізРНК збудника з утворенням комплексу, що легко виявляється. Цей метод можна використати в ранні строки культивування грибів (4-5 діб).
Хорошіперспективидляшвидкоговиявленнягрибівабоїхантигенівудосліджуваному матеріалі відкриває метод полімеразної ланцюгової реакції.
Імунологічні дослідження. У сироватці крові хворих на мікози утворюються аглютиніни, преципітини, комплементзв’язуючі антитіла, гемаглютиніни, реагіни, які виявляють за допомогою реакцій аглютинації, преципітації, зв’язування
