
РАМАЗАНОВА К.Р
..pdf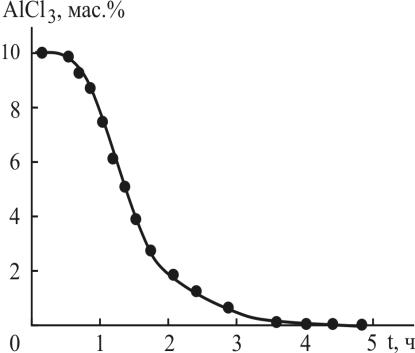
61
Для опытов использовали промышленные пробы алкилата с высоким содержанием остаточного катализаторного комплекса до и после узла разложения водой (таблица 3.2, I) и лабораторные образцы алкилата с низким содержанием кислых примесей после очистки с применением смесителя 2 (рис. 3.2, а; таблица 3.2, II, пробы 1-3, разложения). Алкилат с ёмкости 1 подавали в реактор 3 дозировочным насосом 2 со скоростью 1-2 л/ч или с объёмной скоростью соответственно 1-2 ч-1 или временем пребывания 0,5-1,0 ч согласно рекомендуемым условиям эксплуатации Амберлист 15 Wet [1а, 132], и очищенный алкилат собирали в сборнике 5 (рис. 3.3). Очистку алкилата от остаточного каталитического комплекса проводили при Т = 25°С. Установлена адсорбционная ёмкость 1 л Амберлист 15 Wet, которая имеет величины 150 г AICI3 и 40 г HCI из данных табл. 3.3 и кинетики десорбции (рис. 3.4).
|
|
|
|
|
Таблица 3.3 |
|
|
Адсорбция катионитом Амберлист 15Wet остаточного катализаторного |
|||||
|
|
комплекса и регенерация катионита водой |
||||
№ |
Содержание кислых примесей в алкилате, г/л |
Объём очищенного |
|
|||
|
|
|
|
|
||
опыта |
|
|
|
алкилата (л) 1 л катионита |
|
|
До очистки |
После очистки |
|
||||
|
AICI3 |
|
HCI |
AICI3 и HCI |
|
|
|
0,6 |
|
0,1 |
Х |
250 |
|
I |
0,2 |
|
0,0 |
Х |
750 |
|
3,0 |
|
0,8 |
Х |
50 |
|
|
|
|
|
||||
|
1,5 |
|
0,3 |
Х |
100 |
|
|
0,06 |
|
0,01 |
Х |
2500 |
|
II |
0,05 |
|
0,01 |
Х |
3000 |
|
0,06 |
|
0,01 |
Х |
2500 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
Примечание: Х – отсутствует.
62
Рис. 3.4. Кинетика десорбции хлорида алюминия водой (содержание в промывной воде) при регенерации 1 л катионита Амберлист 15 Wet при Т= 95°С и скорости подачи 1 л/ч.
Для регенерации катионита использовали горячую воду, температуру в реакторе поддерживали дополнительной подачей пара среднего давления 10-12 атм. в рубашку реактора (рис. 3.3). В процессе эксперимента температуру промывной воды контролировали термометром при выходе из реактора. Регенерацию или десорбцию кислых примесей из катионита проводили горячей водой при температуре 95°С и скорости подачи воды 1, 2, 3 и 4 л/ч согласно рекомендациям условий регенерации катионита Амберлист 15 Wet [1а, 132]. При регенерации катионита горячей водой (5 л), к примеру, со скоростью подачи 1 л/ч при температуре 95°С для десорбции 150 г AICI3 и 40 г HCI из катионита отношение объёма воды Vв=4-5 л к объёму VК=1 л катионита для регенерации или кратность с запасом составляет Vв/VК=5 (табл. 3.3; рис. 3.4). При выходе из реактора окончание процесса регенерации катионита контролировали по отсутствию хлорида-иона в промывной воде по качественной реакции с азотнокислым серебром. После регенерации в промывной воде содержание хлорида алюминия составило 3 г/л, а соляной кислоты – 0,8 г/л. В течение 8 месяцев проводились испытания по очистке алкилата от остаточного каталитического комплекса и регенерации катионита на пилотной установке (рис. 3.3). Было проведено 100 рециклов регенерации катионита горячей водой при Т = 95°С. За это время адсорбционная способность катионита Амберлист 15 Wet и полная статическая обменная ёмкость составила 1,7 мг-экв/см3, гранулометрический состав катионита не изменился. Газохроматографический анализ состава алкилата и определение фенола в алкилате до и после очистки от кислых примесей показал, что катионит Амберлист 15 Wet при температуре 25°С не влияет на компонентный состав алкилата (табл. 3.4).
|
|
|
|
|
|
|
|
|
|
Таблица 3.4 |
|
|
Компонентный состав алкилата до и после адсорбционной очистки |
||||||||||
|
|
от остаточного каталитического комплекса |
|
|
|
||||||
|
|
|
Компонентный состав алкилата, масс.% |
|
|
||||||
Алкилат |
Добен- |
Бензол |
|
Толуол |
Этилбен зол- |
Кумол |
Бутилбензолы |
и1,31,4 |
дику- - молы |
1,3,5– трикумолы |
|
|
зольная |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
фракция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
До |
2,50 |
55,50 |
|
0,34 |
1,07 |
33,50 |
0,47 |
|
6,40 |
0,22 |
|
очистки |
|
|
|
|
|
|
|
|
|
|
|
После |
2,40 |
55,55 |
|
0,32 |
1,00 |
33,80 |
0,43 |
|
6,20 |
0,30 |
|
очистки |
|
|
|
|
|
|
|
|
|
|
|
При этом на катионите не происходит изменений примесей фенола, который не сорбируется катионитом и остаётся в алкилате до и после адсорбции (таблица 3.2, II, пробы 1-3). Для снижения примесей фенола алкилат после адсорбционной очистки от остаточного каталитического комплекса использовали в серии экспериментов на лабораторной установке, где для интенсивного смешения 6%-ного раствора щелочи и алкилата задействован смеситель 3 (рис. 3.2).
После очистки содержание примесей фенола с 15•10-3 масс.% уменьшается до (2-4)•10-3 масс.% или снижается в 3-7 раз (табл. 3.2, II , пробы 1-3, нейтрализация),
63
что будет способствовать снижению содержания примесей фенола в товарном кумоле. На лабораторной установке (рис. 3.2) провели исследования процесса очистки раствором щелочи от примесей фенола кумола с содержанием 2,2•10-3 масс.% фенола, не соответствующего требованиям ГОСТ.
В табл. 3.5 приведены экспериментальные результаты очистки кумола от примесей фенола. При том среднее содержание примесей фенола в кумоле снижается почти в 7 раз от 2,2 до 0,3•10-3 масс.%, что почти в три раза меньше содержания примесей фенола 10-3 масс.% в товарном кумоле высшего сорта.
Таблица 3.5
Очистка «бракованного» кумола по содержанию примесей фенола при Т=25°С раствором 6 % щелочи
Массовая доля примесей фенола в кумоле, 104, % |
Степень очистки |
|
До очистки |
После очистки |
фенола, % |
|
3 |
86 |
|
3 |
84 |
|
4 |
83 |
22 |
4 |
82 |
|
2 |
88 |
|
2 |
90 |
|
3 |
85 |
|
4 |
81 |
Среднее: |
3 |
86 |
Использование смесителя (рис. 3.2) в процессе очистки алкилата от остаточного катализаторного комплекса и примесей фенола, «бракованного» кумола от примесей фенола позволяет увеличить степень извлечения этих примесей соответственно до 98 и 87% (табл. 3.2, II, пробы 1-3, разложение, нейтрализация) и 90% (табл. 3.5). Вместе с тем применение процесса адсорбции позволяет полностью или на 100% очищать алкилат от остаточного каталитического комплекса, что даёт возможность предотвратить образование трудно утилизируемого отхода – «мульмы» на узле нейтрализации примеси фенола алкилата (табл. 3.2, II, пробы 1-3, адсорбция, нейтрализация).
На основе результатов исследования процессов разложения, адсорбции и нейтрализации примеси алкилата (рис. 3.2-3.4, табл. 3.2-3.5) предлагается новая технологическая схема очистки алкилата, исключающая образование гидроксида алюминия (рис. 3.5).
Рис. 3.5. Блок-схема очистки алкилата от остаточного каталитического комплекса и примеси фенола без образования отхода – «мульмы»: 1– фильтр очистки от смолообразных веществ; 2 и 5 – смеситель; 3 – узел разложения; 4 – узел адсорбции; 6 – узел нейтрализа-
64
ции
Очень важно, что на узле нейтрализации происходит эффективное извлечение фенола из алкилата, а образование гидроксида алюминия или трудно утилизируемого отхода – «мульмы», затрудняющего фазовое разделение алкилата и водно-щелочного раствора, исключается.
Таким образом, применение смесителя потоков на стадии разложения и нейтрализации алкилата, а также 100% - ное извлечение из него кислых примесей адсорбции катионитом и возврат промывной воды регенерации катионита на стадию разложения позволяют: повысить эффективность извлечения остаточного катализаторного комплекса и фенола из потока алкилата; сэкономить воду на узле разложения; исключить образование трудно утилизируемого отхода - «мульмы», затрудняющего фазовое разделение алкилата и водно-щелочного раствора; повысить качество алкилата и кумола по содержанию фенола.
Данная разработка имеет экологический и экономический эффект. Изготовлена пилотная установка и внедрена для научно-исследовательских целей.
3.3. Переработка алюмохлорида в функциональные добавки композитов
Внастоящее время гидрокси – и гидроксихлоридные соединения алюминия, среди которых гексагидрат хлорида, полиоксихлориды, гидроксид алюминия и оксид алюминия, широко используются в качестве функциональных добавок различного технического назначения для получения полимерных композитов [1а].
Целесообразность применения полиоксихлорида алюминия (ПОХА), гидроксида и оксида алюминия в качестве добавок в композиционные материалы подробно описана в гл. 1.
Вкачестве объекта исследования использовали отход производства фенола и ацетона по кумольной технологии [1а, 34] - алюмохлорид с техническими показателями согласно ТУ 5152-005-47773738-2002 «Алюмохлорид».
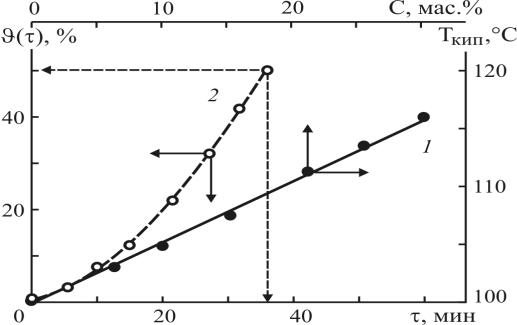
Для полного удаления механических и смолообразных примесей из алюмохлорида подобран фильтр-ткань (артикул RV-06-083). Исследованы физико-химические свойства (плотность, температура кипения) очищенного алюмохлорида от концентрации хлорида алюминия (табл. 3.6, рис. 3.6). Функциональная связь эксперимен-
тальных значений массовой доли хлорида алюминия С (масс.%) и плотности очищенного алюмохлорида ρ*(г/см3) при Т=20°С (табл. 3.6) описываются аппроксимационной формулой
С=100•(ρ*-1). (3.1)
Экспериментальные значения температуры кипения Ткип. очищенного алюмохлорида при атмосферном давлении от концентрации хлорида алюминия С (рис. 3.6, кр. 1) описываются формулой
Т кип. =100+0,533•С. |
(3.2) |
Из соотношений (3.1) и (3.2) следует функциональная зависимость температуры |
|
кипения очищенного алюмохлорида от его плотности |
|
Ткип. =100+53,3•(ρ*-1). |
(3.3) |
65
Установлены аппроксимации (3.1)-(3.3), описывающие экспериментальные данные (табл. 3.6, рис. 3.6, кр. 1) и позволяющие упростить аналитический контроль в промышленных условиях массовой доли хлорида алюминия по плотности очищенного алюмохлорида на уровне | С| ≤ 0,1 масс.% (табл. 3.6) и температуры кипения очищенного алюмохлорида или по его содержанию (рис. 3.6, кр.1) с точностью |ΔТ| ≤ 0,2ºС, или по плотности в практически важном диапазоне изменения концентрации хлорида алюминия 1 ≤ С ≤ 30 масс.% в рецикле AICI3 на узле разложения производства кумола [34].
|
|
|
|
Таблица 3.6 |
|
Экспериментальные и расчётные значения погрешности концентрации |
|||||
|
хлорида алюминия по плотности алюмохлорида |
|
|
||
Экспериментальные значения |
Расчётные |
Погрешность | С|, |
|
||
ρ*, г/см3 (Т=20°С) |
|
С, %, масс (AICI3) |
С = 100•(ρ*-1) |
масс. % |
|
1,010 |
|
0,9 |
1,0 |
0,1 |
|
1,056 |
|
5,6 |
5,6 |
0,0 |
|
1,109 |
|
11,0 |
10,9 |
0,1 |
|
1,126 |
|
12,5 |
12,6 |
0,1 |
|
1,152 |
|
15,2 |
15,2 |
0,0 |
|
1,172 |
|
17,2 |
17,2 |
0,0 |
|
1,2 |
|
19,9 |
20,0 |
0,1 |
|
1,226 |
|
22,7 |
22,6 |
0,1 |
|
1,250 |
|
25,2 |
25,0 |
0,2 |
|
1,271 |
|
27,2 |
27,1 |
0,1 |
|
1,3 |
|
30,1 |
30,0 |
0,1 |
|
|
|
Среднее: |
|
|0,07| масс. % |
|
Рис. 3.6. Зависимость температуры кипения Ткип очищенного от механических примесей алюмохлорида от концентрации хлорида алюминия С (масс.%, кр. 1); кинетика ϑ(τ) отгона солянокислого конденсата (ϑ – объёмная доля конденсата в % к исходному объёму алюмохлорида с плотностью ρ=1,20 г/см3, содержанием хлорида алюминия С=20
66
масс.% и 0,65 масс.% свободной соляной кислоты) при P= - 0,74 кгс/см2, равновесном остаточном давлений паровой фазы (кр. 2)
Впредварительных опытах установлено, что при отгонке воды из алюмохлорида при атмосферном давлении и повышении температуры термообработки выше 115ºС происходит нерегулируемый термический гидролиз алюмохлорида до образования нерастворимого в воде гидроксида алюминия. Поэтому из-за термической нестабильности соединений гидроксихлоридов алюминия в растворе [1а] были подобраны «деликатные» условия удаления воды при пониженных остаточных давлениях (вакуум) для снижения температуры кипения и термообработки алюмохлорида [63а-
68а].
Впроцессе эксперимента контролировали величины: остаточное давление или глубина вакуума в пересчёте на техническую единицу [кгс/см2], температура куба и верха, количество отгона конденсата в зависимости от времени (кинетика); наблюдали за началом кристаллообразования, изменением цвета маточного раствора и вы-
павшего осадка. В дальнейшем для экспериментов по термообработке выбрали очищенный от механических примесей алюмохлорид с плотностью 1,20 г/см3, содержанием органики 0,50 г/дм3, свободной соляной кислоты 0,65 масс. % и хлорида алюминия 20 масс.% из диапазона концентрации 17-27% согласно ТУ 5152-005- 47773738-2002 «Алюмохлорид».
Исследована кинетика отгона конденсата или зависимость объёмной доли кон-
денсата ϑ(τ) = (Vk/V0)•100 от времени τ, где текущее значение объёма конденсата Vk,
исходный объем алюмохлорида V0 в мл, а τ в мин. К примеру, для равновесного остаточного давления паровой фазы P= - 0,74 кгс/см2 значениям τ = 7,12,23 и 36 мин соответствуют объёмные доли конденсата ϑ(τ)=5,10,25 и 50% (рис. 3.6, кр. 2).
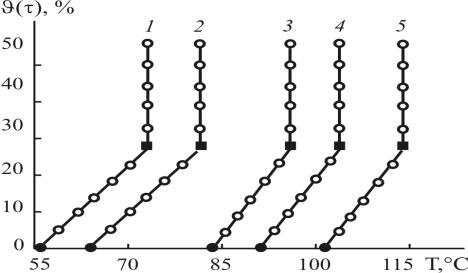
Рис. 3.7. Зависимость объёмной доли конденсата ϑ(τ) от температуры куба маточного раствора алюмохлорида при равновесных остаточных давлениях газовой фазы (глубина ваку-
ума) -P [кгс/см2]: 1 – 0,9; 2 – 0,8; 3 – 0,6; 4 – 0,4; 5 – 0,2 ( – температура кипения алюмохлорида с содержанием 20 масс.% хлорида алюминия;
– температура кипения алюмохлорида с содержанием 20 масс.% хлорида алюминия;  – температура начала вакуум – кристаллизации AICI3•6H2O)
– температура начала вакуум – кристаллизации AICI3•6H2O)
На рис. 3.7 представлены результаты исследования термообработки при «деликатных» условиях пониженного давления (вакуум) и температуры очищенного от механических примесей алюмохлорида с содержанием 0,65 масс.% свободной соляной кислоты и 20 масс.% AICI3 с плотностью 1,20 г/см2 при непрерывной отгонке со-
67
лянокислого конденсата с последующей нейтрализацией и непрерывным фазовым разделением, выводом из фазоразделителя-нейтрализатора по мере накопления органических примесей в виде верхнего слоя органической фазы и нижнего слоя в виде 2-5%-ного водного раствора хлорида натрия.
Изучены процессы кристаллизации основных солей хлорида алюминия из очищенного алюмохлорида, установлена их термическая нестабильность и подобраны «деликатные» технологические условия – диапазоны температур и остаточных давлений их вакуум – кристаллизации (рис. 3.8).
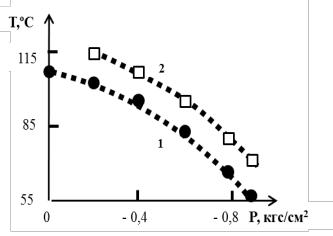
Рис. 3.8. 1 – зависимости температуры кипения кубового раствора алюмохлорида и 2 – температуры начала изотермической вакуумкристаллизации AICI3•6H2O от равновесного остаточного давления (глубина вакуума) газовой фазы
Установлено, что уже при отгоне ϑ(τ) = 25 % конденсата (рис. 3.6, кр. 2; рис. 3.7, кр. 1-5) из алюмохлорида полностью удаляются органические примеси вместе с конденсатом при температуре кипения кубового маточного раствора 72-115ºС под вакуумом при остаточных давлениях от -0,2 до -0,9 кгс/см2 . Показано, что в практическом важном диапазоне удаления конденсата до ϑ(τ) = 70 % в кубовом растворе и осадках-продуктах (см. ниже) отсутствуют органические примеси, в конденсате содержание свободной соляной кислоты достигает значений 1,5-3 масс.%. Установлено, что в фазоразделителе-нейтрализаторе с раствором щелочи происходит обезвреживание свободной соляной кислоты до pH = 6,5 с образованием 2-5%-ного раствора хлорида натрия и происходит фазовое разделение на верхний органический и нижний водный слои. По мере накопления органического и водного слоев из фазоразде- лителя-нейтрализатора непрерывно отводили органический слой и нижний водный.
Методом газовой хроматографии исследован состав органического слоя, представленный в основном бензолом, в малой степени кумолом и примесями толуола, что говорит о возможном рецикле ценного сырья (бензол и кумол) в производство кумола [34].
В диапазоне объёмной доли конденсата 0≤ ϑ(τ)≤25 % происходит отгон конденсата с постоянным градиентом ∆ϑ(τ)/∆Т~1,6%/град в диапазоне значений равновесных остаточных давлений паровой фазы от -0,2 до -0,9 кгс/см2 (рис. 3.6, кр. 2; рис. 3.7, кр. 1-5).
При объёмной доле отгона конденсата ϑ(τ) =25% при любых значениях исследованного диапазона температуры и остаточного давления происходит начало процесса образования кристаллического осадка из маточного раствора с зеленоватым оттенком. При этом температура начала кипения алюмохлорида и температура нача-
68
ла процесса изотермической кристаллизации зависят от равновесного остаточного давления паровой фазы (рис. 3.8, кр. 1 и 2).
В диапазоне отгона солянокислого конденсата ϑ(τ) =25-50% при постоянной температуре (рис. 3.6, кр. 2; рис. 3.7, кр. 1-5) происходит образование или выпадение из раствора кристаллического осадка желтоватого цвета или его изотермическая ва- куум-кристаллизация. Выделенный кристаллический осадок после промывки ацетоном проанализирован на химический состав – содержание алюминия 11,2±0,1%, хлора 44,1±0,1% и кристаллизационной воды 44,7±0,1 масс.% (табл. 3.7). Данный осадок по химическому составу (теоретический расчёт) соответствует брутто-формуле AICI3•6H2O гексагидрата хлорида алюминия. Полученные кристаллы желтоватого цвета гигроскопичны, расплываются на воздухе, хорошо растворимы в воде, выход составляет 30-50% на 1 тонну алюмохлорида с содержанием 17-27% хлорида алюминия (табл. 3.7, опыты 1-3).
Таблица 3.7 Регулируемые технологические условия синтеза функциональных добавок в композиты из
алюмохлорида – отхода кумольного производства фенола
Тип |
Условия отгона конден- |
|
|
|
|
|
||||
|
|
сата |
|
Свойства осадка (кристаллов) |
||||||
функциональ- |
|
|
|
|||||||
|
из алюмохлорида |
|
|
|
|
|
||||
ной |
|
|
|
|
|
|
||||
Т,° |
|
|
|
Объёмная |
Цвет |
Состав, масс, % |
Раство- |
|||
добавки ком- |
|
- Р, |
|
|||||||
С |
|
|
доля |
осадка |
|
|
|
римость |
||
позитов |
|
кгс/см2 |
|
AI2O3 |
CI |
H2O |
||||
|
|
|
|
|
отгона, % |
(раствора) |
|
|
|
в воде |
|
72- |
|
|
|
25 |
жёлто- |
11,1 |
44,1 |
44,7 |
|
|
|
0,2-0,9 |
|
40 |
11,0 |
44,3 |
44,8 |
|
||
AICI3•6H2O |
115 |
|
|
зелёный |
|
|||||
|
|
|
50 |
11,3 |
44,0 |
44,7 |
раство- |
|||
|
|
|
|
|
|
|||||
|
|
|
Состав (AICI3•6H2O) |
11,2 |
44,1 |
44,7 |
||||
|
|
|
рим |
|||||||
Полиоксихло- |
72- |
|
|
|
55 |
белый |
28 |
40 |
|
|
|
|
|
|
|
||||||
риды алюми- |
|
0,2-0,9 |
|
60 |
(жёлт. зел. |
29 |
36 |
Х |
|
|
115 |
|
|
|
|||||||
ния |
|
|
|
70 |
оттенок) |
33 |
30 |
|
|
|
|
|
|
|
|
|
|||||
|
160 |
|
|
|
80 |
|
|
|
|
|
Al(OH)3 |
180 |
|
(1 атм) |
|
90 |
белый |
- |
Х |
Х |
не рас- |
|
200 |
|
|
100 |
|
|
творим |
|||
|
|
|
|
|
|
|
|
|||
AI2O3 |
500 |
|
|
|
- |
|
100 |
|
|
|
Примечание: Х – отсутствует.
При дальнейшем увеличений объёма отгона солянокислого конденсата от ϑ = 55 до 70% (табл. 3.7) происходит изменение цвета маточного раствора и выпадающих из раствора кристаллов от зеленоватого до белого. Выделенные, промытые ацетоном и высушенные при Т = 100ºС белые кристаллы гигроскопичны, на воздухе меняют цвет от белого до зеленоватого, хорошо и полностью растворимы в воде, имеют pH=3,5-5,0 водного раствора. Химический анализ кристаллов, полученных из маточного раствора, в диапазоне отгона конденсата ϑ(τ) =55,60 и 70% (табл. 3.7) по содержанию алюминия (пересчёт на оксид алюминия AI2O3) и хлора показал их переменный состав. При увеличении объёмной доли отгона конденсата от 55 до 70 масс.% в образцах кристаллов возрастает содержание оксида алюминия от 27 до 33 масс.% со средним значением 30,0±3,0 масс.% с уменьшением содержания хлора от 40 до 30 масс.% (табл. 3.7). Этот эффект, связанный с повышением основности с одновремен-
69
ным уменьшением содержания хлора, обусловлен термическим гидролизом гексагидрата хлорида алюминия AICI3•6H2O в растворе [1а, 94-96]. Вещества с таким переменным составом по содержанию оксида алюминия и хлора типичны для полиоксихлорида алюминия с брутто-формулой Alx(OH)yCl3x-y·zH2O (x>1/3, y<3, 2,4≤z≤4,5). Такие соединения относятся к классу бертоллидов [1а]. Полученные из алюмохлорида образцы полиоксихлорида алюминия (ПОХА) проанализированы на химический состав – содержание алюминия (пересчёт на оксид алюминия) и хлора, нерастворимого в воде осадка и микропримесей металлов Fe, Pb, Cd, As, Ni,Cr (табл. 3.8).
Таблица 3.8 Характеристики полученного полиоксихлорида алюминия из отхода – алюмохлорида
и промышленного образца Аква Аурат 30 (Россия)
|
|
Полиоксихлорид алюминия |
Аква Аурат 30 |
|
Показатели |
(сырьё – алюмохлорид) |
(сырьё – порошок |
№ |
|
алюминия) |
|
|
|
||
|
|
Содержание компонентов, масс.%, не более |
|
1 |
Оксид алюминия (Al2O3) |
30,0 ± 3,0 |
30,0 ± 3,0 |
2 |
Хлор |
35,0 ± 5,0 |
35,0 ± 5,0 |
3 |
Железо |
0,03 |
0,04 |
4 |
Свинец |
0,002 |
0,003 |
5 |
Кадмий |
0,002 |
0,001 |
6 |
Мышьяк |
0,0002 |
0,003 |
7 |
Никель |
0,005 |
- |
8 |
Хром |
0,004 |
- |
9 |
Не растворимый в воде осадок |
0,004 |
0,4 |
Физико-химические показатели ПОХА, особенно по содержанию примесей металлов, полученного из алюмохлорида, по техническому уровню не уступают параметрам промышленного образца ПОХА (Флокулянт Аква Аурат 30, Россия), получаемого из чистого дорогостоящего алюминиевого порошка [1а, 94]. В диапазоне отгона конденсата от ϑ = 55 до 70% (табл. 3.7) выход ПОХА составляет 25-45 % на 1 тонну алюмохлорида (табл. 3.7). При исследовании флоккулирующей способности образцов полученного ПОХА из алюмохлорида на модельной системе взвешенная дисперсия бентонитовой глины в воде показала большую эффективность по очистке от взвешенных частиц, чем традиционный коагулянт – сульфат алюминия [1а].
Сушку или термический гидролиз кристаллов AICI3•6H2O для получения ПОХА или собственно ПОХА проводили при Т = 80-160ºС на лабораторной установке циклонной сушки, которая состояла из баллона сжатого воздуха, кварцевой трубки, помещённой в лабораторную печь и соединённой с вертикальным цилиндром из термостойкого стекла. В стеклянный цилиндр сбоку припаяна термопара, соединённая с потенциометром для замера температуры. Нижняя часть имеет съёмный вход, внутри которой вставлена воронка с металлической сеткой для образца навески кристаллов. Вход воронки соединён с выходом кварцевой трубки. К верхней части стеклянной трубки припаян фильтр Шота с выходом для воздуха, но для задержки частиц продукта. Сушку или термический гидролиз гексагидрата хлорида алюминия для получения ПОХА или собственно ПОХА проводили следующим образом. Нагревали с помощью печи кварцевую трубку и подавали небольшой проток воздуха. Нагретый воздух подавали в стеклянную трубку без образца и замеряли температуру. Таким
70
образом, калибровали небольшой проток нагретого воздуха в цилиндре с температурой 80, 100 и 160ºС. После охлаждали установку, на металлическую сетку помещали образец кристаллов и подавали нагретый воздух с необходимой для опыта температурой. Установлено, что при подаче нагретого воздуха с температурой 80-100ºС оптимальным временем получения ПОХА путём термического гидролиза гексагидрата хлорида алюминия или собственно ПОХА составляет 15-25 мин, а для Т= 160ºС достаточно и 2-3 мин. В результате экспериментов на лабораторных установках кристаллизации и термического гидролиза наработано 2 кг образца ПОХА, который представляет собой кристаллический порошок слегка желтоватого оттенка, хорошо растворимый в воде с образованием прозрачного раствора.
Далее при увеличении отгона солянокислого конденсата ϑ(τ) > 70% в выделенном осадке из маточного раствора происходит увеличение доли нерастворимого гидроксида алюминия, и в температурном интервале 160°С < Т < 200ºС при атмосферном давлении образуется не растворимый в воде белый рыхлый осадок гидроксида алюминия, выход которого составляет 10-20% на тонну алюмохлорида (табл. 3.7). При прокаливании гидроксида алюминия при 500°С получен оксид алюминия (табл.
3.7).
Последовательный процесс получения из отхода кумольного производства поликонденсационных мономеров – алюмохлорида функциональных добавок к полимерным композитам на различных этапах удаления солянокислого конденсата (рис. 3.6, кр. 2; рис. 3.7, кр. 1-5; рис. 3.8, кр. 1 и 2; табл. 3.7 и 3.8) основан на термическом гидролизе алюмохлорида AlCl3•mH2O по схеме.
AlCl3•mH2O → AICI3•6H2O↓+(m-6)H2O↑ → Alx(OH)yCl3x-y·zH2O↓+yHCl↑+ |
(3.1) |
|
+ (mx-y-z)H2O↑ → Al(OH)3↓ → AI2O3↓, |
||
|
||
где: m > 6, x > 1/3, y < 3 и 2,4 ≤ z ≤ 4,5. |
|
Таким образом, исследован процесс очистки от механических и органических примесей и переработки алюмохлорида – отхода кумольного производства поликонденсационных мономеров, подобраны оптимальные регулируемые условия получения функциональных добавок различного назначения в полимерные композиты - гексагидрата, полиоксихлоридов и гидроксида и оксида алюминия. Установлено, что регулируя последовательно процесс отгона солянокислого конденсата из очищенного алюмохлорида при «деликатных» условиях пониженного остаточного давления от -0,2 до -0,9 кгс/см2 и температуре 72-115ºС, а также далее последовательно (при атмосферном давлении в интервале температур 160°С < Т < 200ºС и 550ºС) можно получать ряд важных различного назначения функциональных добавок в полимерные композиты – гексагидрат хлорида алюминия, полиоксихлориды алюминия, гидроксид алюминия и оксид алюминия. При этом выделенную органику, хотя и в небольшом количестве, можно возвращать в производство прекурсора (кумола), а нетоксичный 2-5%-ный раствор хлорида натрия отводить на очистные сооружения.
Как отмечалось в гл. 1, «… все получаемые из отхода алюмохлорида функциональные добавки в полимерные композиты очень важны [1а], но среди них особый коммерческий интерес представляют для России полиоксихлориды алюминия…».
В чем же главное преимущество ПОХА с химической точки зрения по сравнению с традиционным коагулянтом – сульфатом алюминия? При гидролизе сульфата алюминия образуются комплексы с небольшими значениями молекулярных масс и
