
РАМАЗАНОВА К.Р
..pdf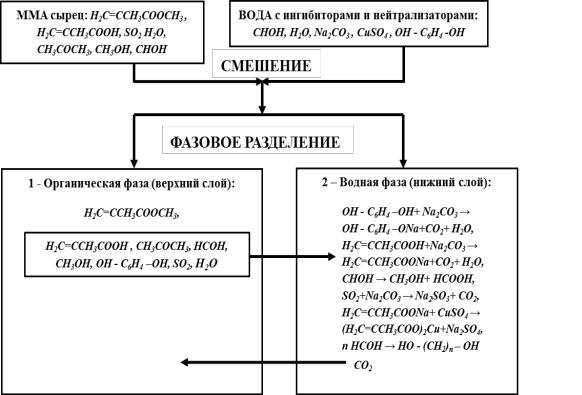
131
В процессе смешения и нейтрализации (рис. 5.2) происходит частичное «вымывание» из органической фазы (фаза 1), или химические связывания в водной фазе (фаза 2) гидрохинона, диоксида серы и МАК в результате реакции с содой; МАК (фаза 2) образуют натриевую соль, способную к полимеризации, но этому процессу препятствует присутствующий в растворе гидрохинолят натрия и сульфат меди, который в системе ведёт себя неоднозначно. Так, при реакциях CuSO4 с сульфитом натрия не исключена возможность получения сульфита одновалентной меди, который распадается на малорастворимый в воде сульфит меди (Cu2SO3), но растворяющийся в присутствии сульфитов щелочных металлов [1а]:
Cu2SO3 + Na2SO3 → 2 CuNaSO3 |
(5.13) |
Вполне вероятно, что смешанная соль (5.13) и проявляет ингибирующую активность. Известно также, что при взаимодействии ацетата меди (II) с сернистым ангидридом также образуется сульфит меди (I) [1а].
В рассматриваемой системе роль ацетата меди (II) вполне может выполнять образующийся метилакрилат меди, так как образовавшийся сульфит одновалентной меди неустойчив и трансформируется в соль Cu2SO3∙CuO, раствор которой имеет фиолетовый цвет, а образующийся метилакрилат меди (рис. 5.2) способен экстрагироваться в эфирный слой; выделяющаяся из водной фазы двуокись углерода поглощается органической частью (фаза 1) гетерофазной системы, также повышая её общую кислотность; в щелочной среде формальдегид претерпевает нецелевые превращения и при рН = 1,9-6,0 полимеризуется, при рН > 7,0 диспропорционирует с образованием метанола и муравьиной кислоты; имеющийся в системе сульфит натрия в этих условиях не реагирует с формальдегидом, т.к. in situ не образуется бисульфит натрия, способный образовывать с ним бисульфитное производное.
132
Рис. 5.2. Физико-химическая модель реакции, массоперенос и распределение компонентов при фазовом разделении гетерогенной реакционной системы при очистке кислотных примесей сырца ММА водным раствором щелочного агента (NaOH, NH4OH), определяющая качество будущего товарного метилметакрилата.
Таким образом, добавление соды в переход апп. 25-26 (рис. 5.1) повышает вероятность полимеризации сырца ММА за счёт вымывания из него части гидрохинона (рис. 5.2). Добавляемый формалин в этих условиях не связывает сернистый ангидрид. Образующиеся в водной фазе производные меди (I) должны оказывать ингибирующее действие на полимеризацию натриевой соли МАК; гидрохинолят натрия (рис. 5.2) также должен проявлять ингибирующую активность.
В аппаратах 26 (рис. 5.1) возможны 2 варианта поведения системы:
-накопление и последующее разделение эмульсии после добавления в неё водного раствора ингибиторов;
-реакционная смесь в апп. 261 (рис. 5.1) постоянно подпитывается уловленной смесью, имеющей рН = 2,8-3,75.
Необходимо отметить, что при обработке сырца ММА содовым раствором из эфирного слоя будет вымываться значительное количество стабилизатора (гидрохинон) и ускоряться полимеризация ММА, ухудшающая гидродинамический режим промывки. В связи с этим представляется актуальным поддержание оптимальной концентрации ингибитора в эфирном слое гетерофазной системы.
В целом анализ потоков (табл. 5.1) в системе очистки сырца ММА, содержа-
щего SO2, показывает, что благоприятные условия должны достигаться при использовании небольшого избытка раствора соды, обеспечивающего некоторый запас «нейтрализующей мощности» системы.
В противном случае система не обеспечит хотя бы эквимольное соотношение реагирующих веществ.
|
Таблица 5.1 |
Баланс* процесса нейтрализации «кислотных» примесей на стадии |
|
очистки сырца метилметакрилата |
|
Приход кислотных примесей, моль-экв. |
Приход нейтрализатора, моль-экв**. |
Метилакриловая кислота – 195,4 |
|
Гидрохинон – 6,4 |
Na2CO3 – 158,4-226,4 |
Сернистый ангидрид – 62,5 |
|
Сумма – 264,3 |
Сумма – 158,4-226,4 |
Примечания: *– расчёт на 1000 кг ММА-сырца; **– в пересчёте на моль-эквивалент NaOH.
Всё вышеизложенное позволило разработать схемы систематического контроля потоков в аппаратах стадий отмывки сырца ММА для проведения экспериментальных исследований в лабораторных условиях моделирования некоторых «критических» операций очистки. Результаты измерений сведены в табл. 5.2.
|
|
|
|
|
|
|
|
|
Таблица 5.2 |
||
|
Содержание сернистого ангидрида в основных аппаратах стадии |
|
|
|
|||||||
|
|
очистки сырца метилметакрилата (масс. %) |
|
|
|
|
|||||
Точка |
|
|
|
Время отбора, сутки |
|
|
|
|
|
||
отбора |
|
|
|
|
|
|
|
|
|
|
|
(рис. 5.1) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
9 |
|
251 |
0,169 |
0,091 |
0,142 |
0,045 |
0,090 |
- |
0,143 |
0,120 |
|
0,069 |
|
133
252 |
0,100 |
0,052 |
0,024 |
10,053 |
0,123 |
- |
0,146 |
0,114 |
0,008 |
253 |
0,144 |
0,113 |
0,138 |
10,049 |
- |
- |
- |
- |
0,113 |
254 |
0,119 |
0,131 |
0,149 |
10,028 |
0,061 |
- |
- |
0,109 |
0,005 |
255 |
- |
- |
- |
0,125 |
0,231 |
- |
0,045 |
0,130 |
0,005 |
262 |
0,048 |
0,048 |
0,035 |
0,009 |
0,108 |
0,064 |
0,016 |
0.054 |
0,046 |
431 |
0,003 |
0,008 |
0,009 |
0,007 |
0,008 |
0,007 |
0,004 |
0,005 |
0,004 |
461 |
0,005 |
0,005 |
0,007 |
0,005 |
0,008 |
0,006 |
0,005 |
0,005 |
0,002 |
702 |
- |
0,004 |
0,007 |
0,004 |
0,003 |
0,007 |
0,004 |
0,004 |
0,004 |
Из табл. 5.2 видно, что в целом остаточное содержание сернистого ангидрида в переходе и аппаратах (рис. 5.1) уверенно снижается в последовательности и С25 > С26, С43 > С46 > С70, где С25, 26, 43, 46, 70 - остаточная концентрация SO2 в аппаратах.
Вто же время качество очистки, оцениваемое по конверсии SО2 в аппаратах стадии очистки различно (табл. 5.3).
Всвязи с этим сделано предположение, что для повышения эффективности стадии очистки необходимо повышение расхода содового раствора и поддержание кислотности в апп. 43 (рис. 5.1) рН ≈ 6,5-7,5. Проведено сравнение содержания сернистого ангидрида в органической фазе и рН водного слоя рассматриваемых аппаратов после внедрения вышеизложенных предложений в производство ММА (табл.
5.4).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5.3 |
|||
|
|
Концентрация (С) и конверсия* (К) SO2 |
в аппаратах стадии очистки сырца ММА |
|
|
|||||||||||||||||||||||||||
|
Время |
|
|
|
|
|
|
|
|
|
Аппараты (рис.5.1) |
|
|
|
|
|
|
|
|
|
|
Общая |
|
|
||||||||
|
отбора |
|
25 |
|
|
|
26 |
|
|
|
43 |
|
|
|
|
|
|
46 |
|
|
|
70 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конверсия, |
|
||||||||||||||
|
проб, |
|
|
|
С, |
|
|
|
С, |
С, |
|
|
К, |
|
С, |
|
|
К, |
|
|
С, |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|||||||||||||||
|
сутки |
|
масс. % |
|
масс.% |
масс.% |
отн.% |
масс.% |
|
отн.% |
масс.% |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
1 |
|
|
0,218-0,244 |
|
- |
|
0,013 |
|
94,0-94,6 |
0,009 |
|
95,9-96,3 |
0,025 |
88,5-89,7 |
|
||||||||||||||||
|
2 |
|
|
0,100-0,169 |
|
0,048 |
|
0,030 |
|
70,0-82,2 |
0,005 |
|
95,0-97,0 |
|
- |
- |
|
|
|
|||||||||||||
|
4 |
|
|
0,024-0,149 |
|
0,035 |
|
0,008 |
|
66,7-94,6 |
0,005 |
|
79,2-96,6 |
0,004 |
85,4-97,6 |
|
||||||||||||||||
|
6 |
|
|
0,079-0,146 |
|
0,016 |
|
0,004 |
|
95,4-97,5 |
0,005 |
|
- |
|
|
0,004 |
95,4-97,5 |
|
||||||||||||||
|
7 |
|
|
0,109-0,130 |
|
0,054 |
|
0,005 |
|
95,1-95,8 |
0,005 |
|
- |
|
|
0,004 |
96,8-97,3 |
|
||||||||||||||
Примечание: * – рассчитывали по формуле К=(С1-С2/С1)·100 отн.%, где С1 – концентрация SO2 |
||||||||||||||||||||||||||||||||
после апп. 25; С2 – концентрация SO2 в органической фазе рассматриваемого аппарата. |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5.4 |
|||
|
|
|
|
Содержание диоксида серы в органической фазе и рН водной фазы |
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
аппаратов стадии очистки сырца метилметакрилата |
|
|
|
|
|
|
|
||||||||||||||||||
|
№ |
|
|
|
|
|
|
|
|
|
|
|
Время отбора проб, сутки |
|
|
|
|
|
|
|
|
|||||||||||
|
апп. |
|
1 |
|
|
|
2 |
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
6 |
|
|
7 |
|
|
|
|||||
|
(рис. |
|
С |
|
рН |
|
С |
|
рН |
|
С |
|
рН |
|
С |
рН |
С |
|
рН |
|
С |
|
|
рН |
С |
|
рН |
|||||
5.1) |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
26 |
|
0,016 |
|
3,8 |
|
0,054 |
|
2,8 |
|
0,046 |
|
4,4 |
|
0,105 |
4,5 |
|
- |
|
2,4 |
|
0,028 |
|
2,5 |
0,037 |
|
5,1 |
|
|||||
43 |
|
0,004 |
|
6,9 |
|
0,005 |
|
6,3 |
|
0,004 |
|
6,6 |
|
0,005 |
7,2 |
|
- |
|
6,4 |
|
0,004 |
|
7,0 |
0,003 |
|
7,0 |
|
|||||
70 |
|
0,004 |
|
5,7 |
|
0,003 |
|
5,0 |
|
0,004 |
|
- |
|
0,002 |
6,7 |
|
- |
|
5,5 |
|
0,003 |
|
5,8 |
0,004 |
|
6,6 |
|
|||||
47 |
|
0,002 |
|
2,3 |
|
- |
|
|
2,1 |
|
- |
|
3,7 |
|
- |
|
- |
|
- |
|
1,8 |
|
- |
|
|
- |
- |
|
- |
|
||
69 |
|
- |
|
3,8 |
|
0,004 |
|
- |
|
0,004 |
|
- |
|
0,002 |
- |
|
- |
|
- |
|
- |
|
|
5,8 |
- |
|
4,3 |
|
||||
Из табл. 5.4 видно, что поддержание рН в апп. 43 в рекомендуемом интервале рН = 6,5-7,5 позволяет стабилизировать процесс очистки от SO2. Контроль параметра
134
может быть легко осуществлен с привлечением аналитической базы производства ММА.
Массоперенос и распределения компонентов-ингибиторов в гетерогенной системе. На следующем этапе экспериментальных исследований в лабораторных условиях уточняли параметры массопереноса и распределения компонентовингибиторов (сульфата меди, гидрохинона) промывочного раствора между водной и органической фазами гетерогенной системы. Оценивали концентрации ингибиторов, прежде всего, в водной фазе после моделирования процесса смешения сырца ММА, поступающего в апп. 26 (рис. 5.1). Варьировали параметрами: концентрация содового раствора С = 6, 8, 9 и 10 масс.% и время перемешивания τ = 1- 8 мин. Результаты исследований приведены в табл. 5.5 и 5.6.
Из табл. 5.5 видно, что при фиксированной концентрации карбоната натрия 6 масс.% длительность перемешивания в течение от 1 до 8 мин не влияет на вымываемость гидрохинона (0,019 масс.%) из органической фазы. С ростом концентрации соды от 6 до 10 масс.% в промывочной жидкости и при наличии в ней сульфата меди 0,12 масс.% этот показатель существенно повышается от 0,019 до 0,39 масс.% (табл.
5.6).
|
|
|
|
|
|
Таблица 5.5 |
|
|
Концентрация гидрохинона в водной фазе модельной системы |
|
|
||||
Со*, |
|
|
Время перемешивания, мин. |
|
|
||
масс. % |
|
1 |
2 |
4 |
|
8 |
|
6 |
|
0,019 |
0,019 |
0,019 |
|
0,019 |
|
Примечание: *Со – концентрация гидрохинона в органической фазе 0,079 масс.%.
Таблица 5.6 Изменение концентрации гидрохинона в водной фазе модельной системы в зависимости от со-
держания в ней кальцинированной соды
Время перемешивания, |
|
Со, масс. % |
|
|
|
мин. |
6 |
8 |
|
9 |
10 |
6 |
0,019 |
0,39 |
|
0,39 |
0,39 |
Интересные и практически важные результаты получены при оценке содержания медного купороса в рассматриваемой модельной системе. Так, при начальной концентрации сульфата меди в исходном водном растворе 0,77 масс.%, через 4 мин после смешения сырца ММА его концентрация снижается до 0,12 масс.%, вероятно, за счёт экстракции в органическую фазу. Это подтверждает ранее высказанное предположение о возможном механизме его ингибирующего действия.
Таким образом, при моделировании процесса очистки сырца ММА экспериментально подтверждено перераспределение компонентов раствора ингибиторов между водной и органической фазами гетерогенной системы. Поэтому для устранения причин, приводящих к повышению кислотности товарного ММА, целесообразна дозированная подача 8%-ного водного раствора соды в количестве, обеспечивающем связывание всего количества «кислотных» примесей в сырце метилметакрилата, поступающего из апп. 26 (рис. 5.1). Расчёт количества соды производится исходя из результатов анализа содержания SO2 и метакриловой кислоты в сырце ММА, а также контроля рН водных фаз в апп. 43, 46 и 70 (рис. 5.1). При попадании в апп. 26 так называемого кислого «улова» или кислой водной фазы вместе с сырцом ММА из
135
апп. 25 и подаче раствора соды при выходе из апп. 26 (рис. 5.1) протекают следующие химические процессы (рис. 5.3).
NaO-C6H4-ONa + H2SO4 → HO-C6H4-OH + Na2SO4 |
(5.14) |
H2C=C(CH3)-COONa + H2SO4 → H2C=C(CH3)-COOH + Na2SO4 |
(5.15) |
(H2C=C(CH3)-COO)2Cu + H2SO4 → 2H2C=C(CH3)-COOH + CuSO4 |
(5.16) |
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O |
(5.17) |
Na2CO3 + H2SO4 → Na2SO4 + SO2 + H2O |
(5.18) |
Рис. 5.3. Модель химических процессов, протекающих в водной фазе аппарата 261 |
при по- |
ступлении в него кислого «улова» с рН < 4 |
|
Оптимальное значение рН водных фаз должно находиться на уровне в аппаратах: рН = 6,8-7.2 (43 апп.); рН = 6.65-6,75 (70 апп.). Вымывание части ингибитора (гидрохинона) из сырца ММА содой, подаваемой совместно с ним и формалином в общий коллектор апп. 251-5, должна быть компенсирована его дополнительной подачей в апп. 41-43 (рис. 5.1). При невозможности реализации этого предложения по техническим причинам, дозирование в переход из апп. 251-5 в 261-2 водного раствора соды (30 л) должно быть прекращено и перенаправлено на всасывающий насос 28 (рис. 5.1).
В связи с обнаруженной вымываемостью гидрохинона из эфирного слоя раствором соды целесообразно подача в переход из апп. 25 в 261-2 (рис. 5.1) раствора в метаноле или товарном ММА смеси гидрохинона и гидрофобного тиодифенила сульфида (фенотиазин, массовое соотношение фенотиазин: гидрохинон = 1:1). При этом фенотиазин не вымывается водой из органической фазы системы и дополнительно стабилизирует промытый метилметакрилат.
.1.2. Промышленная установка нейтрализации сырца метилметакрилата аммиачным раствором
Применяемый в промышленности метод очистки или нейтрализации кислотных примесей сырца ММА содовым раствором (рис. 5.1-5.3) имеет ряд недостатков и на практике приводит к ряду негативных последствий. Выделение углекислого газа способствует эмульгированию ММА, происходит загрязнение сернокислотного маточника сульфатом натрия, содержащегося в отработанном содовом растворе, а отсутствие контроля pH процесса [1а, 45] приводит к получению некондиционного ММА по кислотным примесям, перещелачиванию с образованием трудно разрушаемой эмульсии эфира между органической и водной фазами, дисперсии полимера формальдегида (рис. 5.2).
Поэтому разработка «бессульфатной» технологии нейтрализации кислотных примесей сырца ММА для стабилизации и повышения качества мономера и исключения одного из источников попадания сульфата натрия в сернокислотный маточник является практической важной актуальной задачей.
Данный раздел посвящён разработке «бессульфатной» технологии и установки нейтрализации кислотных примесей сырца метилметакрилата [212а, 213а, 229а, 231а,
232а].
В аналитическом контроле промышленной технологии синтеза (мет)акриловых мономеров содержания кислотных примесей на стадии очистки их сырца [1а, 45, 46] принят термин «кислотность», которая является интегральным показателем с перечё-

136
том на метакриловую кислоту и включает в себя все известные идентифицированные и неидентифицированные примеси органической и неорганической природы кислотного характера, включая и метакриловую кислоту, кроме диоксида серы, содержание которого контролируют отдельно. Поэтому в эфирном слое после нейтрализации аммиачным раствором и фазового разделения контролировали кислотность, содержание диоксида серы, органических примесей, ингибиторов, наличие полимера по аттестованным методикам технологического регламента производства ММА [1а, 45].
Для лабораторных исследований процесса нейтрализации аммиачным раствором концентрации 1,5-10 масс.% без и с содержанием медного купороса 0,06-0,12 масс.% использованы производственная проба сырца ММА с начальной кислотностью Кн = 2,24 масс.% и содержанием диоксида серы 0,1 масс.% и искусственная с кислотностью 1,09 масс.%, приготовленная из производственной пробы разбавлением товарным ММА (рис. 5.4). После нейтрализации проб сырца ММА аммиачным раствором и фазового разделения в эфирном слое для каждого дискретного значения pH анализировали текущее значение кислотности.
На рис. 5.4 приведена зависимость текущего значения кислотности эфирного слоя К от pH при нейтрализации до дискретных значений pH = 4; 5; 6; 6,5; 7 и 8 постоянного объёма V0 = 30 мл сырца ММА при перемешивании аммиачным раствором концентрации 2,5 и 5 масс.%, содержащим медный купорос 0-0,8 масс.%.
а |
б |
Рис. 5.4. а – зависимости текущего значения кислотности эфирного слоя K от рН при нейтрализации сырца метилметакрилата с начальной кислотностью 2,24 масс.% (1) и 1,09 масс.% (2) аммиачным раствором концентрации 2,5-5,0 масс.%; б – кривые нейтрализации сырца метилметакрилата с начальной кислотностью 2,24 масс.% (1, 2) и 1,09 масс.% (3,4) аммиачным раствором концентрации 2,5 масс.% (1,3) и 5 масс.% (2,4), где в опытах а и б объём пробы сырца метилметакрилата V0 = 30 мл, V – объём аммиачного раствора с содержанием медного купороса: ○ - 0 масс.%; ● - 0,8 масс.%.
На рис. 5.4 в области pH = 2-5 кислотность изменяется незначительно, в области pH = 5-7 уменьшается с точкой «перегиба» в диапазоне pH = 6-7.
Установлено, что медный купорос хорошо растворяется в аммиачном растворе с образованием известных комплексных соединений и при хранении не образует осадка (в содовом растворе при хранении выделяется оксид меди) [1а], и его
137
содержание 0,06-0,12 масс.% в аммиачном растворе не влияет на процесс нейтрализации кислотных примесей (рис. 5.4). Наблюдения показали, что в области pH < 7 происходит быстрое и чёткое фазовое разделение на эфирный и водный слои; при pH = 7 образуется эмульсия мономера, которая разрушается в течение более суток; при pH > 7 образуется устойчивая и трудно разрушаемая межфазная эмульсия эфира между мутным эфирным и водным слоями, которая окрашена в темнокоричневый цвет, обусловленный окислением гидрохинона в хинон в сильнощелочной среде [1а].
Установлено, что при интенсивном перемешивании смеси реактантов со скоростью более 200 об/мин эмульсия эфира и межфазная эмульсия не образуются в области pH ≤ 7. Величина pH = 6,7 является предельной (рис. 5.4, а) для обеспечения чёткого и быстрого фазового разделения эфирного и водного слоя и конечной кислотности эфирного слоя Ккон. = 0,6 масс.% Обработкой кривых потенциометрического титрования аммиачным раствором проб объёмом V0=30 мл сырца метилметакрилата различной начальной кислотности (рис. 5.4, а и б) найдена функциональная связь между объёмом V (мл) и концентрацией аммиачного раствора С = 2,5-5 масс.% и значениями начальной Кнач. и конечной Ккон. = 0,6% масс кислотности эфирного слоя для pH = 6,7 (5.1) и получено выражение между расходом аммиачного раствора υА (м3/ч) и расходом сырца ММА υММА (м3/ч).
V = ( Кнач.- Ккон.)/0,164•С |
(5.1) |
υА/υММА = ( Кнач.- Ккон.)/4,92•С |
(5.2) |
Соотношение (5.2) позволяет при различных нагрузках сырца ММА υММА (м3/ч) оценить расход аммиачного раствора заданной концентрации на нейтрализацию или расход уже отработанного аммиачного раствора после фазового разделения, поступающего на стадию синтеза ММА [1а, 45]. При этом величина соотношения расхода щелочного агента (не более 1 м3/ч) к расходу сырца ММА должна быть в пределах υА/υММА = (1:7)-10 [1а, 45] для обеспечения оптимального содержания воды вместе с отработанным аммиачным раствором на стадии синтеза метилметакрилата и производительности промышленной установки [45].
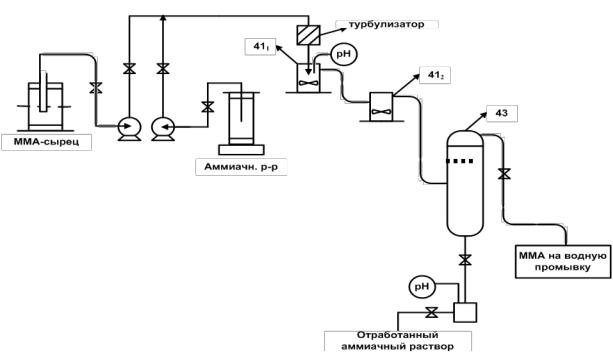
Для экспериментального моделирования промышленных условий очистки сырца ММА от кислотных примесей на основе соотношения (5.2) рассчитаны расходы компонентов и геометрические параметры оборудования разработанной лабораторной установки непрерывной нейтрализации (рис. 5.5) или на фотографии (рис. 5.6). Для эффективного молекулярного контакта целевых компонентов при смешении потока сырца ММА и щелочного агента после дозировочных насосов (рис. 5.5) использован смеситель – турбулизатор запатентованной конструкции [232а].
138
Рис. 5.5. Блок-схема лабораторной установки (стекло) непрерывной нейтрализации сырца ММА щелочным агентом: 411,2 – ячейки с магнитной мешалкой; 43 – фазоразделитель эфирного и водного слоя
Результаты очистки сырца ММА в непрерывном режиме нейтрализацией сырца ММА аммиачным раствором различной концентрации С(масс. %) на лабораторной установке (рис. 5.5) с непрерывным контролем pH смеси сырца метилметакрилата и аммиачного раствора перед фазовым разделением приведены в табл. 5.7.

139
Рис. 5.6. Лабораторная установка непрерывного действия очистки кислотных примесей сырца ММА нейтрализующим агентом
Таблица 5.7 Очистка сырца метилметакрилата от кислотных примесей аммиачным раствором в
непрерывном режиме на лабораторной установке
|
Сырец ММА |
|
Аммиачный раствор |
|
Эфирный слой, |
|||||
№ оп. |
υММА, |
масс.% |
υА, |
масс.% |
pH |
масс, % |
||||
|
мл/мин |
Кн |
|
SO2 |
мл/мин |
NH4OH |
CuSO4 |
|
Кк |
SO2 |
1 |
10 |
2,4 |
|
0,07 |
1,0 |
2,0 |
0,12 |
6,0 |
0,8 |
0,002 |
2 |
10 |
2,4 |
|
0,10 |
1,0 |
2,5 |
0,06 |
6,5 |
0,7 |
0,002 |
3 |
10 |
2,2 |
|
0,09 |
1,0 |
3,0 |
0,08 |
6,4 |
0,8 |
0,003 |
4 |
10 |
2,0 |
|
0,08 |
1,0 |
5,0 |
0,12 |
6,7 |
0,5 |
0,004 |
5 |
10 |
2,2 |
|
0,07 |
1,0 |
4,0 |
0,08 |
6,7 |
0,6 |
0,004 |
6 |
10 |
2,4 |
|
0,10 |
1,2 |
1,5 |
0,08 |
7,0 |
0,2 |
0,005 |
7 |
10 |
2,3 |
|
0,08 |
1,2 |
1,0 |
0,08 |
7,0 |
0,5 |
0,005 |
В диапазоне 6,0 ≤ pH ≤ 7,0 происходит чёткое фазовое разделение на отработанный водный и эфирный слои с кислотностью не более 0,8 масс.% и содержанием диоксида серы не более 0,005 масс.% в пределах регламентных норм [45] при нейтрализации сырца ММА аммиачным раствором концентрации 1-5 масс.% и 0,06- 0,12 масс.% медного купороса (табл. 5.7). На основании полученных результатов разработаны Исходные данные проектирования и промышленная установка очистки
140
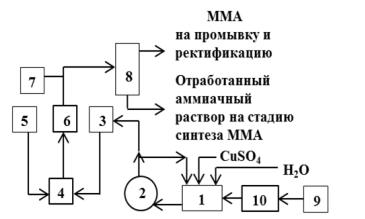
кислотных примесей сырца ММА аммиачным раствором [232а], технологическая схема которой приведена на рис. 5.7.
Рис. 5.7.Технологическая блоксхема промышленной установки непрерывного процесса очистки кислотных примесей метилметакрилата аммиачным раствором (Патент РФ № 2443675, 17.08.2010): 1 и 9 – ёмкости аммиачного раствора; 2,4 и 10 – насосы; 3 и 5 – напорные ёмкости; 6 – смеситель-турбулизатор; 7 – рН – метр и 8 – фазоразделитель [232а]
Применение смесителя-турбулизатора 6 (рис. 5.7) для очистки кислотных примесей ММА позволило упростить аппаратурное оформление, исключить из действующей технологической схемы [21] (рис. 5.1) две ёмкости с перемешивающим устройством и два фазоразделителя, улучшить условия труда обслуживающего персонала, устранить трудоёмкую ручную операцию загрузки порошка соды и автоматизировать процесс приготовления рабочего аммиачного раствора и процесса нейтрализации со щита КИПиА, предотвратить эмульгирование эфирного слоя и образования межфазной эмульсии ММА. На рис. 5.8 приведена запатентованная конструкция промышленного образца смесителя-турбулизатора [232а], а результаты очистки сырца метилметакрилата от кислотных примесей аммиачным раствором на промышленной установке (рис. 5.7) с использованием смесителя-турбулизатора (рис. 5.8) приведены в табл. 5.8.
В табл. 5.8 для сравнения приведены результаты очистки или нейтрализации сырца ММА содовым раствором (пример 1) в промышленных условиях [45], где не проводится контроль pH при смешении потоков.
При почти одинаковой нагрузке сырца ММА 7,9-8,2 м3/ч (примеры № 2, № 9- 12, табл. 5.8) расход аммиачного раствора зависит от его концентрации и с уменьшением концентрации до 0,01 масс.% увеличивается до 1,5 м3/ч (пример 9) или превышает требования регламента [45] по объёму отработанного аммиачного раствора. При концентрации аммиачного раствора 5-10 масс.% (примеры 11 и 12) для нейтрализации требуется очень малое количество аммиачного раствора 0,10-0,15 м3/ч к большому объёму сырца ММА 8 м3/ч (примеры 11 и 12), что приводит к превышению величины конечной кислотности эфирного слоя 1,1-1,2 масс.% норм регламента не более 0,8 масс. % [45]. Концентрация аммиачного раствора 1-2 масс.% с содержанием медного купороса 0,06-0,12 масс.% (примеры 2-9, табл. 5.8) является оптимальным для нейтрализации кислотных примесей до регламентных значений [45] и особенно диоксида серы до отсутствия в диапазоне рН = 5,5-6,7, что практически недостижимо при нейтрализации содовым раствором [45]. Для указанного диапазона концентрации аммиачного раствора при нагрузке сырца ММА 4,1-8,2 м3/ч расход аммиачного раствора составляет 0,3-0,41 м3/ч (примеры 2-9) и не превышает требования регламента [45] по объёму отработанного аммиачного, подаваемого на стадию синтеза ММА.
