
РАМАЗАНОВА К.Р
..pdf121
3 масс.% кумол и 1 масс.% АЦФ в ацетоне при изотермическом режиме на экспериментальной установке (рис. 4.10)
|
|
|
Состав реакционной массы разложения, масс.% |
||||||
№ |
VА:VТГ |
Тип |
Ацетон |
Фенол |
АМС |
Кумол |
АЦФ |
|
|
катализатора |
О |
||||||||
оп. |
|
||||||||
|
|
2 |
|||||||
|
на МСМ-41 |
Н |
|||||||
|
|
||||||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
1 |
5:1 |
10 масс.% |
86,4 |
11,4 |
1,2 |
0,6 |
0,2 |
0,2 |
|
|
|
Н3РW12О40 |
|
|
|
|
|
|
|
2 |
2:1 |
74,0 |
21,7 |
2,3 |
1,2 |
0,4 |
0,4 |
||
3 |
11:1 |
20 масс.% |
93,1 |
5,8 |
0,6 |
0,3 |
0,1 |
0,1 |
|
Н3РW12О40 |
|||||||||
|
|
|
|
|
|
|
|
||
4 |
4:1 |
50 масс.% |
82,8 |
14,2 |
1,6 |
0,8 |
0,3 |
0,3 |
|
Н3РW12О40 |
|||||||||
|
|
|
|
|
|
|
|
||
5 |
11:1 |
20 масс.% |
93,1 |
5,8 |
0,6 |
0,3 |
0,1 |
0,1 |
|
Cs2.5Н0.5РW12О40 |
|||||||||
|
|
|
|
|
|
|
|
||
6 |
5:1 |
10 масс.% |
86,4 |
11,4 |
1,2 |
0,6 |
0,2 |
0,2 |
|
Cs2.5Н0.5РW12О40 |
|||||||||
|
|
|
|
|
|
|
|
||
Нами для исследования выбран промышленный образец технического ГПК состава 89 масс.% ГПК, 7 масс.% ДМФК, 3 масс.% кумол и 1 масс.% АЦФ, а в качестве катализатора разложения – синтезированные нами гетерогенные катализаторы (табл. 4.4), которыми последовательно заполняли реакционную часть колонн 1 и 2 (рис. 4.10). При подаче на вход колонны 1 смесь ацетона и технического ГПК через металлическую сетку равномерно распределяется на поверхности слоя и далее в слое катализатора, при этом ацетон дополнительно обеспечивает орошение слоя катализатора. По мере движения вниз в слое катализатора колонны 1 при температуре кипения ацетона 56°С ГПК разлагается со 100%-ной конверсией и 100%-ной селективностью на фенол и ацетон (табл. 4.5).
Из кубовой части колонны 1 нагретые восходящие пары ацетона проходят через слой катализатора реакционной секции и конденсируются в дефлегматоре 3, конденсат ацетона поступает в сборник 5, из которого часть конденсата с новой порцией технического ГПК поступает на вход колонны 1. Для поддержания допустимого уровня кубовой жидкости в колонне 1 постоянно насосом 8 часть кубовой жидкости подают в колонну 2, которая через металлическую сетку равномерно распределяется на поверхности слоя катализатора и далее в катализаторе.
По мере продвижения вниз в слое катализатора при температуре кипения ацетона 56°С происходит дегидратация ДМФК со 100 %-ной конверсией в α- метилстирол (табл. 4.5). Из кубовой части колонны 2 нагретые восходящие пары ацетона проходят через слой катализатора реакционной секции, достигают верха колонны 2, поступают в дефлегматор 4 и конденсируются. Часть конденсата ацетона с дефлегматора 4 возвращается в колонну 2 для орошения, а другая часть поступает в сборник 5. После дегидратации ДМФК в слое катализатора жидкая фаза – фенол, α- метилстирол, кумол и АЦФ в ацетоне стекает вниз из слоя катализатора в кубовую часть колонны 2. Для поддержания необходимого уровня кубовой жидкости колонны 2 часть кубовой жидкости или реакционную массу разложения, содержащую фенол, ацетон, α-метилстирол, кумол и АЦФ насосом 9 постоянно отводят на стадию ректификации.
122
Очень важный момент синтеза фенола, ацетона и α-метилстирола каталитической дистилляции разложением технического ГПК на синтезированных гетерогенных катализаторах. После разложения ГПК жидкая фаза – фенол, ДМФК, кумол и АЦФ в ацетоне стекает вниз из слоя катализатора в кубовую часть колонны 1, а после дегидратации ДМФК в слое катализатора жидкая фаза – фенол, α-метилстирол, кумол и АЦФ в ацетоне стекает вниз из слоя катализатора в кубовую часть колонны 2. В слое катализатора стекающая вниз жидкая фаза, содержащая ацетон, соприкасается с восходящими парами ацетона из кубовой части колонн 1 и 2 и непрерывно очищает катализатор от продукта реакции – фенола, а также от других примесей технического ГПК. На катализаторе концентрация фенола в жидкой фазе находится на чрезвычайно низком уровне из-за орошения ацетоном, а также образования ацетона при разложении ГПК, восходящего потока паров ацетона и стекания с катализатора жидкой фазы, содержащий фенол, что нивелирует дезактивацию катализатора фенолом [142-144] и другими примесями технического ГПК и обеспечивает продолжительную активность или «пробег» катализатора в колонне 1 и 2.
После колонны 2 компонентный состав реакционной массы разложения определяют газохроматографическим методом на капиллярной колонке, а количественное содержание влаги после дегидратации ДМФК определяют методом Фишера. В табл. 4.5 приведены результаты синтеза фенола, ацетона и α-метилстирола их каталитической дистилляции путём разложения технического ГПК, содержащего ДМФК, на синтезированных гетерогенных катализаторах (табл. 4.4). Установлено, что при увеличении содержания технического ГПК выше VА:VТГ = 2:1 приводит к увеличению теплового эффекта реакции разложения ГПК в колонне 1 (рис. 4.10), поэтому ограничились соотношением VА:VТГ = 2:1 (табл. 4.5).
В табл. 4.5 компонентный состав РМР технического ГПК после колонны 2 (рис. 4.10) проанализирован на капиллярной колонке высокого разрешения компьютерного газохроматографического комплекса с использованием для калибровки стандартов фирм Merk и Lankaster (табл. 2.3, раздел 2.2). Установлено, что кроме ацетона, фенола, α-метилстирола и примесей (кумол и АЦФ) технического ГПК других органических продуктов и примесей не обнаружено. В процессе каталитической дистилляции при изотермическом режиме кипения ацетона в двух колоннах со слоем синтезированных гетерогенных катализаторах происходит разложение технического ГПК, содержащего до 7 масс.% ДМФК, со 100 %-ной селективностью и 100 %-ной конверсией только на фенол, ацетон и α-метилстирол с образованием РМР, содержащая легкоразделяемые продукты (табл. 4.5). Из-за «моющего эффекта» парами и жидким ацетоном слоя гетерогенных катализаторов (табл. 4.5) от примесей кумола и АЦФ технического ГПК, особенно фенола-дезактиватора [142-144] и их фракционирования в процессе каталитической дистилляции за время испытаний в течение 720 ч не отмечено признаков дезактивации синтезированных гетерогенных катализаторов (табл. 4.4). После разложения технического ГПК кубовая жидкость колонны 2 или реакционная масса разложения, содержащая фенол, ацетон, α-метилстирол, кумол и АЦФ, легко разделяется на стадии ректификации. Органического отхода – фенольной смолы и сточных вод не образуется. Выделяемый на стадии ректификации АЦФ является дополнительно полезным и востребованным продуктом на рынке парфюмерной промышленности, а кумол необходим для синтеза технического ГПК [1а, 2736].
123
4.4.Выводы по главе 4
1.Разработана математическая модель алкилатора получения кумола, которая предсказывает максимальные выходы кумола для толстого слоя катализатора с увеличением температуры, однако увеличение температуры выше 200ºС приводит и к быстрому «старению» и дезактивации катализатора. Для реальных практических условий синтеза кумола алкилированием бензола пропиленом на гетерогенных цеолитсодержащих катализаторах наиболее приемлемым температурным диапазоном эксплуатации является Т = 140-1 0ºС для алкилатора с геометрическими параметра-
ми 1 ≤ h/2R0 ≤ 10. Предсказанный математической моделью оптимальный температурный режим 140-180°С подтверждён максимальным выходом 26-30 масс.% и чистотой полученного прекурсора (кумола) на экспериментальной установке и согласуются с результатами работы промышленного каталитического дистиллятора фир-
мы Lummus Global.
2.Результаты математической модели – геометрические параметры и технологический режим процесса алкилирования бензола пропиленом использованы для создания экспериментальной установки каталитической дистилляции, использующий экзотермический эффект алкилирования в процессе синтеза кумола. Впервые в России синтезирован кумол высокой чистоты 99,98% со 100%-ной конверсией пропилена на гетерогенном цеолитсодержащем катализаторе. Разработаны, изготовлены и испытаны экспериментальные установки каталитической дистилляции кумола алкилированием бензола пропиленом, а также поликонденсационных мономеров (фенола
иацетона) и α-метилстирола, которые являются основой для модернизации действующего производства кумола на каталитическом комплексе хлорида алюминия и производства фенола и ацетона на серной кислоте в качестве гомогенных катализаторов.
4.Все синтезированные гетерогенные катализаторы со 100 %-ной конверсией
и100 %-ной селективностью разлагают ГПК только на фенол и ацетон, ДМФК на α- метилстирол и воду количественно. Однако процесс разложения модельного образца ГПК или ДМФК имеет одностадийный характер, а модельной смеси ГПК+ДМФК и технического ГПК, содержащего ДМФК, имеет последовательный двухстадийный характер. Разработаны непрерывные процессы и установки каталитической дистилляции синтеза прекурсора (кумола), поликонденсационных мономеров (фенола и ацетона) и α-метилстирола в изотермических условиях на высокоселективных и активных гетерогенных катализаторах, использующих энергетику реакции алкилирования и разложения ГПК, без образования побочных продуктов, отходов и сточных вод, с минимальным числом рециклов и простотой аппаратурного оформления. Эти процессы соответствуют самым высоким требованиям экологической и технической безопасности, менее чувствительны к влиянию человеческого фактора, имеют экономический и экологический эффект и являются перспективными направлениями создания в России безотходного кумольного процесса синтеза поликонденсационных мономеров.

124
Глава . ФИЗИКО-ХИМИЧЕСКИЕ И ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ НЕЙТРАЛИЗАЦИИ КИСЛОТНЫХ ПРИМЕСЕЙ (МЕТ)АКРИЛОВЫХ МОНОМЕРОВ И ПОЛУЧЕНИЯ ПОЛИМЕРНОГО ПЛАСТИФИКАТОРА ИЗ СЕРНОКИСЛОТНЫХ МАТОЧНИКОВ ИХ ПРОИЗВОДСТВА
К базовым (мет)акриловым мономерам относится метилметакрилат (ММА)
СН2=С(СН3)СООСН3, |
(5.1) |
из которого получают в крупнотоннажном производстве термопластичный линейный полиметилметакрилат
[-СН2С(СН3)(СООСН3)-]n, |
(5.2) |
– сырье для синтеза, например, плексигласа, различного рода пленок и т.д. Сам же мономер (5.1) нашёл широкое применение в качестве добавок к печатным краскам и пастам, как компонент лаков и пр.
Метилакрилат (МА)
СН2=СНСООСН3, |
(5.3) |
используется в производстве органического стекла, пластических бинтов и пластырей, в электротехнической промышленности, для пропитки тканей, склеивания кар-
125
тона, фанеры, тканей и т.п.; для сополимеризации с другими мономерами и при получении полиметилакрилата
(-CH2-CН(COOСН3)-)n |
(5.4) |
– прозрачного, стойкого к нагреванию и действию УФ-света полимера. Из него изготовляют листы прочного и легкого органического стекла, а также прекурсоры при синтезе различных крупнотоннажных полимеров и на основе их композитов (см. подробно в главе 1 и аналитическом обзоре [1а]).
Впромышленности на основе ацетона кумольного процесса [1а, 2736, 74-77], рассмотренного нами в главах 3 и 4, через ацетонциангидрин по сернокислотной технологии [1а, 9, 30, 31, 45, 150-152] получают ММА, на долю которого приходится более 95% мирового производства [1а], МА из нитрила акриловой кислоты [1а, 9, 46], что сопряжено со многими проблемами.
Всреде серной кислоты, кроме основной реакции получения целевого продукта – (мет)акриловых мономеров, протекают и побочные, приводящие к образованию множества новых органических и неорганических примесей, которые в виде кислотных примесей входят в состав (мет)акриловых мономеров или концентрируются в сернокислотных отходах или сернокислотном маточнике – основном отходе их производства.
Важной стадией сернокислотного процесса синтеза полимеризационных мономеров является стадия нейтрализации, от эффективности которой зависит качество (мет)акриловых мономеров. В условиях непрерывного производства одной из актуальных проблем является обеспечение стабильного качества товарного ММА требованиям ГОСТ 20370-74 по содержанию кислотных примесей (муравьиная, уксусная и др., метакриловая кислота, диоксид серы, сульфированные органические примеси кислотного характера и др.), состав и концентрация которых зависят от технологического режима. Попадание кислотных примесей в товарный продукт, особенно метакриловой кислоты и диоксида серы, выше нормы существенно снижает стабильность ММА к полимеризации, требует увеличения дозы ингибитора при транспортировке и энергетических затрат на переработку на месте производства или потребления. Одной из причин нестабильности качества товарного (мет)акрилового мономера по содержанию кислотных примесей, могут быть и возникающие осложнения при их нейтрализации, обусловленые тем, что априори неизвестны химическая природа, состав, концентрация некоторых кислотных примесей и отсутствует инструментальный метод контроля pH процесса на узле нейтрализации действующего производства ММА [1а, 45].
Процесс нейтрализации кислотных примесей сырца ММА связан: с трудоёмкостью приготовления раствора соды (ручная загрузка соды); неэффективным режимом смешения сырца ММА и содового раствора; отсутствием контроля рН нейтрализации; перерасходом соды, перещелачиванием, образованием трудноразделимой межфазной эмульсии эфир-вода; высоким содержанием кислотных примесей и низкой степенью чистоты (мет)акриловых мономеров; загрязнением сульфатом натрия сернокислотного маточника.
Поэтому, с одной стороны, актуальной технологической задачей является разработка физико-химических основ и процессов, протекающих при фазовом разделе-
126
нии и очистке сырца (мет)акриловых мономеров от кислотных примесей раствором соды с практическими рекомендациями по устранению причин повышения кислотности для стабилизации качества выпускаемого ММА, а с другой стороны - разработка научных и физико-химических основ «бессульфатного» процесса, проведения исследований по замене содового раствора на аммиачный раствор, разработка технологии нейтрализации кислотных примесей с повышением качества или чистоты ММА по содержанию основного вещества без диоксида серы, создание промышленной установки с внедрением в действующее производство ММА.
Бесперебойное обеспечение производства полимеров и их композитов мономерами требует для (мет)акрилатного комплекса постоянного совершенствования технологического процесса переработки сернокислотного маточника, поиска новых направлений и внедрения передовых технологий.
До сих пор основное внимание исследователей было уделено термическому разложению разбавленных растворов сернокислотного маточника с повышенным содержанием воды и приблизительным составом регламентных значений органических примесей с целью регенерации серной кислоты, которые вообще-то предназначены для переработки в сульфат аммония. В литературе не уделено внимания исследованию качественного и количественного многокомпонентного состава, природы органических примесей, зольности (содержания в нем металлов) концентрированного сернокислотного маточника (мет)акриловых мономеров, хотя и для разбавленных растворов сернокислотного маточника имеются недостаточные сведения и отсутствует системный анализ примесей. В России, несмотря на многочисленные теоретические и экспериментальные разработки, подробно рассмотренные нами в обзоре [1а] для предприятий нефтепереработки и нефтехимии, основанных на сернокислотных процессах, так и не созданы отечественная технология и промышленная установка регенерации серной кислоты из отработанных сернокислотных отходов. Поэтому исследования физико-химических свойств, органического и неорганического состава, природы органических примесей концентрированного сернокислотного маточника являются актуальной проблемой для обоснованного выбора направления переработки.
В России единственным методом является переработка растворов сернокислотного маточника (мет)акриловых мономеров в сульфат аммония. Проблемой действующей технологии [1а, 97, 98] является получение низкого качества сульфата аммония по внешнему виду из-за загрязнений органическими примесями и фракционному составу со значительным содержанием мелких фракций, склонных к слёживанию при хранении, хотя известны методы укрупнения кристаллов при нейтрализации и процессе кристаллизации под действием ионов металлов, к примеру, иона алюминия [1а]. К тому же, надо учитывать переход органических примесей в процессе переработки из жидкого в твёрдое взвешенное состояние, малое время пребывания насыщенного раствора в кристаллоприёмнике, что явно недостаточно для роста и выхода крупных кристаллов, измельчение их в циркулирующем растворе, забивка ими и взвешенными примесями оборудования. Поэтому выявление причин образования мелких кристаллов и перехода органических примесей в твёрдое состояние, положительного влияния иона алюминия на укрупнения кристаллов на стадии нейтрализации и кристаллизации, установление оптимальных технологических критериев переработки, разработка научно-практических рекомендаций их устранения,
127
подтверждения их проведением опытно-промышленных испытаний являются актуальной технологической задачей.
Главной проблемой действующей технологии переработки сернокислотного маточника в сульфат аммония [1а, 97] является малый период производственного цикла (2-3 суток) из-за накопления в циркулирующем насыщенном растворе растворенных органических примесей от 2-3 до 24 масс.% с повышением его вязкости от 0,075 до 1,1 мм2/с, что снижает коэффициент диффузии сульфата аммония к поверхности растущего кристалла с получением к концу производственного цикла мелких и тёмных кристаллов сульфата аммония низкого качества, загрязнённых органическими примесями, и приводит к технологическим затруднениям переработки, вынужденной остановке переработки для откачки из рецикла 150-250 м3 отработанного раствора с содержанием до 36 масс.% сульфата аммония и до 24 масс.% органических примесей на шламонакопитель. Предложенные способы переработки отработанного раствора [1а, 99-101] не устраняют главного недостатка – накопления органических примесей в рецикле рабочего раствора и малого периода производственного цикла, и они настолько неэффективны, экологически опасны с получением загрязнённого примесями сульфата аммония и пластификатора, что не нашли применения в промышленности. В настоящее время из-за переполнения отработанным раствором шламонакопителей до предельного уровня в России производства (мет)акриловых мономеров приостановлены. Поэтому исследование процесса и разработка физикохимических и технологических основ безотходной технологии переработки сернокислотных отходов производства (мет)акриловых мономеров с очисткой от органических примесей и получением из них качественной функциональной добавки композитов, а также повышенного качества сульфата аммония являются приоритетной технологической и экологической задачей, прежде всего, для создания предпосылок реанимации сернокислотного процесса синтеза полимеризационных мономеров в России.
В сернокислотном процессе синтеза (мет)акриловых мономеров [1а, 9, 30, 45, 46] образуется значительное количество сернокислотных отходов и в мире годовой выход сернокислотного маточника составляет до 11 млн т. К примеру, при мощности производства (мет)акриловых мономеров 5 тыс. т/год на 1 тонну их образуется 3,25 тонны концентрированного сернокислотного маточника [1а, 45, 46] или до 11 т/ч [45, 46] или до 20-22 т/ч разбавленного водой до плотности 1,27-1,33 г/см3, предназначенного для переработки в сульфат аммония [97].
Крупнотоннажные сернокислотные отходы производства (мет)акриловых мономеров являются источником дешёвого и доступного сырья для получения серной кислоты [1а, 102, 153-181], сульфата аммония – ценного минерального удобрения [97, 98] и пластификатора бетонных и битумных композиций, которые широко используются в различных отраслях промышленности, сельском хозяйстве и производстве полимеров [1а, 99-101]. Сульфат аммония в последнее время находит применение в качестве сегнетоэлектрического наполнителя для получения полимерных электретов (диэлектриков) [1а], диапазон использования которых простирается от медицины и бытовой техники до техники специального назначения.
Данная глава диссертационной работы посвящена разработке физикохимических и технологических основ нейтрализации кислотных примесей (мет)акриловых мономеров щелочным агентом для стабилизации и улучшения его
128
качества [212а, 213а, 229а-232а] и безотходного процесса получения из сернокислотных отходов их производства функциональных добавок в композиты [233а-242а].
5.1. Нейтрализация кислотных примесей метилметакрилата раствором щелочного агента
Из химизма процесса синтеза ММА следует [1а], что кислотные примеси могут представлять собой свободные кислоты – муравьиная, уксусная, метакриловая кислота и другие кислоты, диоксид серы, сульфированные органические примеси кислотного характера и др., при этом химическая природа, состав и концентрация некоторых кислотных примесей неизвестны, и процесс их образования зависит от технологического режима.
5.1.1. Нейтрализация содовым раствором
Данный раздел работы посвящён разработке физико-химических основ нейтрализации кислотных примесей сырца ММА содовым раствором [212а, 213а,
229а, 230а].
В промышленности [1а, 45] сырец ММА состава (ММА: предельные эфиры:метанол:вода:гидрохинон: формалин: диоксид серы: кислотные примеси – (7375): (3-4): 6-8: (10-12): (0,02-0,04): (1,0-0,8): <0,1: (1,2-2,4) соответственно (масс.%)
нейтрализуют раствором соды с концентрацией 6-8%, содержащим медный купорос 0,06-0,12 масс.% (ингибитор полимеризации натриевой соли метакриловой кислоты).
Процесс очистки сырца метилметакрилата от кислотных примесей (муравьиная кислота, метакриловая кислота, сернистый ангидрид и др.) проводится в две стадии, где на первой – нейтрализация содовым раствором, а на второй - промывка продуктов реакции разбавленным раствором моногидрата серной кислоты. Практическая реализация этих процессов очистки кислотных примесей сырца ММА для обеспечения стабильного качества товарного продукта и их эффективность возможны только при знании химизма реакций, лежащих в их основе, и физико-химических процессов массопереноса и распределения компонентов при смешении и фазовом разделении сложной реакционной гетерогенной системы. Поэтому рассмотрим фи- зико-химические основы процесса нейтрализации кислотных примесей сырца ММА раствором щелочного агента. До сих пор считается, что при использовании в действующем производстве ММА раствора соды процесс очистки основан на нейтрализации свободной МАК и связывания сернистого ангидрида формальдегидом [1а, 45]
Н2С=ССН3СООН + Na2CO3 → Н2С=ССН3СООNa + СО2 |
(5.5) |
SO2 + Na2CO3 → NaНSO3 + СО2 |
(5.6) |
СНОН + NaНSO3 → NaO3SСН2ОН |
(5.7) |
Однако необходимо отметить, что реакция (5.7) почти не протекает, т.к. образование бисульфита протекает в системах, в которых обеспечивается более чем 2 кратный избыток сернистого ангидрида по отношению к карбонату натрия [1а, 230а]. Для создания благоприятных условий образования бисульфита в раствор сульфита, как правило, добавляют разбавленную серную кислоту, и только тогда образующийся in situ гидросульфит связывается формальдегидом. Так, по данным работы [1а, 230а], благоприятными условиями образования бисульфитного производного является рН = 7,5-11,0 и избыток бисульфита (например, к 250 мл 1 М раствора сульфита
129
натрия добавляют 50 мл 1 н. раствора серной кислоты). По данным [1а], в оптимальных условиях реакция между формальдегидом и бисульфитом натрия заканчивается через 30 мин.
При реакции же сернистого ангидрида с сульфитом натрия в системе быстро достигается равновесие и образующиеся небольшие количества бисульфитного производного разлагаются далее на исходные реагенты. Данное обстоятельство необходимо учитывать при разработке предложений по оптимизации технологических параметров стадии нейтрализации сырца метилметакрилата от кислотных примесей.
Наряду с целевыми компонентами нейтрализующих растворов, побочные составляющие также претерпевают превращения. Побочные превращения формальдегида могут быть описаны нижеприведёнными схемами.
Полимеризации формальдегида. Известно, что продажный водный раствор формальдегида стабилизирован метанолом [1а]. В связи с этим в растворе метанола наблюдается равновесие
СН2O + СН3ОН ↔ Н3С-O-СН2ОН |
(5.8) |
При этом гемиформаль Н3С-O-СН2ОН может реагировать дальше в двух направлениях, присоединяя либо ещё одну молекулу формальдегида, либо спирта
|
|
|
|
HCOH |
|
|
|
|
|
|
|
|
|
|
H3CO(CH2O)2-H |
(5.9) |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||||
|
|
||||||||
H3COCH2OH |
|
|
|
|
|
|
|
|
(5.10) |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
H3COCH2OCH3 |
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3COH |
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Однако на практике реакция (5.10) протекает лишь в присутствии сильных минеральных кислот. Первая же реакция (5.9) продолжается дальше
H3CO(CH2O)2-H + n HCOH |
H3CO(CH2O)n – H. |
(5.11) |
Образующиеся полимеры формальдегида имеют рН-зависимую растворимость в водной фазе системы [1а]. Поэтому не исключено, что при рН = 1,9 – 6,4 он выделяется и образует с водой суспензию в водном и эфирном слое.
Окислительно-восстановительное диспропорционирование формалина. К
непроизводительным реакциям формальдегида в смеси вода – метанол в присутствии кислот, солей и щелочных реагентов относится реакция Канницаро – Тищенко [1а]
2 СН2O → СН3ОН + СН(O)ОН |
(5.12) |
быстро протекающая при комнатной температуре, снижающая содержание формальдегида в реакционной системе. Накапливающаяся муравьиная кислота повышает кислотность системы (в реальных условиях она нейтрализуется содой, что также снижает «нейтрализующую ёмкость» системы очистки).
Таким образом, к побочным реакциям компонентов, снижающим эффективность системы очистки кислотных примесей метилметакрилата, следует отнести:
-полимеризацию формальдегида;
-диспропорционирование формальдегида;
130
- образование в условиях недостатка сернистого ангидрида из кальцинированной соды не бисульфита, а сульфита натрия, который малоактивен и в условиях реального процесса не способен образовывать аддукт с формальдегидом или нейтрализовать диоксид серы.
Необходимо отметить, что процесс очистки сырца ММА протекает в гетерогенной системе, представляющей собой дисперсную систему (эмульсию) с жидкой поверхностью раздела фаз между двумя несмешивающимися жидкостями: жидкость первая – сырец ММА и жидкость вторая – промывной водный раствор соды.
Эффективность массопереноса в такой системе будет существенно определяться наличием в ней ионогенных поверхностно-активных веществ (ПАВ), например, таких как натриевые соли полиметакриловой кислоты [1а], образующиеся в водном растворе после вымывания из органической фазы метакриловой кислоты
(МАК).
Кроме вышеперечисленных реакций, в различных аппаратах системы промывки сырца ММА [230а] протекают процессы, в значительной степени определяющие качество будущего товарного продукта метилметакрилата.
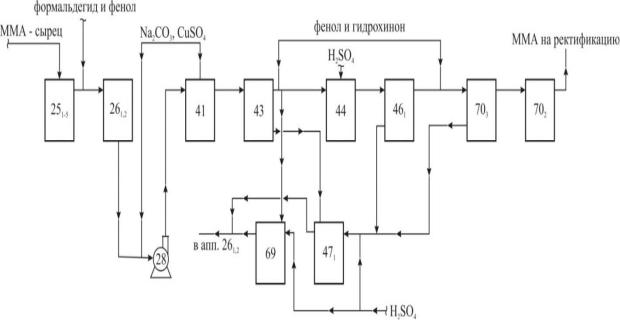
Так, в переходе между аппаратами 25 и 26 [45] в сырце ММА на рис. 5.1, представляющие собой гетерофазную систему, содержащую ММА, метанол, ацетон и воду, подаётся водный раствор карбоната натрия, гидрохинона, формальдегида и медного купороса.
Рис. 5.1. Промышленная технологическая схема очистки сырца метилметакрилата от кислотных примесей содовым раствором: 28 – насос; 251-5 – конденсаторы; 261,2, 471, 69 и 702,3 – сборники; 41 и 43 – смесители с мешалкой; 44 и 461 – фазоразделители.
При смешении и фазовом разделении гетерофазной системы вода – эфир в системе протекают реакции, согласно предлагаемой нами физико-химической модели очистки сырца ММА на рис. 5.2.
