
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Упражнения и задачи для самостоятельного решения
1. Напишите уравнения протолитического равновесия и укажите сопряженные кислотно-основные пары в водных растворах:
а) азотистой кислоты Ко (HNO2) = 5,110–4 ;
б) аммиака Кo(NH3H2O)= 1,7610–5 ;
в) угольной кислоты Ко (Н2СО3 )= 4,5 ∙10–7 Ко ( НСО3–) = 4,810–11
От каких факторов зависит стандартная константа равновесия Ко ?
2. Вычислите концентрационную константу основности аммиака Кс(NH3H2O) и рKc(NH3H2O) в 0,02 н растворе КС1 ,
если рКо (NH3H2O)=4,75.
Ответ: рКс = 4,86; Кс = 1,38 ∙10–5
3. Напишите уравнения реакций автопротолиза воды и безводной уксусной кислоты.
4. Как связаны константы кислотности и основности сопряженной пары NH4 + - NH3 ? Приведите вывод формулы.
5. Степень диссоциации (протолиза) уксусной кислоты равна
1,32∙ 10–2, Ко(СН3СООН)= 1,75 ∙ 10–5 .
Определите концентрацию кислоты, концентрацию ацетат-иона и рН раствора. Коэффициенты активностей ионов принять равными 1.
Ответ:рН= 2,8; [CH3COOH] = 0,15моль/л; [CH3COO–] = 1,6 ∙10–3 моль/л.
6. В О,1 М водном растворе аммиака рН=11,12. Вычислите степень диссоциации (протолиза), константу основности и концентрацию ионов аммония в данном растворе. Коэффициенты активностей ионов принять равными 1.
Ответ: α = 1,32 ∙10–2; Kb = 1,75 ∙10–5; [NH4+] = 1,32 ∙10–3
7. Напишите уравнение протолитического равновесия в водном растворе нитрата аммония. Сколько граммов NH4NO3 содержится в 100 мл его водного раствора, если рН=5,12? [Ко (NH3∙H2O) =1,76∙10–5 ].
Коэффициенты активностей ионов принять равными 1.
Ответ: 0,8 г
8 Рассчитайте рН раствора, полученного при смешивании 10 мл
0,1 М HNO2 и 40 мл 0,025 М КОН, если плотности растворов равны 1,00 г/мл [Ко(HNO2)=5,110–4].
Коэффициенты активностей ионов принять равными 1 .
Ответ: рН= 7,8.
6. Растворы сильных электролитов
Сильные электролиты – вещества, которые при растворении практически полностью диссоциируют на ионы.
Понятие «сильный электролит» относительно. Оно характеризует не только растворяемое вещество, но и растворитель. Хлороводород, растворённый в воде, — сильный электролит, а хлороводород, растворённый в безводной уксусной кислоте, — слабый. Причина электролитической диссоциации электролитов в водных растворах является гидратация.
Например: NaCl + (a +b)H2O = Na+ · aH2O + Cl- · bH2O. В результате гидратации образуются гидратированные ионы натрия и хлора.
Вследствие электростатического взаимодействия в растворах любых концентраций вблизи катиона находятся преимущественно анионы, а вблизи аниона – катионы. Взаимное расположение ионов различного знака таково, что каждый из них окружён ионной атмосферой из противоположно заряженных ионов. С изменением концентрации раствора меняется строение ионной атмосферы и химическая активность иона. С ростом концентрации проявляются электростатические силы, связывающие ионы, и химическая активность ионов становится меньше, чем их концентрация.
Закон действующих масс не учитывает взаимодействия ионов, и в растворах сильных электролитов наблюдается нарушение этого закона. Общая теория растворов, которая позволяла бы теоретически учесть все виды внутренних взаимодействий в растворах любых концентраций, пока ещё не создана. Поэтому по предложению американского физико-химика Г.Льюиса в выражении закона действующих масс концентрации заменены активностями. Активность молекул или ионов — это их эффективная концентрация, в соответствие с которой молекулы или ионы проявляют себя в химических и физических процессах. Значения активностей должны быть такими, чтобы при их подстановке сохранялась справедливость закона действующих масс.
Для равновесной реакции: aA + bB = cC + dD константа равновесия
после замены концентраций активностями выглядит так:
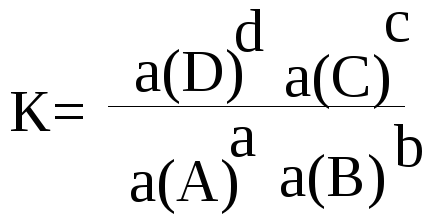
Активность иона или молекулы равна произведению его концентрации С на его коэффициент активности «f» : a = f ∙ C.
Коэффициенты активности ионов зависят от величины I , называемой ионной силой и вычисляемой по уравнению:
I = 0,5( C1z12 + C2z22 + C3z32 + …) =0,5∑ Cizi2,
где Ci - концентрация иона данного сорта, а zi – заряд этого иона.
Ионная сила учитывает электростатическое влияние всех ионов в растворе. Она имеет размерность концентрации и для растворов сильных однозарядных электролитов численно ей равна. В разбавленных растворах (I< 0,1M) коэффициенты активности ионов меньше единицы и уменьшаются с ростом ионной силы: при I→ 0 величина f→1. Растворы с очень низкой ионной силой(I<10-4М) можно считать идеальными.
С увеличением концентрации коэффициенты активности ионов начинают зависеть от природы ионов, а затем и от общего состава. В очень концентрированных растворах ( I> 1M) коэффициенты активности ионов могут быть больше единицы. Одна из причин этого явления состоит в том, что в области очень высоких концентраций сказывается дегидратация, освобождение иона от гидратной оболочки и активность его снова растёт. Поэтому для нахождения коэффициентов активности следует пользоваться конкретными справочными данными (см. табл. 5 Приложения).
Пример 1. Рассчитайте рН раствора, содержащего в 1л 0,001 моль HCl и 0,06 моль CaCl2 с учетом и без учета коэффициентов активности.
Решение:
Уравнение протолиза: HCl + H2O = H3O+ + Cl–
а) без учета коэффициента активности:
[H3O+] = 0,001моль/л; рН = –lg[H3O+] = –lg10-3 = 3.
б) с учетом коэффициента активности:
Ионная сила раствора:
I = 0,5( 0,001∙1 + 0,001∙1 + 0,06∙22 + 2∙0,06∙1)= 0,182.
Коэффициент активности иона H3O+ f= 0,824.
а(Н3O+) = 0,824∙0,001 =0,000824.
рН= –lgа(Н3O+) = – lg8,24 ∙10-4 = 3,08.
Пример 2. Рассчитайте рН 0,001М NaOH.
Решение:
pOH = –lg 10–3 = 3; pH = 14 – pOH = 14 – 3 = 11.
Пример 3.Рассчитайте рН раствора соляной кислоты с концентрацией 10–7моль/л.
Решение:
При концентрации сильного электролита < 10–6 моль/л пренебречь автопротолизом воды нельзя.
Уравнение электронейтральности: [H3O+] = [Cl–] + [OH–] .
[Cl–] = [HCl]; [OH–] = Kw / [H3O+] ;
Тогда [H3O+] = [HCl} + Kw/[H3O+] ;
[H3O+]2 - [HCl] – Kw = 0;
______________
[H3O+] = 0,5( [HCl] + √ [HCl]2 + 4Kw )
[Cl–] = 10–7 моль/л ; [OH–] = K(H2O) / [H3O+] = 10–14/ [H3O+] ;
Тогда [H3O+] = 10–7 + 10–14/ [H3O+] или [H3O+]2 – 10–7 – 10 –14 = 0
_____________
Отсюда: [H3O+] = 0,5(10-7 + √ 10–14 + 4 ∙10–14 = 1,67 ∙ 10–7 моль/л.
pH = –lg1,67 ∙ 10–7 = 6,78.
