
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Делокализованная π-связь
По методу МВС электронная структура молекулы выглядит как набор различных валентных схем (метод локализованных пар). Но, как оказалось, нельзя объяснить экспериментальные данные о структуре многих молекул и ионов, оперируя только представлениями о локализованной связи. Исследования показывают, что всегда локализованными являются только σ-связи. При наличии π-связей может иметь место делокализация, при которой связующая электронная пара одновременно принадлежит более чем двум атомным ядрам. Например, экспериментально установлено,что молекула BF3 имеет плоскую треугольную форму(рис.6). Все три связи
B–F равноценны, однако величина межъядерного расстояния свидетельствует, что связь является промежуточной между одинарной и двойной. Объяснить эти факты можно следующим образом. У атома бора в результате комбинации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу, но остаётся неиспользованной свободная негибридизированная р-орбиталь, а атoмы фтора имеют неподелённые электронные пары. Поэтому имеется возможность образования π –связи по донорно- акцепторному механизму. Равноценность всех связей свидетельствует о делокализации π –связи между тремя атомами фтора.
Структурную формулу молекулы BF3 с учётом делокализации π- связи можно изобразить следующими образом (нелокализованную связь обозначена пунктиром):

Рис.11 Строение молекулы BF3
Нелокализованная π-связь обусловливает нецелочисленную кратность связи. В данном случае она равна 1 1 /3 поскольку между атомом бора и каждым из атомов фтора осуществляется одна σ–связь и 1 /3часть π-связи.
Точно также равноценность всех связей в ионе NO3–свидетельствует о делокализации π –связи и отрицательного заряда на все атомы кислорода. В плоском треугольном ионе NO3-( sp2-гибридизация атома азота) делокализованные
π-связи (изображены пунктирными линиями) равномерно распределяются между всеми атомами кислорода ( рис.12 )
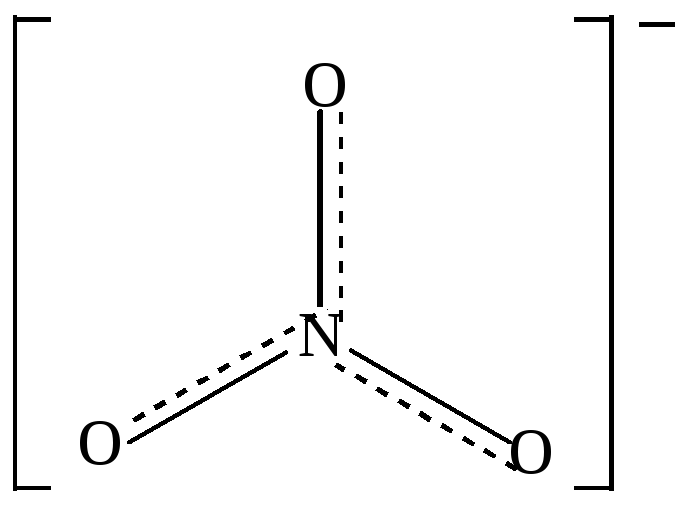
Рис. 12 Структурная формула иона NO3- с учётом делокализации π- связи
Аналогично делокализованные π-связи равномерно распределяются между всеми атомами кислорода в анионах :PO43-(sp3-гибридизация атома фосфора→тетраэдр) ,SO42-(sp3-гибридизация атома серы→тетраэдр)(рис.13)

Рис.13 Структурные формулы SO42- и PO43- с учётом делокализации
π-связи.
Метод молекулярных орбиталей
Если в методе валентных связей МВС волновая функция молекулы строится исходя из комбинаций волновых функций, образующих молекулу атомов, то в методе молекулярных орбиталей ММО полная волновая функция молекулы строится из функций, описывающих поведение отдельных электронов в поле, создаваемом остальными электронами и всеми атомными ядрами, которые образуют молекулярную систему.
К большинству молекул метод ВС может быть применен с успехом. Однако имеется ряд молекул, к которым этот метод неприменим или его выводы находятся в противоречии с опытом. Установлено, что в ряде случаев определяющую роль в образовании химической связи играют не электронные пары, а отдельные электроны. На возможность образования химической связи при помощи одного электрона указывает существование иона H2+. При образовании этого иона из атома водорода и иона водорода выделяется энергия в 255 кДж . Таким образом, химическая связь в ионе H2+довольно прочная. По методу МВС молекула кислорода имеет двойную связь, и все электроны должны быть спарены. Это означает, что молекула О2 диамагнитна (у диамагнитных веществ атомы не обладают постоянным магнитным моментом, и вещество выталкивается из магнитного поля). Однако экспериментальные данные показывают, что по энергии связь в молекуле кислорода действительно двойная, но молекула является не диамагнитной, а парамагнитной из-за наличия двух неспаренных электронов, и в результате молекулы кислорода обладают магнитным моментом, т.е. способны втягиваться в магнитное поле. Метод ВС бессилен объяснить это факт.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО).
Метод МО ЛКАО основан на следующих правилах:
1. Молекула рассматривается как целое, а не как совокупность сохраняющих некоторую индивидуальность атомов. Каждый электрон принадлежит молекуле в целом и движется в поле всех её ядер и электронов.
2. Состояние электрона в атоме описывается одноэлектронной волновой функцией Ψi, характеризуемой определённым набором молекулярных квантовых чисел. Эта функция называется молекулярной орбиталью МО. В отличие от одноцентровой атомной орбитали АО молекулярная орбиталь многоцентровая, так как число ядер в молекуле не менее двух. Как и для электрона в атоме квадрат волновой функции /Ψi/2определяет плотность электронного облака.
3. Совокупность молекулярных орбиталей, занятых электронами, определяет электронную конфигурацию молекулы.
4. Наиболее простой метод построения молекулярных орбиталей—метод линейной комбинации атомных орбиталей ЛКАО. В соответствии с этим методом молекулярная орбиталь рассматривается как линейная комбинация соответствующих атомных орбиталей в изолированных атомах, ядра которых входят в состав молекулы.
5. Перекрываются атомные орбитали, близкие по энергии приблизительно одинаковую симметрию относительно оси связи. В результате перекрывания атомных орбиталей образуются молекулярные. Число полученных молекулярных орбиталей (МО) равно числу исходных атомных(АО).
6. При перекрывании атомных орбиталей возможно образование как
σ-связей (перекрывание по оси химической связи), так и π-связей (перекрывание по обе стороны от оси химической связи).
7. Молекулярные орбитали, имеющие меньшую энергию по сравнению с исходными атомными называются связывающими, а молекулярные орбитали, обладающие большей энергией, чем исходные атомные орбитали — разрыхляющими.
Молекулярные орбитали, не участвующие в образовании химической связи, называются несвязывающими. Их энергия равна энергии исходных АО.
8. Последовательность заполнения электронами молекулярных орбиталей, как и в атомах, определяется принципом наименьшей энергии, принципом Паули, правилом Хунда.
9. Энергия связи определяется разницей количества электронов находящихся на связывающих и разрыхляющих МО. Для сопоставления числа связей в методах МВС и ММО используется понятие порядок связи, который равен полуразности числа связывающих и разрыхляющих электронов. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов(см. табл.1).
