
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
12.4. Устойчивость комплексных соединений
Все реакции образования комплексов в водном растворе обратимые. Состояние равновесия образования комплекса при T=const по закону действующих масс количественно характеризуется общей константой устойчивости (β). Константа устойчивости определяет меру общей устойчивости комплекса по отношению к устойчивости аквакомплекса. Для реакций образования аквакомплексов в водном растворе общие константы устойчивости приняты равными нулю.
Константа (или Ку) является термодинамической характеристикой устойчивости комплекса в растворе (см. табл. 6 Приложения), Величина, обратная константе образования, называется константой нестойкости комплекса Kн = 1/ . Величина константы образования является мерой устойчивости комплекса. Так, комплекс [Co(NH3)6]3+ более устойчив, чем [Cu(NH3)4]2+, поскольку константы устойчивости у них соответственно равны:1,991035 и 1,071022.
Поскольку образование комплексного иона происходит в результате обмена воды гидратированного иона на соответствующие лиганды, более точно процесс комплексообразования называется обменом лигандов.
Константа равновесия, соответствующая суммарной реакции:
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ +4H2O ,
является суммарной константой образования или константой устойчивости данного комплекса β4 (или Ку):у(β)=1/Кн; рКу=рКн, где Кн—константа нестойкости (диссоциации).
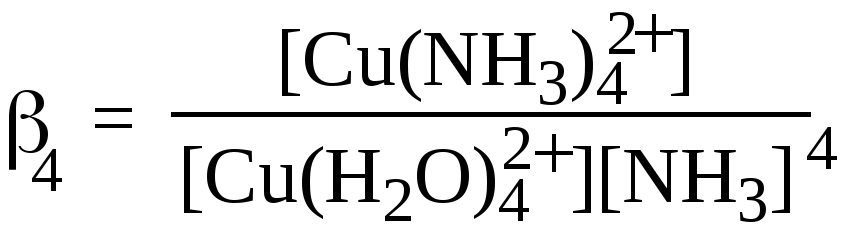
12.5. Свойства комплексных соединений Окраска комплексных соединений
Поглощение света комплексными соединениями d- элементов теория кристаллического поля объясняет переходом электронов с t2g-подуровня на eg-подуровень в октаэдрических комплексах и с eg-подуровня на t2g-подуровень в тетраэдрических комплексах. При этом поглощается квант света, энергия которого равна энергии расщепления: h=, где h- постоянная Планка, ― частота колебаний. Энергия расщепления, таким образом, оказывается математически связана с частотой колебания света в максимуме поглощения и, следовательно, с длиной волны максимума поглощения: =/h и =с/, где с― скорость света.Окраска комплекса зависит от его состава и строения, и определяется длиной волны max , отвечающей максимуму полосы поглощения и интенсивностью полосы. В спектрах поглощения комплексных соединений d-элементов имеются полосы поглощения низкой интенсивности, которые проявляются в видимой области, а иногда несколько сдвинуты в фиолетовую область. Их появление связано с электронными переходами в незаполненных d- орбиталях.
Положение полосы поглощения определяется величиной расщепления в кристаллическом поле. Изъятие из потока света, падающего на поглощающее свет вещество, части энергии, отвечающей поглощённой длине волны, приводит к тому, что возникает окрашивание, соответствующее действию на глаз человека непоглощённых длин волн. Например, из солнечного спектра раствором [Ti(H2O)6]3+ поглощаются зелёные волны, поэтому мы воспринимаем растворы комплексов Ti3+ как имеющие красно-фиолетовое окрашивание (см. табл. 8 Приложения). Невозможностью
d-электронных переходов объясняется отсутствие или её низкая интенсивность у следующих комплексных соединений: [Au(CN)4], [Co(CN)6]3, [Zn(NH3)4]2+.
