
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Упражнения и задачи для самостоятельного решения
1. Определите заряды комплексных частиц с центральным ионом-комплексообразователем кобальтом в степени окисления +3:
а)[Co(CO3)(NO2)4], б)[Co(NH3)5(SO4)], в)[Co(CO3)2(NO2)2], г)[Co(NH3)5Cl], д)[Co(NH3)6].
2. Определите степень окисления иона-комплексообразователя в следующих соединениях:
а)K3[Ag(S2O3)2], б)[Ni(CO)4], в)Al[Au(CN)2I2]3, г) K4[Mo(CN)8], д)Na[Co(NH3)2(SCN)2(C2O4)]
3. Напишите координационные формулы соединений по заданному составу для вещества в водном растворе, если при добавлении избытка нитрата серебра :
а) к 0,11 моль PtCl4 · 3NH3 образуется 0,11 моль осадка;
б) к 0,07 моль CrCl3 · 5NH3 образуется 0,14 моль осадка.
в) к 0,22 моль PtCl4 ∙ 2NH3 образуется 0 моль осадка
г) к 0,04 моль PtCl4 ∙ 4NH3 образуется 0,08 моль осадка
д) к 0,08 моль PtCl4 ∙ 6NH3 образуется 0,32 моль осадка
е) к 0,18 моль CrBr3 ∙ 5NH3 образуется 0,36 моль осадка
Ответ: а)[Pt(NH3)3Cl3]Cl б)[Cr(NH3)5Cl]Cl2 в)[Pt(NH3)2Cl4] г)[Pt(NH3)4Cl2]Cl2 д)[Pt(NH3)6]Cl4 е)[Cr(NH3)5Br]Br2
4. Определите тип гибридизации в следующих комплексах с монодентатными лигандами:
а)[Pb(OH)4]2-, б)[Be(ОН)4]2-, в)[Al(H2O)6]3+, г)[Zn(H2O)4]2+, д)[HgBr4]2-,
е)[Cd(H2O)2(NH3)4]2+
Ответ: а)sp3 б)sp3 в)sp3d2 г)sp3 д)sp3 е)sp3d2
5.Составьте энергетическую диаграмму образования связей, определите тип гибридизации следующих комплексов 3d- элементов с октаэдрическим полем лигандов: а)[MnCl6]2-; [Co(NO2)6]3-. Укажите число неспаренных d-электронов,
предскажите магнитные свойства комплексов :
Ответ:
а)
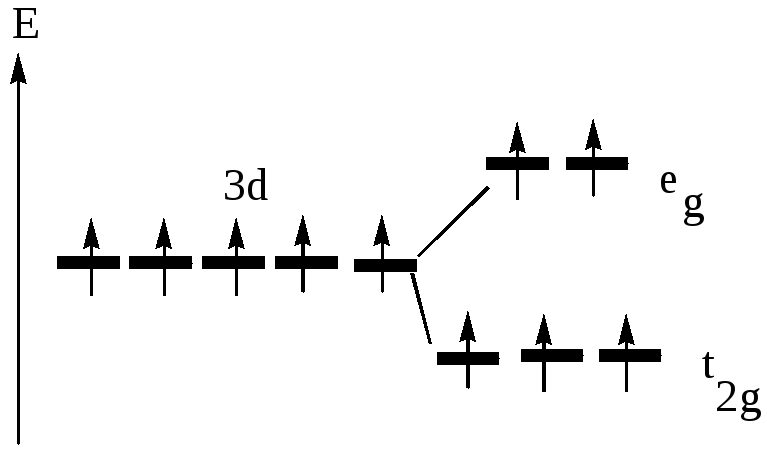
[MnCl6]2- гибридизация sp3d2, лиганд слабого поля, комплекс парамагнитный.
б)

[Co(NO2)6]3- гибридизация d2sp3, лиганд сильного поля, комплекс диамагнитный.
6. Объясните, почему низкоспиновые комплексы Fe(II) и Co(III) диамагнитны.
7. Составьте пространственные изображения цис- и транс- изомеров следующих комплексов: [Co(NCS)3(NO2)3]3-, [Pt(NH3)2(NCS)2].
8. Напишите молекулярные и ионные уравнения реакций образования комплексных соединений:
Zn(OH)2 + NH3 · H2O= …; Fe(CN)2 + KCN =…;
[Cr(H2O)6]3+ + OH- = … : [Ni(H2O)6]2+ + NH3 · H2O =
9. Объясните, почему соединения ионов Ti4+, Ca2+ и Zn2+ бесцветны.
10 Укажите какие из комплексных соединений являются неэлектролитами и сильными электролитами в водном растворе:
а)K2[PtCl6], б)[Pt(NH3)4(OH)2]Cl2, в)[Pt(NH3)2Br4], г)K3[Fe(CN)6], д)[Co(NH3)3(NO2)3], ж)Cr(H2O)5Cl]Cl2, з)[Cu(NH3)4](OH)2, и)Na2[Zn(OH)4].
11. Напишите уравнения протолитических реакций в водном растворе для комплексов, проявляющих кислотные свойства:
[Co(H2O)(NH3)4(NO2)]2+, [Pt(H2O)2(NH3)4]4+.
12. Напишите уравнения протолитических реакций в водном растворе для комплексов, проявляющих основные свойства:
[Co(NH3)5(OH)]2+, [Pt(NH3)2(OH)2].
13. Пользуясь таблицей констант устойчивости, определите, в каких случаях произойдёт взаимодействие между электролитами. Напишите для этого случая молекулярные и ионные уравнения
[Ag(NH3)2]NO3 + NaNO2 = …; Na3[Ag(S2O3)2] + KCN =…;
14. Вычислите концентрацию ионов серебра в 0,001М [Ag(CN)2]NO3, если константа устойчивости комплексного иона равна 7,1 ∙ 1019. Раствор соли содержит в одном литре 0,1 моль иона CN-
Ответ: 1,4 ∙10-21 моль/л
15. Определите окраску комплексного иона [Ti(H2O)6]6]3+ , если энергия расщепления энергетических уровней равна Δ = 241,9 кДж/моль.-
Ответ: длина волны максимума поглощения λ= 495 нм, цвет поглощаемого излучения― сине-зелёный, наблюдаемый цвет(дополнительный)― красный.
16. Определите число неспаренных электронов в высокоспиновом комплексе [Fe(H2O)6]3+ , если определенная экспериментально молярная магнитная восприимчивость равна 0,0146.Укажите тип гибридизации орбиталей центрального атома. _________
Ответ: магнитный момент μ = 2,84 √ 0,0146·298 = 5,92. магнетонов Бора. Такая величина соответствует пяти неспаренным электронам. Гибридизация sp3d2.
