
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Теория поля лигандов
Теория поля лигандов объединяет метод молекулярных орбиталей и теорию кристаллического поля: электростатическое воздействие поля лигандов на несвязывающие орбитали центрального атома-комплексообразователя, которое связано со стереохимией, магнитными свойствами и оптическим поглощением комплексов, а связи металл-лиганд можно рассматривать с точки зрения локализованных молекулярных орбиталей, образующихся из соответствующих атомных орбиталей. Особое значение в теории поля лигандов имеет возможность -донорного и - дативного взаимодействия.
Теория молекулярных орбиталей даёт подход, учитывающий ковалентный характер связей. Основные принципы теории молекулярных орбиталей, развитых в своё время для двухатомных молекул, применимы и к координационным соединениям. Для комплекса волновая функция молекулярной орбитали мо представляет собой линейную комбинацию, состоящую из волновых функций орбитали центрального атома металла м и групповой орбитали лигандов сL(линейная комбинация определённых орбиталей лигандов):
мо =ам ± сL
Знак + в уравнении отвечает связывающей орбитали, знак – разрыхляющей.
Рассмотрим октаэдрические комплексы d-элементов. Система координат взаимного расположения комплексообразователя и лигандов октаэдрического комплекса ML6
показана на рис.31
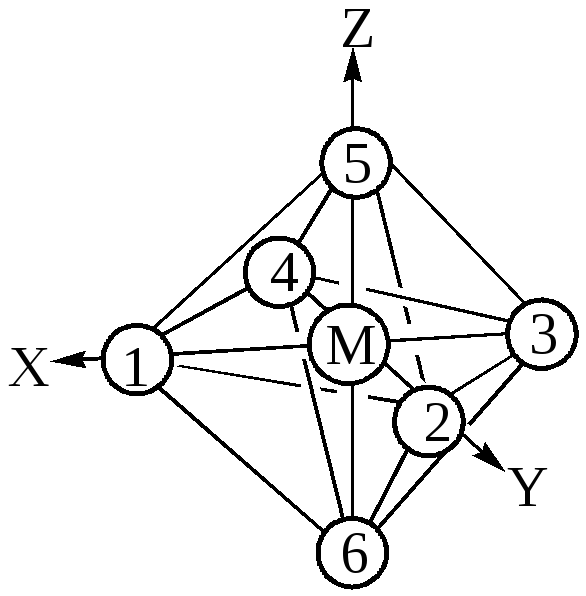
Рис.31 Схема октаэдрического комплекса ML6.
С учётом симметрии и энергетических соображений молекулярные орбитали(МО) строятся как линейная комбинация атомных орбиталей(АО). Могут образовываться как -, так и - молекулярные орбитали. Рассматривая связывание в октаэдрических комплексах, мы будем принимать во внимание в начале только - взаимодействие. Металл (4 период) способен предоставить лигандам девять орбиталей: пять 3d, одну 4s и три 4р. Так, s-орбиталь комплексообразователя благодаря сферической симметрии одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра. Это приводит к образованию семицентровых связывающей и разрыхляющей молекулярных s – орбиталей(s и *s). Каждая из трёх р-орбиталей может перекрываться с орбиталями лигандов, расположенных по осям x,y,z:
px- орбиталь перекрывается только с орбиталями лигандов 1и 3, py- орбиталь – только с орбиталями лигандов 2и 4, pz- орбиталь – только с орбиталями лигандов 5 и 6. Это приводит к образованию семицентровых трёх связывающих и трёх разрыхляющих
p -орбиталей(x,y,z и x*,y*,z*).Орбитали eg(z2 и x2-y2) перекрываются с орбиталями лигандов, соответствующим образом расположеннных в пространстве. При этом образуются две связывающие и две разрыхляющие молекулярные
-орбитали (z2, x2-y2 и z2*и x2–y2*).Орбитали t2g (dxy,dyz,dxz ) не подходят для
-связывания, так как они не направлены к орбиталям лиганда. Орбитали t2g могут перекрываться по - типу с теми орбиталями лигандов, которые обладают подходящей для этого симметрией. Многие лиганды (например, NH3, H2O, Cl–, Br–) не имеют таких орбиталей с энергией, близкой к энергии t2g- орбиталей центрального атома. Между такими лигандами и центральным атомом не образуется - связей. Электроны, находящиеся на орбиталях t2g в комплексах, где отсутствуют - связи, мало отличающиеся от их энергии в несвязанном атоме металла. Считается, что электроны, занимающие в свободном атоме металла орбитали dxy,dyz,dxz , при образовании комплекса переходят на несвязывающие молекулярные орбитали t2g, которые по энергии и форме электронных облаков мало отличаются от атомных орбиталей (их обозначение xyo, yzo, xzo).
Октаэдрические комплексы в основном состоянии имеют семь энергетических уровней, три из которых связывающие, три- разрыхляющие и один – несвязывающий.
Рассмотрим с помощью этого метода электронную конфигурацию низкоспинового иона [Co(NH3)6]3+. В образовании химической связи в этом комплексе участвуют 18 электронов: 6 электронов иона-комплексообразователя Co3+ и 12 электронов шести лигандов NH3 Молекулярные орбитали образуются в том случае, если атомные орбитали исходных взаимодействующих частиц близки по энергии и соответствующим образом ориентированы в пространстве. Орбиталь 4s иона Co3+ одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра, в результате чего образуются семицентровые связывающая и разрыхляющая молекулярные орбитали:s и s*. Каждая из трёх 4р- орбиталей иона Co3+ перекрываются с орбиталями лигандов, так как последние расположены по осям р-орбиталей комплексообразователя. Это приводит к образованию шести семицентровых орбиталей:трёх связывающих x , y , z и трёх разрыхляющих x*, y*,z*. Орбитали z2 и x2-y2 иона Co3+ перекрываются с орбиталями лигандов, соответствующим образом расположенных в пространстве. При этом образуются четыре семицентровые молекулярные орбитали: две связывающие z2,x2-y2 и две разрыхляющие z2 *, x2-y2*. Орбитали dxy,dxz,dyz иона-комплексообразователя не направлены к орбиталям лигандов и не комбинируются с ними, поэтому не участвуют в образовании -связи. Энергия этих орбиталей не изменяется, и они являются несвязывающими орбиталями. Их обозначение: xzо,xyо ,yzо .
Таким образом, в комплексном ионе [Co(NH3)6]3+ пятнадцать молекулярных орбиталей: шесть связывающих, шесть разрыхляющих и три несвязывающих.
18 валентных электронов в низкоспиновом комплексном ионе [Co(NH3)6]3+ на молекулярных орбиталях располагаются следующим образом:(s)2 , (x)2, (y)2 , (z)2, (x2-y2)2 , (z)2 / (xzо)2, (xyо)2, (yzо)2 .Схема образования молекулярных орбиталей в низкоспиновом комплексном ионе [Co(NH3)6]3+ представлена диаграммой на рис. 32.
Молекулярные орбитали xyо ,xzо, yzо и *x2-y2, *z2 в теории поля лигандов соответствуют dx2-y2 , dz2 и dxy, dxz, dyz – орбиталям, возникающих при расщеплении
d - уровня в октаэдрическом поле лигандов. Таким образом, и в теории поля лигандов величина соответствует энергии электронного перехода между уровнями t2g и eg . В соответствии с рассматриваемой теорией параметр расщепления растёт с увеличением степени перекрывания исходных орбиталей, которое приводит к увеличению энергетического различия между связывающими и разрыхляющими орбиталями, т.е. значение растёт с усилением - связывания металл-лиганд.

Рис.32 Схема распределения валентных электронов по молекулярным орбиталям октаэдрического низкоспинового комплексного иона [Co(NH3)6]3+.
