
- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Многоатомные молекулы
К многоатомным молекулам применимы те же принципы, что и к двухатомным, однако с увеличением числа атомов в молекуле увеличивается число комбинируемых атомных орбиталей, различающихся как по форме, так и по энергии. Не участвуют в образовании связей электроны, находящиеся на завершенных энергетических уровнях(однако на их долю приходится большой запас энергии), часть валентных электронов, находящихся на несвязывающих молекулярных орбиталях. В многоатомной молекуле наряду с нелокализованными молекулярными орбиталями, охватыващими несколько ядер могут быть и локализованные, охватывающие только два ядра. Таким образом, молекула представляет сложную систему, и поэтому необходимо учитывать большое число факторов, влияющих на полную молекулярную волновую функцию.
Для некоторого упрощения принято для многоатомных молекул молекулярную орбиталь рассматривать как состоящую из орбитали центрального атома и так называемой групповой орбитали. Групповая орбиталь представляет собой результат комбинации орбиталей периферических атомов (лигандов).
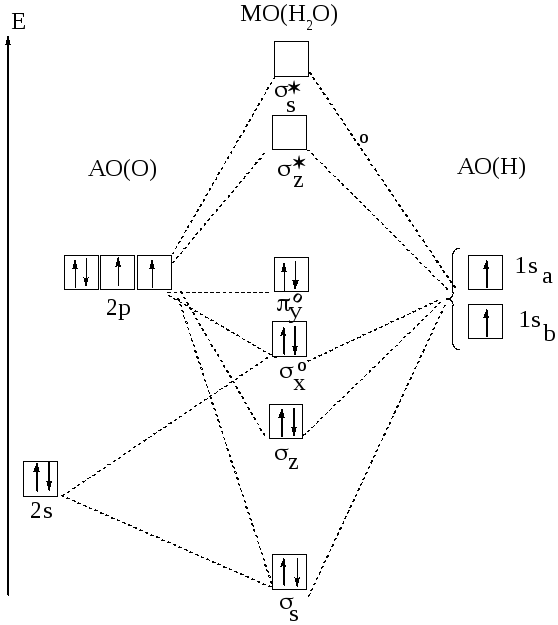
Рис.23 Молекулярные орбитали в Н2О
Рассмотрим трёхатомную молекулу Н2О. Она имеет угловую форму. Роль центрального играет атом кислорода, а атомы водорода—роль лигандов. Молекулярные орбитали Н2О образуются за счёт 2s- и
2p- орбиталей кислорода и 1s-орбиталей двух атомов водорода. Перекрывание 2pz- орбиталей атома кислорода и 1s-орбиталей двух атомов водорода приводит к образованию молекулярных орбиталей: связывающей σz и разрыхляющей σz*.Перекрывание 2s- и 2px- орбиталей приводит к образованию связывающей σs и разрыхляющей σs* орбиталей. Орбиталь 2py не перекрывается и в молекуле Н2О играет роль несвязывающей. Таким образом, комбинация четырёх атомных орбиталей кислорода и двух орбиталей атомов водорода приводит к образованию двух связывающих(σs и σz), двух несвязывающих(σxо и πyо) и двух разрыхляющих(σs* и σz*) молекулярных орбиталей (рис.23).
(Метод молекулярных орбиталей применительно к комплексным соединениям см главу Комплексные соединения)
Свойства ковалентной связи
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Насыщаемость
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Валентность — свойство атома данного элемента присоединять или замещать определённое число атомов другого элемента. Мерой валентности является число ковалентных связей, которые образует атом. При этом учитывают связи, образованные как по обменному механизму, так и по донорно-акцепторному.
При образовании химической связи по обменному механизму каждый из взаимодействующих атомов по одному неспаренному электрону для образования связывающей электронной пары. Так образуется, например, молекула водорода:
Н∙ + ∙Н = Н׃Н
При определении числа химических связей, которые атом элемента может образовывать по обменному механизму, следует учитывать, что при переходе атома в возбуждённое состояние число его неспаренных электронов может увеличится в результате разделения некоторых электронных пар и перехода электронов на более высокие энергетические подуровни. Если энергия, затраченная на возбуждение атома, не очень велика, то она может компенсироваться энергией образующейся химической связи, и возбуждённое состояние стабилизируется. Это возможно при переходе электронов на более высокие подуровни внутри одного и того же энергетического уровня.
Валентности атомов:Li(1s22s12p0),N(1s22s22px12py12pz1),O(1s22s22px2py1pz1),
F(1s22s2p5),Ne(1s22s22p6) равны числу неспаренных электронов в основном состоянии, так как разделение любой из электронных пар в этих атомах возможно только при переходе электронов на новый, более высокий энергетический уровень. Таким образом, валентность лития равна 1, азота 3, кислорода 2, фтора 1, неона 0.
В атомах бериллия, бора, углерода может происходить разделение электронных пар за счёт перехода электронов с 2s- подуровня на 2p-подуровень, так как в атомах этих элементов на 2p- подуровне имеются вакантные орбитали. Поэтому валентности 2,3 и 4, присущие атомам Ве,В,С в возбуждённом состоянии, более характерны для них, чем валентности, определяемые числом неспаренных электронов в основном состоянии.
Число химических связей, которые атом образует по донорно-акцепторному механизму, зависит от числа имеющихся на его валентных подуровнях несвязывающих электронных пар или вакантных орбиталей. Например, атом азота может образовывать четыре химические связи: три– за счёт трёх неспаренных электронов и ещё одну – за счёт электронной пары.
