
Неотложные состояния и анестезия в акушерстве_Лысенков С._2004
.pdf
Схема регуляции свертывающей системы крови представлена на рисунке 5.1.2:
Р и с . 5.1.2. Модель системы коагуляции крови и ее регуляции (по Б. Г. Катцунг, 2000).
Протеин С — активируется тромбином, эта реакция ускоряется тромбомодулином — поверхностным белком эндотелиоцитов. В присутствии своего кофактора расщепляет и инактивирует основ ные неферментные факторы свертывания (фУШ и фУ). Протеин С синтезируется гепатоцитами.
70
Протеин S — кофактор протеина С, в его присутствии инактивирует фУШ и фУ. Также К-витамин — зависимый гепатогенный фактор.
Дефицит протеина С клинически значим, ибо создает уже в молодом возрасте наклонность к тромбозам. Вторичное снижение протеина С наблюдается при ДВС-синдроме, тяжелых поражени ях печени, респираторном дистресс-синдроме.
а2-Макроглобулин — белок, обладающий способностью связы вать активированные компоненты свертывающей системы крови и фибринолиза.
Еще один ингибитор факторов свертывания — ингибитор пути тканевого фактора относится к семейству кунинов, гомологич ных апротинину (ингибитору панкреатического трипсина). Он инактивирует ФХа, ф\Па, фШ-тканевой фактор. Гепарин усили вает его антикоагулянтную активность.
Вторичные физиологические коагулянты образуются в процессе свертывания и фибринолиза. Так, фибрин, образующийся при свер тывании, адсорбирует и инактивирует большое количество тром бина и, таким образом, является антикоагулянтом (антитромбин-1). Продукты ферментативного расщепления фибриногена плазмином — продукты деградации фибрина (ПДФ) ингибируют как агрегацию тромбоцитов, так и образование фибрина.
Патологические антикоагулянты — это антитела к факторам свер тывания, чаще всего к фУШ и фУ, иммунные комплексы — волчаночный антикоагулянт (в том числе, при антифосфолипидном синд роме), антитромбин-V, нередко выявляющийся при ревматоидном артрите. Эти коагулянты отсутствуют в крови в норме и появляются при различных иммунных нарушениях, реже — без видимых причин.
Фибринолиз
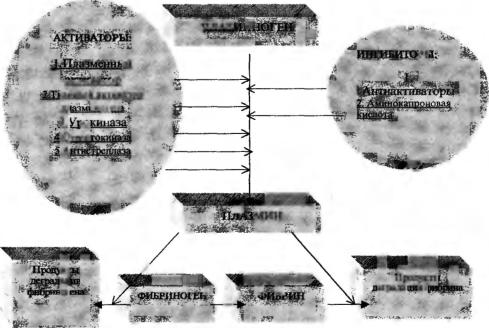
Ферментная система, вызывающая расщепление фибрина на мелкие фрагменты, называется фибринолитической (плазминовой). Главный компонент этой системы — плазмин, содержащийся в плаз ме крови в виде профермента (плазминогена) в количестве 2,2 г/л.
Активация плазминогена осуществляется в организме, как и активация свертывания крови, как по внешнему, так и по внут реннему механизму.
Внутренний механизм запускается комплексом ХПа с калликреином и ВМК. Активность этого механизма оценивается по скорос ти лизиса глобулиновой фракции, полученной из крови, предва рительно активированной контактом.
Внешняя активация фибринолиза в основном осуществляется син тезируемым в эндотелии сосудов белковым активатором тканевого
71
типа (ATT). Сходные с ним активаторы содержатся во многих тканях и жидкостях организма, но эндотелиальный легче всего поступает в кровоток. Интенсивный выброс его происходит при всех видах заку порки сосудов, при различных физических нагрузках, под влиянием различных вазоактивных веществ и лекарственных средств — никоти новой кислоты, норадреаналина, адреналина.
Мощные активаторы плазминогена находятся также в клетках крови, моче (урокиназа), молоке, желчи, слюне. Некоторые опу холи продуцируют активаторы плазминогена (меланома). Актив ный плазмин быстро блокируется антиплазминами и элиминиру
ется из кровотока. |
|
Нефизиологическими активаторами плазминогена |
являются |
стрептокиназа (продуцируемая гемолитическим стрептококком), антистреплаза и стафилокиназа (продуцируемая золотистым ста филококком). Первые два — фармакологические тромболитические средства, применяемые для лечения острого тромбоза.
Ингибиторы плазмина — а2-антиплазмин — основной ингиби тор гшазмина в крови и сс2-макроглобулин — ингибитор плазмина, калликреина и тканевого активатора плазминогена.
Ингибиторы активатора плазминогена 1, 2, 3 — ограничивают фибринолитическую активность местом расположения гемостатической пробки за счет ингибирования ТАЛ или урокиназы (см. рис. 5.1.3).
Р и с . 5.1.3. Схема фибринолитической системы
72
В связи с действием ингибиторов обычные сгустки крови, по лученные в результате ее естественного свертывания в пробирках, подвергаются в нормальных условиях очень слабому лизису, кото рый определяется методом исследования естественного лизиса сгустка. В отличие от этого, эуглобулиновый лизис происходит бы стро, т. к. при выделении эуглобул и новой фракции плазминоген и его активаторы выпадают в осадок, тогда как ингибиторы фибринолиза остаются в надосадочной жидкости. Таким образом, инги биторы лизиса удаляются, и определяется только активность плаз мина и его активаторов.
Плазмин вызывает расщепление фибрина (см. рис. 5.1.3), в ре зультате чего сначала остается крупномолекулярный фрагмент X, затем он расщепляется на фрагменты Y и D, а фрагмент Y — на D и Е. Фрагменты X и Y называются ранними, а фрагменты D и Е — поздними. В норме содержание в сыворотке продуктов деградации фибриногена (ПДФ) менее 0,05 г/л. Повышение ПДФ свидетель ствует об активации фибринолиза.
Клеточная фибриполитическая система связана с лейкоцита ми, макрофагами, эндотелиоцитами и тромбоцитами. Наряду с влиянием эстераз и других протеаз, лейкоциты и макрофаги фаго цитируют разрушенный фибрин и клеточные остатки.
Первичное повышение фибринолиза в организме — это край не редкое явление. В подавляющем большинстве случаев оно сви детельствует об активном процессе свертывания. Связано это либо с ДВС-синдромом, либо с массивными тромбоэмболиями. Поэто му повышение ПДФ расценивается как показатель внутрисосудистой гемокоагуляции и вторичной активации фибринолиза (рис. 5.1.3). Продукты, образующиеся в результате фибринолиза, био логически активны и оказывают влияние на проницаемость и то нус кровеносных сосудов, ингибируют агрегацию тромбоцитов и самосборку мономеров.
5.2. Лабораторный мониторинг системы гемостаза
Первичный (сосудисто-тромбоцитарный) гемостаз.
Количество тромбоцитов (норма 180—320 •109/л).
Тромбоциты представляют собой кровяные пластинки разме ром 2—4 мкм, содержащие грануломер и гиаломер. Подсчет тромбоцитограммы позволяет оценить процентное содержание юных, зрелых и старых тромбоцитов. В норме 91—98% в тромбоцитограмме — зрелые тромбоциты. Юные и старые — от 0—3%. При патоло гии встречаются формы раздражения — гигантские (овальные,
73
или колбасовидные тромбоциты, которые почти все заняты грануломером, а гиаломер представлен лишь узкой полоской). Такие тромбоциты иногда появляются при новообразованиях: морфоло гическое исследование тромбоцитов с помощью светового и элек тронного микроскопов позволяет выяснить структурные измене ния тромбоцитов (в частности отсутствие грануломера), что ука зывает на наличие тромбоцитопатий.
Время кровотечения.
Существует несколько методов определения времени кровоте чения. Все они состоят в измерении времени от момента нанесе ния стандартного повреждения кожи до остановки вызванного им кровотечения из мелких подкожных сосудов. Время кровотечения удлиняется при падении числа тромбоцитов ниже 100 • 109/л, либо при функциональном дефекте. Метод Дъюка: надрезы наносятся ланцетом у наружного края мочки уха или пальца глубиной 3,5 мм. Ширина прокола около 3 мм. Сразу же после прокола включают секундомер и фильтровальной бумагой промокают капельки кро ви через 15—30 с, норма 2—4 мин.
Метод Айви: на плечо накладывают манжету сфигмоманометра и в течение всего исследования поддерживают в ней давление = 40 мм/рт. ст. На верхней трети предплечья наносят ланцетом 3 поперечных прокола глубиной в 3 мм. Тест более чувствителен и точен, чем проба Дъюка, и определяет время кровотечения при повышенном венозном давлении. Нормальное время кровотече ния по Айви обычно не превышает 7 мин.
Исследования адгезивной функции тромбоцитов при контакте со стеклом.
Кровь непосредственно из вены просасывается через поливи ниловую трубку, заполненную стеклянными шариками, после чего в ней определяется убыль тромбоцитов по сравнению с кровью, не прошедшей через такой фильтр. Разница между этими показа телями, выраженная в %, отражает степень адгезии (норма 20— 40%). Снижение ее наблюдается при врожденных (наследствен ных) и симптоматических тромбоцитопатиях в сочетании с раз личными нарушениями агрегационных функций (тромбастения, уремия, лейкозы и т. д.), либо без них (болезнь Виллебранда).
Своевременная диагностика тромбоцитопатий требует развер нутого изучения агрегации тромбоцитов под влиянием следую щих агентов: коллагена, АДФ, адреналина, малых доз тромбина, ристоцетина. При графической регистрации процесса агрегации на агрегографе определяется двухволновая кривая, в которой вто рая волна связана с выходом из тромбоцитов эндогенных стиму ляторов агрегации — АДФ, катохоламинов, тромбоксана и др. Это
74
вторая волна характеризует реакцию высвобождения. Ее нет при отсутствии в тромбоцитах плотных гранул. Начало агрегации с мо мента добавления стимулятора агрегации в норме — 11—17 мин.
Полное отсутствие или резкое снижение агрегации тромбоци тов наблюдается при различных видах качественной неполноцен ности тромбоцитов. Изолированное нарушение ристоцетин-агре- гации наблюдается в основном при болезни Виллебранда. Это на рушение обусловлено отсутствием в плазме фактора Виллебранда, в силу чего ристоцетин-агрегация нормализуется после добавле ния нормальной плазмы (в отличие от болезни Бернара-Сулье, где дефектны сами тромбоциты).
При атеросклерозе, нарушениях коронарного и мозгового кро вообращения, сахарном диабете, гиперлипидемиях и других забо леваниях с повышенным тромбогенным риском может наблюдать ся чрезмерно высокая АДФ-агрегация тромбоцитов.
Определение ретракции кровяного сгустка.
Принцип основан на определении объема ретрагируемой сы воротки в пробирке. Объем сыворотки, оставшейся после наступ ления полного свертывания крови, равен 50—75%.
Недостаточная ретракция сгустка наблюдается при выражен ных тромбоцитопениях, при неполноценности тромбоцитов, из бытке тромбоцитов и увеличении гематокритного показателя.
Для того чтобы иметь представление о причинах тромбоцитопений, необходимо исследовать состояние родоначальних кле ток тромбоцитов-мегакариоцитов. Исследование мегакариоцитарного аппарата важно для разграничения гипо- и апластических тромбоцитопений, обусловленных интенсивной гибелью кровя ных пластинок, при которых имеется гиперплазия мегакариоцитарного ростка. Оценка состояния мегакариоцитарного ростка про водится путем исследования пунктатов костного мозга и гистоло гически с помощью трепанобиопсии. В пунктате костного мозга около 0,2% мегакариоцитов.
Каждый зрелый мегакариоцит образует около 3—4 тыс. тром боцитов. Количество мегакариоцитов значительно снижается при так называемых г и п оре генератори ых тромбоцитопениях (гипо- и аплазии костного мозга, лейкозы, опухоли костей, дефицит тромбопоэтина). Количество мегакариоцитов резко снижается, тогда как при всех иммунных тромбоцитопениях и формах, обуслов ленных депонированием тромбоцитов (спленомегалия, гигантс кие гемангиомы, массивное тромбообразование), отмечается вы раженная гиперплазия мегакариоцитарного аппарата. Резкое уве личение этих клеток отмечается при миелопролиферативных заболеваниях (эритремии, геморрагической тромбоцитемии и др.).
75
Определение резистентности капилляров.
Снижение резистентности капилляров к механическим воздей ствиям может быть обусловлено неполноценностью стенок микро сосудов, связанной с инфекционно-токсическими влияниями (сеп сис, сыпной тиф и др.), с гиповитаминозом, эндокринными нару шениями (менструальный период, патологический климакс). Но чаще всего оно наблюдается при выпадении ангиотрофической функции тромбоцитов. Методы исследования резистентности капилляров не достаточно точны и стандартизированы. Чаще всего в клинике ис пользуются манжеточная проба (Borchgrevik). Внутрисосудистое дав ление повышают путем дозированного сдавливания плеча манжет кой сфигмоманометра (90—100 мм рт. ст.) в течение 5 мин. Манжетку снимают и ждут 5 мин. После чего подсчитывают количество петехий на ладонной поверхности предплечья в круге (d — 5 см). Норма
— до 5 петехий, 15—10 проба — слабоположительная, 10—20 — положительная, 20 и больше — резко-положительная.
Вторичный (коагуляционный) гемостаз.
Оценка I фазы свертывания крови — образования протромбиназы.
Время свертывания крови по Lee, White. Этот тест отражает весь процесс свертывания и выявляет только значительные сдвиги в системе гемокоагуляции (норма 5—10 мин.). Укорочение времени свертывания свидетельствует о гиперкоагуляции, а удлинение, напротив — о гипокоагуляции.
Активированное парциальное тромбопластиновое время (АПТВ).
Принцип метода заключается в определении времени свертыва ния цитратной плазмы при добавлении Са2+ в условиях стандарт ной активации процесса свертывания каолином и кефалином. АПТВ удлиняется при дефиците плазменных факторов, участвующих во внутреннем механизме свертывания крови, либо при избытке в плазме антикоагулянта. Укорочение АПТВ указывает на активацию свертывания крови.
Аутокоагуляционный тест. Стандартизированная методика, от ражающая динамику нарастания, а затем инактивацию тромбиновой активности в исследуемой крови. Стандартизация начальной фазы процесса свертывания крови достигается использованием гемолизата эритроцитов исследуемого. Немедленно после взятия кровь стабилизируется цитратом натрия, после чего 0,3—0,5 мл ее отливают в отдельную пробирку для приготовления гемолизаткальциевой смеси. Остальную кровь для получения плазмы цент рифугируют при 1500 об/мин. 10 мин. Затем плазму разливают по 0,2 мл в 10 пробирок и помещают в водяную баню при 37°С; для приготовления гсмол изат-кальциевой смеси в отлитую кровь до бавляют СаС12. В каждую из пробирок с плазмой, находящейся в
76
водяной бане, добавляют по 0,2 мл полученной гемолизаткальциевой смеси, последовательно через 2, 4, 6, 8, 10, 20, 30, 40, 50, 60 мин. от момента приготовления смеси. В каждой пробирке опре деляют время свертывания плазмы. Полученные результаты в се кундах переводятся в процентные показатели по таблице. По дан ным АКТ вычерчивают аутокоагулограмму. Восходящая часть кри вой АКТ отражает динамику нарастания и максимальную активность тромбо-пластина и тромбина в исследуемой крови. Нисходящая часть кривой характеризует скорость и интенсивность инактивации тромбина за счет действия ATIII и продуктов фибринолиза.
Таким образом АКТ дает представление о состоянии как прокоагулянтного, так и антикоагулянтного звеньев свертывающей системы.
Чтение результатов: А — свертывающая активность на 2-й ми нуте инкубации (в норме 15,4%). Максимальная активность — МА (100%). Т — время достижения 1/2 МА (3,7 мин), Т2— время достижения МА (10 мин). Время удлиняется при дефиците плаз менных факторов, участвующих в свертывании. Время свертывания на 10-й мин. — 10 секунд.
На показаниях АКТ отражается активность XII, XI, IX, VIII, X, V, и II факторов, а также действие прямых антикоагулянтов и не отражается снижение активности VII фактора, участвующего во внешнем механизме образования протромбиназы.
Оценка II фазы свертывания — образования тромбина: опреде ление протромбинового индекса (ПТИ) по A. J. Qwick (1935), отра жающего активность факторов протромбинового комплекса (II, VII, IX, X): в цитратную плазму, инкубированную с тромбопластином, добавляется раствор СаС12 и определяется время до обра
зования |
сгустка |
фибрина в секундах. Затем высчитывался ПТИ |
в %. По |
данным литературы нормальные значения находятся в |
|
пределах от 85 до |
110%. |
|
Удлинение протромбинового времени или снижение протром бинового индекса при нормальном содержании в плазме фибри ногена и нормальном тромбиновом времени наблюдается при де фиците К-витаминозависимых факторов свертывания, который развивается при следующих нарушениях:
—недостаточное образование в кишечнике витамина К — эн тероколиты с профузными поносами, кишечные дисбактериозы, геморрагическая болезнь новорожденного;
—недостаточное всасывание витамина К из-за отсутствия жел чи в кишечнике при механической желтухе;
—нарушение синтеза К- витаминзависимых факторов в печени при лечении непрямыми антикоагулянтами;
—нарушение синтеза факторов протромбинового комплекса в
77
печени при тяжелых поражениях ее паренхимы — острой дистро фии печени, гепатитах, циррозах, паразитарных поражениях; при этом нарушается также синтез других факторов свертывания, ко торые вырабатываются печенью.
При достаточном содержании факторов протромбинового ком плекса для превращения протромбина в тромбин (удлинение протромбинового времени или снижение ПТИ при одновремен ном удлинении тромбинового времени) действие последнего на фибриноген замедляется под влиянием антикоагулянтов, в ос новном — гепарина, при очень низком содержании фибриногена
вплазме (ниже 1 г/л).
III фаза свертывания крови (образование фибрина) оценивает ся гравиметрическим методом определения количества фибри ногена в плазме (унифицированный метод по Р. А. Рутберг, 1961). К плазме добавляется раствор СаС12, после свертывания фибри ногена его высушивают и взвешивают. Нормальные показатели по данным литературы — от 2 до 3,5 г/л.
Гипофибриногенемия наблюдается: 1) при нарушении синтеза фибриногена — при болезнях печени; 2) при остром ДВС-синд- роме в результате усиленного потребления (гипофибриногенемия не развивается, если была исходная гиперфибриногенемия); 3) при врожденных а- или гипофибриногенемиях; 4)г при дисфибриногенемиях.
При снижении уровня фибриногена ниже 1 г/л может возник нуть кровотечение.
Гиперфибриногенемию вызывают: 1) многие острые и под острые воспалительные, иммунные и деструктивные процессы (пневмо нии, ревматизм, ревматоидный артрит, гломерулонефрит, инфаркт миокарда и т.д.); 2) хронические и подострые формы ДВС-синд- рома, особенно инфекционно-септического генеза; 3) беремен ность, гестоз.
Врезультате гиперфибриногенемии резко увеличивается СОЭ, вязкость крови, но не усиливается гемокоагуляция.
Для выявления продуктов паракоагуляции, свидетельствующих об интенсивной внутрисосудистой коагуляции, проводятся следу ющие тесты:
Этаноловый тест (по H.Godal et al., 1971), в модификации В. Г. Лычева (1975) с добавлением 50% этанола. Положительный тест (появление желеобразной субстанции или сгустка через 10 мин.) свидетельствует о наличии в исследуемой плазме несвертываемых тромбином комплексов: фибрин-мономеров с ПДФ и самим фиб риногеном. Эти продукты появляются при ДВС-синдроме или ло кальном внутрисосудистом свертывании крови, сопровождающемся лизисом фибрина.
78
Протаминсульфатный тест по Z. Latallo (1971), в модификации В. Г. Лычева (1975) проводится путем добавления к цитратной бестромбоцитной плазме протамин-сульфата. Положительный тест (образование сгустка или геля) свидетельствует о наличии в плаз ме неполимеризующихся (заблокированных) фибрин-мономер ных комплексов. Их увеличение отмечается при интоксикации организма и ДВС-синдроме.
Определение РФМК в плазме проводится орто-фенантроли- новым тестом по В. А. Еламыкову, А. П. Мамоту (1987). Появление в плазме хлопьев в течение первых 2 мин. после добавления к ней раствора орто-фенантролина свидетельствует о наличии раствори мых высокомолекулярных фибрин-мономерных комплексов. Ско рость образования хлопьев зависит от концентрации РФМК, что позволяет оценивать количество РФМК в эквиваленте фибринмономера. В норме показатели этого теста — не больше 3 — 4 мг/ 100 мл или 3 — 4 г/л - Ю-2 (В. Г. Лычев,1998).
Положительные тесты паракоагуляции свидетельствуют о те чении ДВС-синдрома или массивных тромбозах на ранних этапах развития процесса.
Антикоагулянтная система.
Используется унифицированный метод определения толеран тности плазмы к гепарину (по F. Gormsen, 1959), основанный на изменении времени рекальцификации плазмы после внесения в нее гепарина. Если после введения гепарина резко увеличивается время образования сгустка, значит толерантность плазмы к гепари ну понижена, и наоборот, если гепарин замедлял свертывание плаз мы незначительно, толерантность плазмы к гепарину была повыше на. Этот тест отражает состояние общей коагуляционной активности крови и содержание в плазме крови антитромбина-Ш (АТ-Ш). Нор мальные показатели у здорового человека — 11—16 мин. (В. П. Балуда с соавт., 1980). Толерантность плазмы к гепарину снижается до 20 мин. при любом дефиците факторов коаіуляции, особенно факторов протромбинообразования, а также при тромбоцитопении, повышении антикоагулянтной активности крови, после введения гепари на, когда у больного достаточно АТ-Ш. Повышение толерантно сти плазмы к гепарину до 1 — 9 мин. всегда свидетельствует либо о внутрисосудистом свертывании (появлении в кровеносном русле
активированных факторов коагуляции), либо о |
циркуляции в кро |
ви тканевого тромбо-пластина, связывающего |
гепарин, либо об |
истощении расходуемого на внутрисосудистое |
свертывание крови |
АТ-Ш или его врожденном недостатке. Для исследования больных с гипокоагуляцией этот тест применяться не должен.
79
