
Неотложные состояния и анестезия в акушерстве_Лысенков С._2004
.pdfна пациента. Определение «антипиринового пространства» больше представляет академический интерес, так как внедрение его в практическую медицину ограничивается трудоемкостью метода.
Для практикующих реаниматологов возможно представит ин терес клинический тест, предложенный П. И. Шелестюком (1978),
позволяющий ориентировочно оценить степень гидратации. Тест проверяется следующим образом. В область передней поверхно сти предплечья внутрикожно вводят 0,25 мл 0,85% раствора хло рида натрия (или раствора Рингера) и отмечают время до полно го рассасывания и исчезновения волдыря (для здоровых людей оно равно 45—60 минутам). При I степени дегидратации время рассасывания составляет 30—40 минут, при II степени — 15—20 минут, при III степени — 5—15 минут.
Определение объема циркулирующей крови.
Большое распространение в специализированных лечебных уч реждениях, научно-исследовательских институтах нашли методы с радиоизотопами. Однако необходимо заметить, что методы с использованием радиоизотопов представляют академический ин терес и не используются из-за лучевой нагрузки.
Определение объема циркулирующей крови с помощью красителя Т-1824 (синий Эванса) сохранил свою актуальность и сегодня. Главное преимущество — отсутствие вредности для боль ного и врача и минимальное количество необходимой аппаратуры. Метод обладает хорошей воспроизводимостью.
При введении в кровь синий Эванса прочно связывается с бел ками плазмы, в основном с альбумином; с фибрином и эритроци тами он не связывается, с лейкоцитами — слабо. Краситель выво дится печенью с желчью, адсорбируется ретикуло-эндотелиальной системой и частично попадает в лимфу. В дозах, превышающих ди агностические (0,2 мг/кг массы тела), может вызвать окрашивание склер и кожи, исчезающее через несколько недель. Для внутривен ного введения готовят раствор из расчета 1 г на 1000 мл физиоло гического раствора. Полученный раствор стерилизуют автоклавированием. Определение концентрации красителя возможно на лю бом фотоэлектроколориметре (ФЭК), либо спектрофотометре. При работе с ФЭК берут кюветы емкостью 4 или 8 мл и определением на красном светофильтре. При работе со спектрофотометром ис пользуют кюветы 4 мл и определение на длине волны 625 nm.
Прежде чем приступить к определению, необходимо постро ить калибровочную кривую. Для этого готовят ряд разведений от 10 до 1 мкг в плазме, принимая во внимание то, что 1 мл исход ного раствора содержит 1000 мкг красителя. По полученной ка либровочной кривой устанавливается истинная концентрация кра сителя в крови у пациента.
102
Для определения ОЦП шприцем вводят раствор красителя внут ривенно из расчета 0,15 мл/кг массы. Для удобства расчета общую дозу можно округлять (к примеру, взять не 8,5 мл, а 9,0 мл). Через 10 минут (период перемешивания индикатора) из вены другой руки берут кровь в пробирку с 3 каплями гепарина. Взятую кровь центрифугируют в течение 30 мин при 3000 об/мин, плазму (или сыворотку) отсасывают и проводят определение оптической плот ности. По калибровочной кривой устанавливают концентрацию красителя в плазме, объем которой находят путем деления коли чества вводимого красителя на его концентрацию. Общий объем крови определяется исходя из показателя гематокрита.
Чтобы уменьшить объем забираемой у пациента крови, плазму можно разводить вдвое физиологическим раствором.
Полученные результаты объема циркулирующей крови дан ным методом составляют: для женщин — 44,72 ± 1 , 0 мл/кг (для мужчин — 45,69+1,42 мл/кг). Причинами ошибок данного метода могут быть: присутствие жира в плазме, введение части красителя под кожу, выраженный гемолиз эритроцитов. По возможности этих ошибок следует избегать.
Метод определения ОЦК с помощью декстрана недостаточно точен и дает очень приблизительные результаты.
Общими недостатками описанных методов являются следую щие: при нарушениях центральной и периферической гемодина мики время перемешивания индикатора в сосудистом русле мо жет сильно варьировать. Особенно этот процесс зависит от состо яния микроциркуляции в органах и тканях. Кроме того, в условиях нормы (к примеру, в печени) и особенно патологии (выраженные степени гипоксии) нарушается проницаемость сосудистой стенки различных регионарных зон для белка. Часть белка уходит из сосу дистого русла, что дает завышенные результаты ОЦК.
Н. М. Шестаков (1977) предложил бескровный метод опреде ления ОЦК при помощи интегральной реографии. Автор доказал в эксперименте, а также в клинике, что интегральное сопротивле ние тела находится в обратной зависимости от ОЦК. Им была предложена следующая формула для определения ОЦК:
ОЦК (л)=770/Я,
где R — сопротивление (Ом). Самым главным преимуществом этого способа является его неинвазивность и возможность опреде лять ОЦК неоднократно.
С практической точки зрения представляет интерес методика, предложенная В. Е. Грушевским (1981). Основываясь на установ ленной закономерности между ОЦК и показателями гемодинами-
103
ки им предложена формула и номограмма для определения ОЦК по клиническим признакам (ОЦКкл в процентах к должному ОЦК):
ОЦКкл = 5{2,45[А(6-Т) + В(6-2Т)] + Т + 8}, где А — отношение среднего артериального давления (АДср)
кнормальному возрастному АДср;
В— отношение центрального венозного давления (ЦВД) к нормальному ЦВД;
Т— степень растяжимости сосудистой стенки, определяемая по сроку исчезновения белого пятна, возникающего при славле ний ногтевого ложа пальцев кисти (с).
Предложенные номограммы позволяют рассчитать должные показатели гемодинамики для больных различного возраста.
Гематокритный метод Филлипса-Пожарского основан на том, что чем меньше объем крови у больного, тем больше снижа ется показатель гематокрита после введения полиглюкина. Эта зависимость выражается математическим уравнением:
|
Ht2 |
|
ОЦК = V * Ht, - Ht, |
где V |
— объем введенного полиглюкина; |
HtL |
— исходный гематокрит; |
Ht2 |
- гематокрит после введения полиглюкина. |
Ход определения. До начала инфузии у больного определяют венозный гематокрит (Htj). Затем вливают струйно за 5 минут 0,2— 0,3 л полиглюкина, после чего продолжают его инфузию со скоростью не болееЗО кап/мин и через 15 минут от начала инфу зии вновь определяют венозный гематокрит (Ht^). Подставляют полученные данные в приведенную выше формулу и получают фактический ОЦК (фОЦК). Чтобы определить дефицит ОЦК, не обходимо узнать должный ОЦК. Для этого используется номог рамма Лайта . В зависимости от наличия исходных данных дОЦК можно определить: по росту (колонка а); по массе тела (колонка в) или по росту и массе одновременно (рост находят по колонке «а», массу — по колонке «в», найденные точки соединяют прямой линией, в месте пересечения ее с колонкой «в» находят дОЦК). Из дОЦК вычитают фОЦК и находят дефицит ОЦК, соответству ющий кровопотере.
Из расчетных методов определения ОЦК нужно указать на метод Сидоры (по весовой части, гематокриту, массе тела), метод опреде ления глобулярного объема по номограмме Староверова с соавт., 1979, определение ОЦК по гематокриту и массе тела с помощью номографа Покровского (Л. В. Усенко, 1983).
При отсутствии информации о динамике веса больного, не возможности определения объемов жидкости методом разведения
104
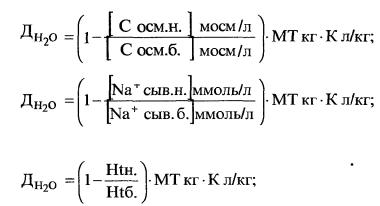
индикаторов можно воспользоваться расчетными показателями и
формулами дефицита воды в организме:
где: ДН7 0 — дефицит воды в литрах,
Сосм.н. — нормальная осмотическая концентрация сыворотки,
Сосм.б. — осмотическая концентрация сыворотки больного, Na+ сыв.н. — нормальная концентрация натрия в ЭЦЖ (в сы
воротке), |
|
|
|
Na+ сыв.б. |
— концентрация натрия |
в сыворотке больного, |
|
Ht н. |
— нормальная величина гематокрита для данного воз |
||
раста, |
|
|
|
Ht б. |
— гематокрит больного, |
|
|
К — коэффициент, величина которого |
указывает количество |
||
общей воды тела в 1 л/кг массы тела (МТ). |
|
||
Величину коэффициента можно взять постоянной для всех воз растов — 0,6 л/кг.
Вполне понятно, что такой подход к оценке дефицита жидко сти в организме весьма приблизительный, но в сочетании с дру гими методами, клинической картиной, может успешно исполь зоваться в практике интенсивной терапии.
Описанные методы, к сожалению, не дают представления об изменениях ОЦК в реальном масштабе времени, что особенно важно для реаниматолога при проведении коррекции. В этом отно шении все большее внимание привлекают современные компью теризированные системы для определения ОЦК. Так, НПО «Эльф» (г. Саратов) разработала серию приборов: «Д-индикатор», «Инди катор ДЦК» (индикатор дефицита циркулирующей крови), рабо тающие совместно с любым IBM-совместимым компьютером и позволяющие всего за 3 минуты определить гематокрит, ОЦК в % и мл, вычислить дефицит ОЦК от должного. Малые объемы крови (1,5—3 мл) позволяют контролировать динамику ОЦК, что очень важно для тактики инфузионной терапии.
105
Глава 7
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
ИСПОСОБЫ ЕГО ОПРЕДЕЛЕНИЯ
7.1.Физиология кислотно-основного состояния
Врезультате жизнедеятельности клетки в ней постоянно обра
зуются кислоты, которые диссоциируют с освобождением очень активных ионов Н+. Часть этих ионов нейтрализуется буферной системой клетки, другая — буферными системами межклеточной жидкости и крови, а также физиологическими системами легких, почек, кишечника, печени и др. Соотношение водородных и гидроксильных ионов во внутренней среде в значительной мере оп ределяет интенсивность окислительно-восстановительных процес сов, синтеза и расщепления белков, жиров и углеводов, актив ность ферментов, проницаемость мембран, чувствительность к гормональным стимулам и др. Это соотношение выражается в ин тегральном показателе рН. Учитывая, что показатель рН часто встречается в медицинской литературе, мы ладим ему более под робную характеристику.
Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода. Это характеризуется показате лем рН, представляющих собой отрицательный десятичный лога рифм молярной концентрации ионов Н+: для нейтральной среды рН = 7,0, т. е. содержание ионов Н+ [Н+] равно 107 моль/л. Если кислотность раствора увеличивается, то рН его снижается. Для биологических объектов важна не сама концентрация Н+ ионов, а электрический потенциал ионов (рН). Именно от него зависит возбудимость рецепторов, участвующих в поддержании кислот но-основного равновесия. Когда речь идет о рН крови, то следует подразумевать рН плазмы (7,37—7,43; в среднем 7,40). Дело в том,
106
что известные способы измерения этого показателя в крови опре деляют этот показатель не в эритроците, а в плазме: рН в эритро ците измерить довольно сложно, однако показано, что рН эритро цита составляет 7,28—7,29.
Отдельно следует отметить, что в связи с развитием реанима тологии клиницисты и экспериментаторы столкнулись с ситуаци ями, когда рН крови непосредственно после реанимации состав лял 6,8. Несмотря на это, отмечались благоприятные исходы. Вполне естественно задать вопрос — чем обеспечивается постоянство рН? Это обеспечивается эффективными системами организма по их нейтрализации и выведению: 1) разведением (перераспределени ем и транспортировкой ионов из места их образования); 2) буферированием: физико-химическим, гомеостатическими — карбонатной, фосфатной, гемоглобиновой, белковой буферны ми системами, обменными процессами; 3) физиологическими го меостатическими механизмами, которые обеспечиваются функ циями легких и крови, почек, желудочно-кишечного тракта, пе чени, кожи. Наиболее быстро рН регулируется первыми двумя факторами, но после этого всегда еще остаются небольшие физио логические изменения рН, необходимые для того, чтобы вклю чить физиологические механизмы регуляции.
Принцип работы химических буферных систем заключается в сле дующем. Химические буферные системы обладают способностью принимать или отдавать ионы водорода. В этом и заключается их демпферирующий эффект. При избытке водородные ионы связы ваются с анионами с образованием слабой кислоты. Если схема тично обозначить Н+ как ион водорода, а А- как анион, то Н++А будет кислота, сила которой определяется способностью к диссо циации, т. е. степенью, с которой реакция НА = Н++А_ смещается вправо. Водород проявляет кислотные свойства только в ионной форме. Чисто химическое буферирование осуществляют бикарбонатная и фосфатная системы и белки плазмы. К ним можно отне сти и эритроцитарную гемоглобиновую буферную систему. Пос ледняя, принимая участие в химической регуляции, тоже прояв ляет свое действие в физиологических и гомеостатических механизмах.
Особое место среди буферных систем крови и тканей занимает
карбонатная буферная система. Она состоит из углекислоты Н2С03
и гидрокарбоната натрия NaHC03. Отношение NaHC03 к Н2С03 при рН крови 7,4 составляет 20:1. Оба химических соединения име ют общий гидрокарбонатный ион НС03~. Большая часть гидрокар бонатных ионов освобождается при диссоциации NaHC03. Ион, высвобождаемый из соли, подавляет диссоциацию слабой уголь ной кислоты. Механизм буферного действия заключается в том, что
107
при поступлении в кровь большого количества кислых продуктов, т. е. Н+, образуется слабодиссоциирующая угольная кислота:
(H2C03/NaHC03) + Н+А- - 2Н2СОэ + Na+A"
Наблюдается увеличение кислотной части и уменьшение ос новной части. Если в крови увеличивается количество сильных оснований (ОН~ и др.), то они реагируют с угольной кислотой с образованием воды и ионов гидрокарбоната:
(H++HC03/NaHC03) +Na+ + ОН" = 2NaHC03+H20
Происходит изменение буферной системы с увеличением ее основной части и уменьшением кислотной. Изменение соотноше ния в буферной системе приводит к изменению рН менее выра женному, чем если бы вводимые кислоты и основания в организ ме не вступали во взаимодействие с буферными системами. Бу ферная емкость карбонатной системы составляет 7 — 9% от общей буферной емкости, однако она является хорошим индикатором кислотно-щелочного баланса.
Фосфатная буферная система (1% буферной емкости кро ви) состоит из фосфорно-кислых солей: кислотная часть пред ставлена в виде однозамещенного фосфата натрия NaH2P04, а основная часть представлена двузамещенным фосфатом натрия
— Na2HP04. Одноосновные фосфатные соли являются слабыми кислотами, а двухосновные соли имеют ясно выраженную ще лочную реакцию. Принцип действия фосфатного буфера анало гичен карбонатному. Непосредственная роль фосфатного буфера в крови небольшая, но ему принадлежит значительная роль в конечной регуляцией кислотно-основного гомеостаза и регуля ции активной реакции тканей. В крови действие этого буфера сводится к поддержанию и воспроизводству карбонатного буфе ра. При увеличении в крови кислот и образовании Н2С03 проис ходит обменная реакция:
Н+ + НСО - + Na9HP04 = NaHCO, + NaH7PO
3 |
2 |
4 |
3 |
2 s |
Избыток Н 2 С0 3 |
ликвидируется, |
а концентрация Н С 0 3 |
||
увеличивается. Таким образом, удерживается соотношение Н2С03: NaHC0 3 = 1:20 на постоянном уровне.
Буферные свойства белков проявляются благодаря их способ ности в кислой среде связывать ионы водорода, а в щелочной — отдавать их.
Характер диссоциации зависит от природы белка и реакции среды. При щелочной реакции крови белки диссоциируют с обра зованием Н+ и образуют соли с щелочами (протеинаты), при закислении среды они отдают эту щелочь. Белковая буферная систе ма в сравнении с карбонатной относительно невелика.
108
Наибольшая буферная емкость крови (75%) приходится на гемоглобиновый буфер. Он в 9 раз сильнее, чем гидрокарбонатный. Буферные свойства, гемоглобина обусловлены возможностью вза имодействия Н+ ионов с калиевой солью гемоглобина, в резуль тате которого образуется соответствующее количество калиевой соли гемоглобина и свободного гемоглобина. Свободный гемогло бин проявляет свойства очень слабой органической кислоты. За счет этого может связываться большое количество Н+ ионов, при чем у солей гемоглобина эти свойства сильнее, чем у оксигемоглобина. Таким образом, гемоглобин (НЬ) является более слабой органической кислотой, чем НЬО. В связи с этим в тканевых ка7 пиллярах диссоциация НЬО сопровождается освобождением до полнительного количества оснований, способных связывать угле кислоту. Оксигенация гемоглобина приводит к вытеснению Н2С03 из гидрокарбоната.
На уровне эритроцит-плазма крови—ткань происходят следу ющие физиологические процессы.
В результате тканевого дыхания освобождается С02, Н2 0 и Н+, которые поступают в интерстициальную жидкость и плазму крови. В каждой из систем, начиная уже с внутриклеточной среды, про исходит буферирование кислых валентностей химическими буфер ными системами. С02 в силу парциального давления проникает в эритроцит. В эритроците содержится фермент карбангидраза, ко торый катализирует реакцию:
Ш2 + н2о = н2со3
Н2С03 диссоциирует на Н+ и НС03_; Н+ ионы водорода остают ся в эритроците и связываются буферными системами гемоглобина. Излишки НС03~ покидают эритроцит, а в плазме крови от белков и от двузамещенных фосфатов к этим анионам переходит натрий. При этом в белках и в фосфатной системе освобождается место для Н+, т. е. уже здесь на этом уровне эритроцитарный буфер поддержи вает химические буферные системы, в частности, фосфатную и белковую. В силу правила Доннана (отношение концентрации ионов, способных проходить через мембрану, должны быть равны по обе стороны мембраны), СО входит в эритроцит, а натрий остается в плазме, поскольку мембраны эритроцитов для них практически непроницаемы. Создающийся избыток натрия, соединяясь, электронейтрализует избыток НС03~, образуя основную — бикарбо- натную-буферную систему крови, восполняя ее убыль, возника ющую в венозной крови и поддерживая рН.
Коль скоро речь идет о поведении эритроцита в венозной кро ви, то необходимо сказать, что из эритроцита выходит 02. Комп лекс КНЬС02 в эритроците теряет К+; 02Нв присоединяет кислые
109
валентности и СО,, превращаясь в Н-НЬС02. Калий нейтрализует хлор (КС1) и Н2С03 (КНС03). Описанная фракция крови, эритро цит-плазма крови, где происходили вышеописанные превраще ния артериальной крови в венозную, через 1 с уходит из тканевых капилляров и через несколько секунд приходит к легким. Если не разделять кровь схематично на отдельные эритроциты, то речь идет о венозной крови, поступающей в легочные капилляры, где про исходит выведение С02 и оксигенация крови.
На уровне легочных капилляров в системе эритроцит—плаз ма крови — ткань происходят противоположно направленные про цессы.
Углекислый газ диффундирует в 20 раз интенсивнее кислоро да. Переход углекислого газа из крови в альвеолярный воздух объяс няется имеющимися здесь градиентом рС02. Облегчается этот про цесс двумя механизмами: переходом НЬ в НЬО (образующаяся более сильная кислота вытесняет углекислый газ из крови) и дей ствием карбангидразы. Количество углекислого газа, выводимого из легких, зависит прежде всего от амплитуды и частоты дыха тельных движений, а параметры дыхания преимущественно регу лируются содержанием углекислоты и рН крови.
С02 выходит из эритроцитов плазмы в альвеолярный воздух. В эритроцитах от белков гемоглобина отщепляются Н+ионы, а из плазмы в эритроцит заходят анионы НС03~, карбангидраза ката лизирует реакцию:
Н+ + нсо3 =>н2со3«=>н2о + со2Т
В плазме крови в это время освободившийся натрий из карбо натной системы возвращается на фосфатную и белковую буфер ные системы. Хлор выходит из эритроцита. В эритроците при насы щении гемоглобина кислородом образуется комплекс КНЬО (ар териальная кровь).
Обменные процессы весьма существенно способны менять кислотно-основной баланс. Щелочи могут нейтрализоваться мо лочной кислотой, образование которой резко стимулируется при сдвиге рН тканей в щелочную сторону. Неорганические кислоты могут быть нейтрализованы солями калия, натрия, аммиаком с образованием аммонийных солей. Органические кислоты могут соединяться с продуктами белкового обмена. К примеру, образу ющаяся молочная кислота может ресинтезироваться в гликоген, а кетоновые тела — в высшие жирные кислоты. Окислительно-вос становительные процессы в клетке, сопровождаясь накоплением Н+ внутри ее, требуют постоянного выведения Н+ из клеток в межклеточное пространство. Этим во многом определяется мемб ранный потенциал клетки и многие электрофизиологические ха-
110
рактеристики. Ион Н+ выходит из клетки в обмен на ион К+, кото рый проходит мембрану клетки в комплексе глюкозо-фосфата. Параллельно этому из клетки удаляется также ион Na+, который нейтрализует во внеклеточном пространстве выходящие из клет ки ионы Н+. Эти механизмы компенсируют внутриклеточный аци доз и обеспечивают реполяризацию клетки.
Физиологические механизмы регуляции кислотно-основного ба ланса. Несмотря на наличие многочисленных буферных систем в организме, они не способны были стабилизировать сдвиги рН. Для этого необходимы более эффективные механизмы стабилизации. По быстроте и эффективности на первом месте стоит система дыхания. Основная физиологическая роль легких сводится к под держанию нормальной концентрации углекислоты в крови. Физио логическими стимулами к изменению активности дыхательного центра являются рН и рС02. В случае увеличения рС02 и смеще ния рН в кислую сторону соответственно увеличивается вентиля ция легких и выделение С02, буферное соотношение гидрокарбо натной системы выравнивается и концентрация ионов водорода нормализуется. Высокая мобильность системы дыхания объясня ется хорошей диффузной способностью С02 при прохождении через мембраны альвеол. Следует особо отметить, что этот про цесс существенно зависит от количества воды в межуточной тка ни легкого и на поверхности альвеол.
Как показали исследования последних лет, степень гидрата ции может очень эффективно регулироваться центральными не рвными образованиями (преоптической областью гипоталамуса и дорсальными ядрами блуждающего нерва) и уровнем гормонов в притекающей и оттекающей от легких крови. Количество диффун дирующего газа пропорционально его растворимости в слое жид кости. Таким образом, посредством регуляции количества жидко сти в легких может осуществляться регуляция диффузионной спо собности в легких к О, и С02. Установлено, что С02 диффундирует в 20 раз интенсивнее 02. В случае накопления оснований и откло нения рН в щелочную сторону система дыхания отвечает сниже нием легочной вентиляции, что создает условия для повышения концентрации ионов водорода. Эта компенсаторная реакция не совершенна и, вероятно, обеспечивает компенсацию лишь крат ковременно.
Почечная регуляция кислотно-основного гомеостаза осу ществляется следующими основными механизмами:
1)секрецией Н+ ионов в обмен на реабсорбцию натрия;
2)образованием более кислых фосфорных солей (двузамещенные фосфаты превращаются в однозамещенные: Na2HP04 + Н+ = NaH2P04 + Na+, т. е. связывается Н+ ион и освобождается натрий);
111
