
posobia_4semФизика / Квантовая оптика _решебник_
.pdf
|
|
|
|
1 |
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
R |
32 |
|
n2 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Произведем вычисления: |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
9 25 |
1,28 10 6 м |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12,8 10 7 |
||
1,097 |
10 |
7 |
|
1 |
|
1 |
|
1,097 107 25 9 |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
32 |
52 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
= 1,28мкм.
Ответ: = 1,28 мкм.
Рекомендуемое задание № 8
Определить длину волны спектральной линии, соответствующую перех о- ду электрона в атоме водорода с шестой боровской орбиты на вторую (рис. 2). К какой серии относится эта линия, и которая она по сч ёту?
Дано:
m = 2 n = 6
R = 1,097 107 м-1=?
Решение:
Запишем обобщенную формулу Бальмера:
1 |
1 |
|
1 |
|
|
|
|
|
|
|
, |
|
|
|
|||
|
R |
n2 |
|||
m2 |
|
|
|||
где – длина волны спектральных линий в спектре атома
Бора;
m – определяет серию; |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
6 |
||||||||||||||
n – определяет отдельные линии этой серии (m < n); |
5 |
||||||||||||||||||
4 |
|||||||||||||||||||
R – штриховая постоянная Ридберга. |
|
3 |
|||||||||||||||||
|
|||||||||||||||||||
Отсюда длина волны: |
|
|
2 |
||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
. |
|
|
|
|
|
|
|
||
R |
1 |
|
|
|
1 |
|
|
|
|
|
|
|
1 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
орбита |
||
|
|
|
m2 |
|
|
n2 |
|
|
|
|
|
|
Рис. 2 |
||||||
Произведем вычисления: |
|
|
|||||||||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
36 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
4,1 10 7 |
0,41 10 6 м 0,41мкм. |
|||||
|
10 |
7 |
|
1 |
|
1 |
|
1,097 107 |
9 1 |
||||||||||
1,097 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
4 |
36 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Из задачи № 5 – серия Бальмера, т.к. m = 2. По счёту она 4я, т.к. n – m = 6
– 2 =4.
Ответ: = 0,41 мкм, серия Бальмера, по счёту № 4.
Рекомендуемое задание № 9
Найти: 1) период обращения Т электрона на первой боровской орбите атома водорода, 2) его угловую скорость .
91
Дано: |
|
Решение: |
||
|
||||
Z = 1 |
|
|
1) Напишем связь угловой скорости ω с периодом |
|
n = 1 |
|
обращения Т и линейной скоростью υ: |
||
r1 = 52,9∙10-12 м |
|
|
2 |
|
υ = 2,18∙106 м/с |
|
|
|
|
|
|
Т . |
||
1 |
|
|
|
|
1) T =? |
|
|
||
|
|
|
|
|
|
|
|
|
|
2) =? |
|
|
|
r |
|
|
|
||
Приравняем |
и выразим период: |
|||
2 |
=> Т |
2 r . |
|
|
Т |
r |
|
|
|
Радиус 1 – ой орбиты электрона (задача № 1) и скорость электрона на 1
– ой орбите для водорода (задача № 2):
|
|
|
|
|
|
|
0 h2 |
|
|
|
|
|
|
|
|
||||
r1 a |
|
|
|
|
|
|
|
|
52,9пм |
||||||||||
mе |
е |
2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
. |
|
||||||||||
|
|
|
е2 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
2,18Мм/с |
|||||||||||
|
|
|
|
|
|
||||||||||||||
1 |
|
2 0 h |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Т.е. конечная формула периода: |
|||||||||||||||||||
Т 2 |
|
0 h2 |
|
|
|
2 0 h |
4 02 h3 |
. |
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
mе е |
2 |
|
е2 |
|
|
|
mе е4 |
|||||||||
Вычисление проведём через известные данные: |
|||||||||||||||||||
Т |
2 3,14 52,9 10 12 |
||||||||||||||||||
|
|
|
|
2,18 106 |
|
|
152 10 18 1,52 10 16 с . |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
2) Конечная формула угловой скорости: |
|||||||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
mе е4 |
|
|
mе е4 |
||||||
|
Т |
2 |
|
|
|
|
2 02 h3 . |
||||||||||||
|
4 02 h3 |
||||||||||||||||||
Вычисления произведём через известные данные: |
|||||||||||||||||||
|
2 |
|
|
|
2 3,14 |
|
|
4,13 1016 рад/с . |
|||||||||||
Т |
1,52 10 16 |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,18 106 |
|
0,0412 1018 4,12 1016 рад/с . |
|||||||||||||
r |
52,9 10 12 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
Т.е. промежуточные вычисления сказываются на конечной цифре! Ответ: Т = 1,52·10 -16 с; ω = 4,1·1016 рад/с.
Примечание: Формула периода для водородоподобного атома на n - ой орбите: с
учётом задач № 1, 2: ТZ ,n |
2 r |
2 |
|
0 |
h2 |
|
n2 |
|
2 |
|
h |
|
n |
|
4 2 h3 |
|
n3 |
|
n |
|
|
|
|
0 |
|
|
0 |
|
. |
||||||||
n |
mе е2 |
Z |
е2 |
|
Z |
mе е4 |
Z 2 |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
92
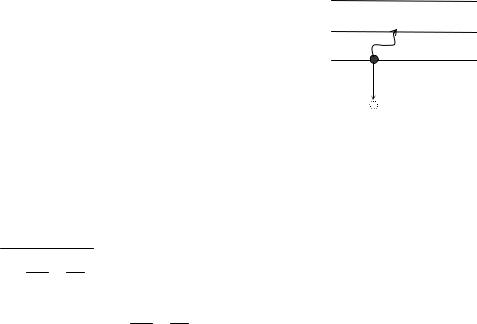
Рекомендуемое задание № 10
1) Найти наибольшую длину волны max в ультрафиолетовой серии спектра водорода. 2) Какую наименьшую скорость должны иметь электроны, чтобы при возбуждении атомов водорода ударами электроно в появилась эта линия (рис.3)?
|
Дано: |
|
|
Решение: |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||
Z = 1 |
|
|
|
1) Ультрафиолетовая серия (см. задачу № 5) спектра |
|||||||||||||
m = 1 |
|
|
|
водорода – серия Лаймона. Запишем обобщенную фор- |
|||||||||||||
h = 6,626·10-34 Дж·с |
мулу Бальмера: |
|
|
|
|
|
|
|
|||||||||
с = 3·108 м/с |
|
|
1 |
|
1 |
|
|
1 |
|
|
|
6 |
|||||
|
|
-31 |
|
|
|
|
|
|
|
|
, |
|
5 |
||||
|
|
|
|
|
|
|
|
|
|||||||||
mе = 9,11·10 |
кг |
|
|
R |
|
|
|
|
|
|
|
||||||
|
|
|
m2 |
|
n2 |
|
|
|
4 |
||||||||
|
|
|
|
|
|
||||||||||||
|
= 1,097 10 |
7 |
-1 |
где – длина волны |
3 |
||||||||||||
|
|||||||||||||||||
R |
|
м |
|
2 |
|||||||||||||
max , - ? |
|
|
|
спектральных линий в спектре |
|
||||||||||||
|
|
|
|
|
|
|
|||||||||||
атома Бора; |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|||
|
m – определяет серию; |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
Рис. 3 |
орбита |
|||||||||
|
n – определяет отдельные линии этой серии |
|
|
|
|||||||||||||
(m < n); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R – штриховая постоянная Ридберга. Отсюда длина волны:
R 11 1 .
m2 n2
Максимальная при m12 n12 min . Это наступит при наименьшем n: n
= m + 1 = 1 + 1 = 2. Произведем вычисления:
|
|
|
|
|
1 |
|
|
|
|
|
|
|
4 |
|
|
1,215 10 7 |
м 121,5(нм) . |
max |
|
|
|
|
1 |
|
1 |
|
3 1,097 |
10 |
7 |
||||||
|
1,097 10 |
7 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
12 |
22 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2) Закон сохранения энергии – кинетическая энергия падающего электрона перейдёт в конечном итоге в энергию фотона :
Eк |
или |
m 2 |
h h |
c |
. |
е |
|
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
Выразим отсюда скорость, она будет наименьшая, для данной длины волны:
93
min |
|
2hc |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
max mе |
|
|
|
|
|
|
|
|
|
|
|
|
Произведём вычисления: |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 6,626 10 34 3 108 |
|
|
|
|
|
|
|
6 |
|
6 |
|
|
min |
|
|
|
3,592 |
10 |
8 |
1,895 |
10 |
1,9 10 |
(м/с). |
||||
1,215 10 7 9,11 10 31 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ответ: λmax = 121,5 нм; υmin = 1,9·106 м/с.
Рекомендуемое задание № 11
На сколько изменилась кинетическая энергия электрона в атоме вод орода при излучении атомом фотона с длиной волны = 486 нм?
Дано: |
|
СИ: |
|
Решение: |
|
|
|||
Z = 1 |
|
486∙10-9 м |
|
Из закона сохранения энергии: разность пол- |
= 486 нм |
|
|
ных энергий электрона соответствующих орбит рав- |
|
|
|
|
|
на энергии излучения: |
Ек -? |
|
|
|
|
|
|
|
|
E En Em h . |
|
|
|
|
Частота это есть отношение скорости света к длине во лны:
c .
Полная энергия электрона по модулю равна кинетической энергии (задача № 3). Тогда:
E Eк hc .
Подставим численные значения:
|
E 6,626 10 |
34 |
|
3 108 |
|
|
0,0409 10 17 |
4,09 10 19 |
Дж 2,56 (эВ). |
|
|
|
|||
|
486 10 |
9 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Ответ: Ек = 2,56 эВ. |
|
|
|
|
|
|
|
|
|
|
||||
|
Примечание: 1 эВ = 1,6∙10-19 Дж. |
|
|
|
|
|
|
|
|||||||
|
|
Домашнее задание № 1 |
|
|
|
|
|
|
|
||||||
|
Определить максимальную и минима льную |
min |
|
6 |
|||||||||||
энергии фотона в видимой серии спектра водорода |
|
|
|
|
5 |
||||||||||
|
|
|
|||||||||||||
(серии Бальмера)(рис. 4). |
|
|
|
|
|
|
|
|
4 |
||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
3 |
||||||||
Дано: |
|
Решение |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
2 |
||||||||
|
|
|
|
|
|
|
|||||||||
Z = 1 |
|
Для определения энергии фо- |
|
|
|
|
|||||||||
n1 2 |
тона воспользуемся (см. задачу № 5 |
|
|
|
|
1 |
|||||||||
|
|
другой |
способ) сериальной |
форму- |
|
орбита |
|||||||||
max |
? |
Рис. 4 |
|
|
|
||||||||||
min |
? |
лой |
для водородоподобных |
ионов |
|
|
|
||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
94
(обобщённая формула Бальмера):
|
|
|
|
|
1 |
|
|
|
2 |
1 |
1 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
Z |
|
|
n2 |
(1) |
|||||
|
|
|
|
|
|
|
n2 |
, |
|||||||
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
||
где - длина волны фотона, |
|
|
|
|
|||||||||||
|
= 1,097·10 |
7 |
м |
-1 |
- постоянная Ридберга со штрихом, |
||||||||||
R |
|
|
|||||||||||||
Z - заряд ядра в относительных единицах (при |
Z = 1 формула переходит в сери- |
||||||||||||||
альную формулу для водорода), |
|
|
|
|
|||||||||||
n1 - номер орбиты, на которую перешёл эле ктрон, |
|||||||||||||||
n2 |
- номер орбиты, с которой перешёл электрон (n1 и n2 - главные квантовые |
||||||||||||||
числа). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Энергия фотона выражается формулой:
hс .
Поэтому, умножив обе части равенства (1) на hс, получим выражение для энергии фотона:
|
|
1 |
|
1 |
|
|
2 |
|
|
||||
2 |
2 |
|||||
R hcZ |
|
. |
||||
|
n1 |
|
n2 |
|
||
Так как Rhc = Ei = 13,6 эВ есть энергия ионизации атома водорода (энергия необходимая для удаления электрона из ат ома с первой орбиты), то:
|
2 |
|
1 |
|
1 |
|
|
|
|
|
|
|
|
Ei Z |
|
2 |
2 |
|||
|
|
. |
||||
|
|
n1 |
n2 |
|
||
Проанализируем. Из условия видимый спектр – серия Бальмера, т.е. n1 = 2
Максимальна энергия фотона будет при n2 . Минимальная энергия фотона связана с переходом со второй на третью орбиту (n2 = 3). Т.е.:
max Ei Z |
2 |
1 |
|
1 |
|
|
Ei Z 2 |
и min Ei Z |
2 |
1 |
|
1 |
|
|
5Ei Z 2 |
. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
22 |
|
4 |
|
22 |
32 |
36 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Произведём вычисление во внесистемных единицах:
max |
13,6эВ 12 |
3,4 (эВ). |
|
|
4 |
|
|
min |
5 13,6эВ 12 |
= 1,89 (эВ). |
|
|
36 |
|
|
Ответ: εmax = 3,4 эВ, εmin = 1,89 эВ.
Домашнее задание № 2
Атомарный водород, возбуждённый светом определённой длины во лны, при переходе в основное состояние испускает только три спектрал ьные линии.
95

Определить длины волн этих линий и указать, каким сериям они пр инадлежат (рис. 5).
Дано: |
|
Решение: |
|
|
|
|
||
|
|
|
|
|
||||
Z = 1 |
|
У |
падающего |
фотона энергии |
λ1 λ2 λ36 |
|||
3 линии |
|
хватит |
перебросить |
электрон на 2 |
ю |
|||
|
|
|
5 |
|||||
|
|
|
||||||
|
|
орбиту. Какие возможны переходы со |
4 |
|||||
λ1, λ2, λ3 -? |
|
|||||||
|
|
3 |
||||||
|
|
второй орбиты? Только на первую |
|
|||||
|
|
2 |
||||||
(серия Лаймана, см. задачу № 5), но это только одна |
||||||||
|
|
|||||||
линия, а по условию атомарный водород испускает |
|
1 |
||||||
3 спектральные линии. |
|
|
орбита |
|||||
Тогда будем считать, что энергии падающего |
Рис. 5 |
|||||||
фотона хватит перебросить электрон на 3ю орбиту (см. рис. 5). Какие возможны переходы с третьей орбиты? Это - на первую (серия Лаймана) и на вторую (серия Бальмера) – две линии. Но со второй орбиты электрон перейдёт ещё об я- зательно на первую (серия Лаймана). В итоге три линии. При большей энергии падающего фотона появятся ещё линии, а это по условию неприемл емо.
Применим обобщённую формулу Бальмера для водородоподобных ио-
нов:
1 |
|
|
1 |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
n1 |
n2 |
|
|
|
|
|||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
R Z |
|
|
|
|
|
|
=> |
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
, |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
n |
2 |
n |
2 |
|
|
1 |
|
1 |
|
|
2 |
n |
2 |
n |
2 |
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
R Z |
|
2 |
|
|
||||||||||||
|
|
1 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
R Z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
n1 |
n2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
где - длина волны фотона,
R = 1,097·107 м-1- постоянная Ридберга со штрихом, Z - заряд ядра,
n1 - номер орбиты, на которую перешёл эле ктрон,
n2 - номер орбиты, с которой перешёл электрон (n1 и n2 - главные квантовые числа).
Произведём вычисления: 1) Cерия Лаймана:
|
|
12 |
22 |
|
|
|
4 |
|
|
1,215 10 7 м ; = 121,5 (нм); |
|||||
1,097 107 |
12 22 |
12 |
1,097 107 |
3 |
|||||||||||
1 |
|
|
|
|
|||||||||||
2 |
|
12 |
32 |
|
|
9 |
|
|
1,026 10 7 м ; = 102,6 (нм). |
||||||
|
|
1,097 107 |
12 32 |
12 |
|
1,097 107 |
8 |
|
|||||||
2) Cерия Бальмера, n1=2, |
|
|
|
|
|
|
|
||||||||
3 |
|
|
|
22 32 |
|
|
|
36 |
|
|
6,563 10 7 м ; = 656,3 нм. |
||||
|
1,097 107 |
12 32 |
22 |
|
|
1,097 107 |
5 |
||||||||
96
Ответ: серия Лаймана: 121,6 нм; 102,6 нм; серия Бальмера: 656,3 нм.
Домашнее задание № 3
В каких пределах должна быть энергия бомбардирующих электронов, чтобы при возбуждении атома водорода ударами этих электронов спектр изл у- чения водорода имел лишь одну спектральную линию? Энергия атома в одорода в основном состоянии E1 = – 13,6 эВ.
Дано: |
|
|
|
|
|
|
|
Решение: |
||||
|
|
|
|
|
|
|
||||||
E1 = – 13,6 эВ |
|
|
|
|
|
Основное состояние – это переход электрона со 2-ой ор- |
||||||
m = 1 |
|
|
|
|
биты на 1-ую. Если энергии фотона недостаточно, чтобы эле к- |
|||||||
n = 2 |
|
|
|
|
трон изменил свое состояния при переходе с первой орб иты на |
|||||||
|
|
|
|
|
третью, то возможен только переход с первой орбиты на вт о- |
|||||||
Emin=? |
|
|
|
|
||||||||
Emax=? |
|
|
|
|
рую. |
Воспользуемся обобщённой формулой Бальмера: |
||||||
|
|
|
|
|
|
|
|
|
|
|||
|
1 |
R |
|
|
2 |
1 |
|
1 |
|
|||
|
|
|
Z |
|
|
|
|
|
, |
|||
|
|
|
|
|
n2 |
|||||||
|
|
|
|
|
|
|
m2 |
|
|
|||
где - длина волны испускаемого фотона, |
||||||||||||
|
= 1,097·10 |
7 |
-1 |
- постоянная Ридберга со штрихом, |
||||||||
R |
|
м |
|
|||||||||
Z - заряд ядра,
m – номер орбиты, на которую перешёл эле ктрон,
n – номер орбиты, с которой перешёл электрон (m и n – главные квантовые числа).
По закону сохранения энергии: энергия бомбардирующих электронов Е перейдёт в энергию излучаемого фотона ε (но сначала электрон на первой орбите получит энергию и перейдёт на вторую орбиту, через малый пр омежуток времени он избавится от излишней энергии и вернётся на первую о рбиту):
|
h c |
|
1 |
|
1 |
|
E |
|
h c R |
|
|
|
. |
|
n2 |
|||||
|
m2 |
|
|
|||
Соответственно минимальная и максимальная энергии:
|
|
1 |
|
|
1 |
|
|
|
3 |
|
|||
Emin h c R |
|
|
|
|
|
|
|
|
|
|
|
hcR |
|
2 |
2 |
2 |
4 |
||||||||||
|
|
1 |
|
|
|
|
|
|
. |
||||
|
|
1 |
|
|
1 |
|
|
|
8 |
||||
|
|
|
|
|
|
||||||||
Emax h c R |
|
|
|
|
|
|
|
|
|
|
|
hcR |
|
2 |
|
|
|
2 |
|
|
|||||||
|
|
1 |
|
|
3 |
|
|
|
|
9 |
|
||
|
|
|
|
|
|
|
|||||||
Энергия водородоподобного атома в основном состоянии (см. задачу №
3):
97
Е1 Rh |
Z |
|
2 |
|
1 |
2 |
|||
|
|
|
Rh |
Rh. |
|||||
|
|
|
n |
|
|
|
1 |
|
|
Тогда: |
|
|
|
|
|
|
|
||
E |
min |
|
3 |
Е |
|
3 |
13,6 10,2эВ |
||
|
|
4 |
1 |
|
|
4 |
|
. |
|
|
|
|
8 Е |
8 |
|
||||
E |
max |
|
13,6 12,0(8) 12,1эВ |
||||||
|
|
9 |
1 |
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
||
И так если энергия, получаемая атомами водорода, находится в пределах от +10,2 эВ до +12,1эВ, то они будут излучать только одну длину волны.
Ответ: от +10,2 эВ до +12,1эВ;
Примечание 1: Почему Umin? При большом напряжении будет другая (меньше) гр а- ница сплошного рентгеновского спектра (минимальная длина волны фотона).
Примечание 2: Z – лишнее данное для проверки теоретических зн аний.
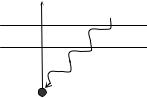
Домашнее задание № 4
На возбуждённый (n = 2) атом водорода падает фотон и вырывает из ат о- ма электрон с кинетической энергией Т = 4 эВ. Определить энергию падающего фотона εф (в эВ)(рис. 6).
Дано: |
|
|
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Z = 1 |
|
Закон сохранения энергии: |
|
|
|
|||||
n = 2 |
|
Едо = Епосле |
|
|
Т |
6 |
||||
|
|
|
|
|
||||||
Т = 4 эВ |
|
|
|
|
|
|
|
|
|
5 |
или для нашей задачи: |
|
|
||||||||
|
4 |
|||||||||
Еi = 13,6 эВ |
|
|
ф Е Т , |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
||||
εф = ? |
где Е – полная энергия электрона на |
|
|
|
2 |
|||||
|
|
|
||||||||
второй орбите водородоподобного атома, равная |
|
|
1 |
|||||||
(см. задачу № 4): |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
орбита |
||||
|
|
Z |
2 |
Z |
|
2 |
|
Рис. 6 |
|
|
Е Rh |
|
|
Еi |
|
, |
|
|
|
|
|
|
n |
|
n |
|
|
|
|
|
|
|
где Еi = Rh – энергия ионизации атома водорода . Тогда ЗСЭ:
|
Z 2 |
Т . |
ф Еi |
|
|
n |
|
|
Откуда энергия фотона: |
||
|
|
Z 2 |
ф Т Еi |
. |
|
|
n |
|
Произведём вычисления во внесистемных единицах:
ф 4 |
13,6 |
|
1 |
|
2 |
|
2 |
|
7,4(эВ) . |
||
|
|
|
|
|
98

Ответ: εф = 7,4 эВ.
Домашнее задание № 5
Найдите скорость электронов, вырываемых электромагнитным излучением с длиной волны 18 нм из иона Не +, находящегося в основном состоянии.
Энергия ионизации атома водорода 13,6 эВ. |
|
|
|
|
|
||||
Дано: |
|
СИ: |
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Z = 2 |
|
18ּ10-9 м |
|
Закон сохранения энергии: |
|
||||
λ = 18 нм |
|
|
ε = Ei,Z + Т = E + |
m 2 |
, |
|
|
||
m = 1 |
|
21,76ּ10-19 Дж |
|
|
2 |
|
|
||
Ei = 13,6 Эв |
|
|
где ε – энергия фотона, |
Т |
|
m 2 |
– кинетиче- |
||
υ - ? |
|
|
|
2 |
|||||
|
|
|
|
|
|
|
|
||
ская энергия |
|
вырванного электрона, Ei,Z – энергия ионизации водородоподобно- |
|||||||
го атома. Тогда скорость: |
|
|
|
|
|
|
|
||

 m2 ( Ei ) .
m2 ( Ei ) .
Энергия фотона и связь энергии ионизации водородоподобного атома с энергией ионизации водорода (см. задачу № 4):
|
hс |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Z |
|
Еi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Еi,Z |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2 |
hс |
Z |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
Еi . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Произведём вычисления: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
2 |
|
|
|
6,626 10 34 |
3 108 |
22 |
21,76 |
10 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
19 |
, |
|
|
|||||||||||
|
9,11 10 31 |
18 10 9 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
2 1031 |
110,43 87,04 10 19 |
|
|
|
2 |
|
|
23,393 1012 |
|
|
106 . |
||||||||||||
|
|
|
|
5,136 |
|||||||||||||||||||||
9,11 |
9,11 |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
υ = 2,27∙106 м/с = 2,27 Мм/с. Ответ: υ = 2,27 Мм/с.
99

Практическое занятие 6 РЕНТГЕНОВСКОЕ ИЗЛУЧЕНИЕ
Рекомендуемое задание № 1
Определить скорость υ электронов, падающих на антикатод рентгено в- ской трубки, если минимальная длина волны min в сплошном спектре рентге-
новского излучения равна 1 нм. |
|
|
|
|
|
|
||||
Дано: |
|
Си: |
|
|
Решение: |
|
|
|||
|
|
|
|
|||||||
min = 1 нм |
|
10-9 м |
|
|
Для начала вычислим энергию фотона: |
|||||
m = 9,11∙10-31 кг |
|
|
|
|
|
hc |
|
6,626 10 34 3 108 |
. |
|
с = 3·108 м/с |
|
|
|
|
|
|
10 9 |
|||
|
|
|
|
|
|
|
|
|||
h = 6,626·10-34 Дж·с |
|
|
|
|
19,878 10 17 |
Дж 1,24кэВ , что намно- |
||||
υ = ? |
|
|
|
|
го меньше энергии покоя электрона (511кэВ), |
|||||
следовательно, электрон можно рассматривать как классическую частицу. Работа сил электрического поля Аэл разгоняет электрон, т.е. сообщает ки-
нетическую энергию Т электрону; электрон, попав на анод, тормозится и теряет всю энергию в виде излучения ε. Переход можно представить в следующем виде: Аэл → Т → ε. Нас интересует последний (два момента): закон сохранения энергии: Т → ε. Т.е. система трёх уравнений (расписана кинетическая энергия электрона и энергия фотона):
|
|
|
|
Т |
|
|
|
|
m |
2 |
|
|
|
|
|
Т |
|
|
, |
2 |
|
||
|
|
|
|
|
hc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где m – масса электрона, h – постоянная планка, с – скорость света в вакууме. Из зависимости энергии от длины волны фотона видно, что чем меньше дл ина волны, тем больше энергия, т.е. максимальной энергии соответствует наимен ь- шая длина волны. Подставим два последних уравнения в пе рвое:
m 2 |
|
hc |
. |
2 |
|
||
|
min |
||
Выразим скорость электрона, которая является максимальной :
|
2hc |
. |
|
||
|
m min |
|
Произведём вычисления:
100
