
posobia_4semФизика / Квантовая оптика _решебник_
.pdf
нения энергии, изменению энергии фотона, то есть:
|
|
|
|
c |
|
|
c |
|
|
hc |
|
|
|
|
Т |
h |
h . |
|
|
||||||||||
|
|
|
||||||||||||
Произведём вычисления: |
|
|
||||||||||||
|
6,63 10 |
34 |
3 108 |
2,426 10 12 |
48,25314 10 38 |
|
||||||||
Т |
|
|
|
|
448,52 10 24 |
0,11 10 14 , |
||||||||
20 10 12 |
20 10 12 |
2,426 10 12 |
||||||||||||
Т = 1,1∙10-15 Дж = 0,67∙104 эВ = 6,7 кэВ.
3) Кинетическая энергия и импульс классической частицы (при её скорости υ значительно меньше скорости с света υ<<с):
|
|
|
|
|
р |
|
|
|
|
|
|
|
|
|
m |
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
Т |
|
|
|
m |
|
|
|
р |
|
|
||
|
|
2 |
|
|
|
|
|
|
2 Т |
|
|
. |
|
|
m |
р |
2m |
||||||||
|
р m |
|
|
|
|
|||||||
|
|
Т |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
2 m |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||
Откуда связь импульса классической частицы с кинетической энерги- |
||||||||||||
ей: |
|
|
|
|
|
|
|
|
|
|
|
|
р |
2 mT |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подставим числа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23 |
кг |
м |
|
р |
2 9 ,11 10 |
|
31 |
1,1 10 |
|
15 |
|
20 |
10 |
|
46 |
4 ,48 |
10 |
|
||||||
|
|
|
|
|
с |
. |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: = 2,42 пм; Т = 6,7 кэВ; р = 4,48·10 –23 кг·м/с.
Примечание. В случае релятивистской частицы применяем формулы связи импульса с: 1) полной энергией: Е2 = Е02 + (рс)2 или 2) с кинетической энергией: (рс)2 =
Т(Т+2Е0).
81
Практическое занятие 5 АТОМ ВОДОРОДА ПО ТЕОРИИ БОРА
Рекомендуемое задание № 1
Вычислить радиус второй орбиты r2 электрона в ионе гелия He+.
Дано:
Z = 2 n = 2
ħ = 1,05·10-34 Дж·с ε0 = 8,85·10-12 Ф/м mе = 9,11·10-31 кг е = 1,6·10-19 Кл
r2 =?
Решение:
Второй закон Ньютона:
FКулона mе a .
В проекции на ось Оx (рис. 1) и распишем
Кулона и нормальное ускорение:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
m |
е |
a |
n |
|
|
|
|
|
rn |
|||
|
К |
|
|
|
|
|
Zе e |
|
|
||||
|
|
|
|
1 |
|
|
|
|
FКулона |
||||
FК |
|
|
|
|
|
|
, |
|
|||||
4 0 |
r |
2 |
x |
||||||||||
|
|
|
|
|
|
|
an |
||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
||
an |
|
r |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
силу
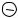 mе
mе
n
где Ze – заряд ядра, e – заряд электрона, υ – линейная скорость электрона.
Подставим второе и третье уравнение сист емы в первое уравнение:
1 |
|
Zе2 |
mе |
2 |
=> |
1 |
|
Zе2 |
mе 2 . |
(1) |
|
4 0 |
r 2 |
r |
4 0 |
r |
|||||||
|
|
|
|
|
|
Первый постулат Бора (постулат стационарных состояний или правило квантования орбит): дискретные квантовые значения момента импульса удовлетворяют условию:
mе r n |
(n = 1, 2, 3…), |
(2) |
где m – масса электрона, r – радиус орбиты электрона n – номер стационарной
орбиты, ħ – постоянная Планка с чертой. |
|
|
|
|
|
|
|
|
||||||||||||||
Выразим скорость из (2): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
n |
. |
|
|
|
|
|
|
|
|
(3) |
||
|
|
|
|
|
|
|
|
mе r |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставим в формулу (1) получим: |
|
|
|
|
|
|
|
|
||||||||||||||
|
1 |
|
Zе2 m |
|
n2 2 |
|
n2 2 |
=> |
|
1 |
|
|
Zе |
2 n2 2 . |
|
|||||||
|
|
е mе2 r 2 |
mе r 2 |
4 0 |
|
|
||||||||||||||||
|
4 0 |
r |
|
|
|
|
|
|
|
mе r |
|
|
||||||||||
Сократили m и r, Отсюда радиус n – ой орбиты электрона: |
|
|||||||||||||||||||||
|
|
|
|
4 0 2 |
n2 |
|
4 0 h2 |
|
|
|
n2 |
|
0 h2 |
n2 |
|
|||||||
|
|
|
rn |
mе е2 |
Z |
|
|
|
|
|
Z |
|
|
|
Z . |
(4) |
||||||
|
|
|
mе е2 2 2 |
|
mе е2 |
|||||||||||||||||
82
Учли: h = 2πħ. Подставим числа:
r |
|
4 3,14 8,85 10 12 1,05 10 34 |
2 |
|
2 |
2 |
|
122,6 |
10 |
80 |
2 5,257 10 11 |
2. |
|
9,11 10 31 1,6 10 19 |
2 |
|
2 |
23,32 |
10 |
69 |
|||||||
2 |
|
|
|
|
|
|
|||||||
r |
10,5 10 11 м 105пм. |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ответ: r2 = 105 пм.
Приложение 1: Первый Боровский радиус r1 = а в атоме водорода (Z = 1, n = 1):
a |
|
4 0 2 |
|
0 h2 |
|
|
8,85418782 10 12 6,626176 10 34 2 |
|||
mе е2 |
|
|
. |
|||||||
mе е2 |
3,141592654 9,109534 10 31 1,6021892 10 19 2 |
|||||||||
r |
a |
388,7538155 10 80 |
5,29 10 11 м 52,9пм . Учли: h = 2πħ. |
|||||||
73,46384139 10 69 |
||||||||||
1 |
|
|
|
|
||||||
|
|
|
|
|
||||||
Приложение 2: Связь радиуса n –той стационарной орбиты водородоподобного атома с радиусом первой боровской орбиты электрона в атоме водорода:
r r n2 |
а n2 . |
||
n |
1 |
Z |
Z |
Рекомендуемое задание № 2
Вычислить скорость υ4 электрона на четвёртой орбите для иона лития
Li++.
|
Дано: |
|
|
|
|
|
Решение: |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Z = 3 |
|
|
|
|
|
Из 2го закона Ньютона (см. задачу № 1): |
|
||||||||||||
n = 4 |
|
|
|
|
|
1 |
|
|
|
Zе2 |
m 2 . |
|
|
|
|||||
h = 6,626·10-34 Дж·с |
|
|
|
|
|
|
|
|
r |
|
|
|
|||||||
|
|
|
4 0 |
|
е |
|
|
|
|||||||||||
ε0 = 8,85·10-12 Ф/м |
|
|
Из первого постулата Бора (см. задачу № 1) ра- |
||||||||||||||||
е = 1,6·10-19 Кл |
|
|
|
|
диус орбиты: |
|
|
|
|
|
|||||||||
υ4 = ? |
|
|
|
|
|
r |
n |
. |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
Подставим в предыдущую формулу: |
|
|
|
||||||||||||||||
|
1 |
Zе2 |
mе |
m 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
4 0 |
|
n |
е |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
После сокращения на mеυ получим скорость электрона на n – той орбите |
|||||||||||||||||||
для водородоподобного атома: |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
n |
1 |
|
Zе2 |
|
е2 |
|
|
Z |
2 е2 |
Z |
е2 |
Z . |
(1) |
||||
|
|
4 0 |
|
|
|
|
2 0 h |
||||||||||||
|
|
|
n |
4 0 |
n |
4 0 h n |
n |
|
|||||||||||
Учли, что h = 2πħ. Подставим числа:
4 |
|
1,6 10 19 2 |
|
3 |
|
2,56 10 38 |
|
3 |
0,0218 10 |
8 |
|
3 |
, |
|
2 8,85 10 12 |
6,626 10 34 |
4 |
117,2802 10 46 |
4 |
|
4 |
||||||||
|
|
|
|
|
|
|
|
|
||||||
83
4 0,01637 108 1,64 106 м 1,64 Мм/с. Ответ: υ4 = 1,64 Мм/с.
Приложение 1: Скорость электрона на первой орбите в атоме водор ода:
1 |
|
е2 |
|
1 |
|
е2 |
|
1,6 10 19 2 |
|
|
2,18 10 |
6 |
м/с. |
|
2 0 h |
1 |
2 0 h |
2 8,85 10 12 |
6,626 |
10 |
34 |
|
|||||||
|
|
|
|
|
|
|
|
|||||||
Приложение 2: Связь скорости электрона водородоподо бного атома на n – ой орбите со скоростью на первой орбите атома водорода: n 1 Zn .
Рекомендуемое задание № 3
Определить потенциальную П, кинетическую Т и полную Е энергии электрона, находящегося на первой орбите атома водорода (основное со стояние).
Дано: |
|
|
|
|
|
|
|
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Z = 1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 способ. 1) Потенциальная энергия электрона в |
||||||||||||||||||||||||
n = 1 |
|
|
|
|
|
|
|
|
|
электростатическом поле ядра и радиус орбиты rn элек- |
|||||||||||||||||||||||||||
mе = 9,11·10-31 кг |
|
|
|
|
трона (см. задачу № 1): |
|
|
|
|
|
|
||||||||||||||||||||||||||
е = 1,6·10-19 Кл |
|
|
|
|
|
|
|
|
П |
1 |
|
|
|
|
Ze е |
|
1 |
|
Ze2 |
|
|||||||||||||||||
h = 6,626·10 |
-34 |
Дж·с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
4 0 |
|
|
|
|
|
r |
|
|
4 0 |
r |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
||||||||||
ε0 = 8,85·10 |
-12 |
Ф/м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 h |
2 |
|
|
|
|
n |
2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
1) П = ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
mе е |
2 |
|
|
|
Z |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
2) Т = ? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Тогда потенциальная энергия электрона на любой |
|||||||||||||||||||||||||
3) Е = ? |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
орбите водородоподобного атома (Считаем энергию |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
электрона в бесконечности равной нулю): |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
2 |
|
mее2 |
|
|
|
|
Z |
|
|
|
mе e4 |
|
Z |
|
2 |
|
|||||||
|
|
|
|
|
П |
|
|
|
|
Ze |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
(1) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
0 h2 |
n2 |
4 02 h2 |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
4 0 |
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|||||||||||||||
Потенциальная энергия для основного состояния атома водорода Z = 1, |
|||||||||||||||||||||||||||||||||||||
n = 1: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
П |
mе e4 |
|
1 |
2 |
|
mе e4 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
4 02 h2 |
|
|
4 02 h2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Приложение 1: Связь потенциальной энергии водородоподобного атома с потен-
циальной энергией основного состояния атома водорода: ПZ
Вычислим:
П |
9,11 10 31 |
1,6 10 19 4 |
|
|
59,7 |
10 107 |
4 8,85 10 12 |
6,626 10 34 2 |
13755 |
10 92 |
|||
П 43,4 10 19 Дж 27,13 эВ.
П Z 2
Нn .
0,00434 10 15 ,
84
2) Кинетическая энергия электрона при движении по окружности и
скорость электрона на этой орбите (см. задачу № 2):
|
|
|
m 2 |
|
|
|
||
Т |
2 |
|
|
|
|
|||
|
|
|
|
|
|
. |
||
|
|
|
|
е |
2 |
|
Z |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
n |
|
|
2 0 h |
|
n |
|
|
|
|
|
|
|
|
|||
Тогда кинетическая энергия электрона на любой орбите водородоподо б- ного атома:
|
m |
|
е4 |
|
Z 2 |
|
mе4 |
|
Т |
|
|
|
|
|
|
|
|
2 |
4 02 h2 |
8 02 h2 |
||||||
|
|
n |
|
|||||
|
Z |
2 |
(2) |
|
|
. |
|
n |
|
|
|
Кинетическая энергия для основного состояния атома водорода Z=1,
n=1:
|
mе4 |
|
1 |
|
2 |
mе4 |
|
|
Т |
|
|
|
|
|
|
. |
|
8 02 h2 |
1 |
8 02 h2 |
||||||
|
|
|
|
|
Приложение 2: Связь кинетической энергии водородоподобного атома с кинети-
ческой энергией основного состояния атома водорода: ТZ |
|
|
Z |
2 |
|
|
||||||||||||||||||
ТН |
. |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
Приложение 3: Связь потенциальной и кинетической энергии водородоподобного |
||||||||||||||||||||||||
атома: Т |
П => |
П 2Т 2 |
m 2 |
|
m 2 . |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Вычислим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Т |
|
|
9,11 10 31 |
1,6 10 19 |
4 |
|
|
13,565 эВ. |
|
|
|
|
|
|
||||||||||
8 8,85 10 12 |
6,626 10 34 |
2 |
|
|
|
|
|
|
||||||||||||||||
3) Полная энергия электрона на любой орбите водородоподобного ат о- |
||||||||||||||||||||||||
ма: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
mе4 |
Z |
|
2 |
|
mе e4 |
|
Z |
2 |
mе4 |
|
Z |
|
2 |
|
||||
Е Т П |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
(3) |
|||||
8 02 h2 |
|
4 02 h2 |
8 02 h2 |
|||||||||||||||||||||
|
|
|
|
|
|
n |
|
|
|
n |
|
|
n |
|
|
|
||||||||
Полная энергия для основного состояния атома водорода Z = 1, n = 1: |
||||||||||||||||||||||||
|
|
|
mе4 |
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Е |
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
8 02 h2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Вычислим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
9,11 10 31 |
1,6 10 19 4 |
|
|
|
|
|
|
|
|
|
|||||||||||
Е |
|
|
|
13,565эВ . |
|
|
|
|
|
|
||||||||||||||
|
8 8,85 10 12 |
6,626 10 34 2 |
|
|
|
|
|
|
||||||||||||||||
2 способ. Решим через постоянную Ридберга R.
85
Приложение 4: Постоянная Ридберга для водорода: R |
me e4 |
= 3,28805∙1015 1/с. |
||||||
|
||||||||
|
|
|
|
|
|
8h3 02 |
|
|
|
9,109534 10 31 |
1,6021892 10 19 4 |
60,02765265 |
10 107 |
||||
R |
|
|
|
182463,6461 |
10 126 , |
|||
8 6,626176 10 34 |
3 8,85418782 10 12 2 |
|||||||
R 0,000328984 1019 |
3,28984 1015 1/с (с табличным расходится!). |
|||||||
Приложение 5: Постоянная Ридберга для водородоподобной системы: |
||||||||
RZ Z 2 R |
me e4 |
Z 2 . |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
8h3 02 |
|
|
|
|
|
|
1) Потенциальная энергия электрона на любой орбите водородоподобн о- го атома из формулы (1) с учётом постоянной Ридберга :
П2Rh Z 2 .
n
Потенциальная энергия для основного состояния атома водорода Z = 1,
n = 1:
П 2Rh. Вычислим:
П 2Rh 2 3,29 1015 6,626 10 34 Дж 43,599 10 19 27,2 эВ.
2) Кинетическая энергия электрона на любой орбите вод ородоподобного атома из формулы (2) с учётом постоянной Ридберга :
ТRh Z 2 .
n
Кинетическая энергия для основного состояния атома водорода Z = 1, n
=1 и учтём связь с потенциальной энергией :
ТRh П2 .
Вычислим:
Т 27,2эВ 13,6 эВ. 2
3) Полная энергия электрона на любой орбите водородоподобного ат о-
ма:
|
Z 2 |
|
Z 2 |
|
Z |
2 |
Е Т П Rh |
|
2Rh |
|
Rh |
. |
|
n |
n |
n |
|
|||
Вчислах для основного состояния атома водорода Z = 1, n = 1:
ЕRh Т П2 13,6эВ.
86

Приложение 6: Полная энергия для водородоподобной системы через кинетическую или потенциальную энергии:
Е Т П2 .
Ответ: П = – 27,2 эВ; Т = 13,6 эВ; Е = – 13,6 эВ.
Рекомендуемое задание № 4
Найти энергию Еi и потенциал Ui ионизации иона He+. |
|
|
|
|||||||||||||||||
Дано: |
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Z = 2 |
|
1) Энергия ионизации любого водородоподобного |
||||||||||||||||||
n = 1 |
|
атома, т.е. электрон вывести с первой орбиты в бесконе ч- |
||||||||||||||||||
m = ∞ |
|
ность – за пределы атома (покинуть атом): |
|
|
|
|||||||||||||||
h = 6,626·10-34 Дж·с |
|
|
|
|
|
|
2 |
|
|
1 |
|
1 |
|
2 |
|
2 |
hcR , |
|
||
|
|
Е |
|
|
1, |
Z |
|
hR |
|
|
|
|
|
Z |
|
hR Z |
|
(1) |
||
1) Еi = ? |
|
|
|
12 |
|
|
|
|||||||||||||
|
|
i,Z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2) Ui = ? |
|
где R = R/с = 3,28805∙1015 1/с – постоянная Ридберга, |
R = |
|||||||||||||||||
1,097373177∙107 м-1 |
|
– штриховая постоянная Ридберга, Z – зарядовое число (по- |
||||||||||||||||||
рядковый номер в таблице Менделе ева). |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Энергия ионизации водорода: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Еi 12 hR hR hcR . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Произведём вычисления: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Еi 6,625 10 34 3 108 1,097 107 |
6,625 10 34 |
3,29 107 , |
|
|
|
|||||||||||||||
|
|
Еi 21,8 10 19 Дж 13,6эВ. |
|
|
|
|
|
(2) |
||||||||||||
Связь энергии ионизации водородоподобного атома с энергией иониза- |
||||||||||||||||||||
ции водорода: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Еi,Z |
Z 2 Еi . |
|
|
|
|
|
|
|
|
|
|
|
(3) |
|||
Вычислим энергию ионизации иона гелия: |
|
|
|
|
|
|
|
|
||||||||||||
Еi,Не 22 13,6эВ 54,4эВ.
2) Потенциал по определению:
Епотенциальная .
q
Тогда потенциал ионизации (ускоряющая разность потенциалов, которую должен пройти бомбардирующий электрон, чтобы приобрести энергию, достаточную для ионизации атома) любого водородоподобного атома:
i Ui |
Еi |
|
Rh |
. |
(4) |
|
|
||||
|
e |
en2 |
|
||
Если энергия ионизации выражена внесистемно в эВ, то потенциал ионизации Ui или φi численно равен энергии ионизации:
87

Ui = φi = Еi (Вольт).
Тогда потенциал ионизации иона гелия:
Ui = φi = 54,4 В.
Ответ: Еi = 54,4 эВ; Ui = 54,4 В.
Приложение 1: Связь потенциала ионизации водородоподобного атома с потенци а- лом ионизации водорода: φi = Z2φi.
Приложение 2: Полная, кинетическая и потенциальная энергии для водородоподобной системы, через энергию ионизации:
|
Z 2 |
|
Z 2 |
|
Z |
2 |
Е Еi |
|
, Т Еi |
|
, П 2Еi |
. |
|
n |
n |
n |
|
|||
Рекомендуемое задание № 5
Определить энергию фотона, испускаемого при переходе электрона в
атоме водорода с третьего энергетического уровня на вт орой. |
|
||||||||||||||||||||||
Дано: |
|
|
|
|
|
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Z = 1 |
|
|
|
|
|
|
1 способ. Энергия фотона: |
|
|
|
|
||||||||||||
m = 2 |
|
|
|
|
|
|
|
|
|
m,n h m,n |
h |
c |
|
, |
(1) |
||||||||
n = 3 |
|
|
|
|
|
|
|
|
|
m,n |
|
||||||||||||
h = 6,626·10-34 Дж·с |
|
|
|
где h – постоянная планка, с – скорость света в вакуу- |
|||||||||||||||||||
с = 3·108 м/с |
|
|
|
ме, ν – частота излучения, λ – длина волны излучения |
|||||||||||||||||||
R = 3,29 1015 c-1 |
|
|
|
m, n – стационарные орбиты; m = 1, 2, 3, 4, 5, 6 (опреде- |
|||||||||||||||||||
R/ = 1,097 107 м-1 |
|
|
|
ляет серию), n = m + 1, m + 2, m + 3…(определяет от- |
|||||||||||||||||||
Еi = 13,6 эВ |
|
|
|
дельные линии этой серии), n = ∞ определяет границу |
|||||||||||||||||||
mе = 9,11·10-31 кг |
|
|
|
серии. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
е = 1,6·10-19 Кл |
|
|
|
|
|
|
Обобщённая |
формула |
Бальмера |
(сериальная |
|||||||||||||
ε3,2 =? |
|
|
|
формула): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2 |
|
1 |
|
1 |
1 |
|
|
2 |
|
1 |
|
|
1 |
|
||||||||
m,n Z |
|
|
R |
|
|
|
|
|
или |
|
Z |
|
R |
|
|
|
|
|
|
, |
(2) |
||
|
|
|
2 |
n |
2 |
m,n |
|
|
2 |
|
n |
2 |
|||||||||||
|
|
|
m |
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|||||
где R = R/с = 3,28805∙1015 1/с – постоянная Ридберга, R/ = 1,097373177∙107 м-1 – штриховая постоянная Ридберга, Z – зарядовое число (порядковый номер в та б- лице Менделеева).
Подставим формулу (2) частоты в (1):
|
|
2 |
|
|
1 |
|
|
|
|
1 |
|
|
|
2 |
|
|
1 |
|
|
|
|
1 |
|
|
|
|
||||||
m,n Z |
|
hR |
|
|
|
|
|
|
|
|
Z |
|
Еi |
|
|
|
|
|
|
|
|
, |
|
(3а) |
||||||||
|
|
|
|
n2 |
|
|
|
|
n2 |
|
||||||||||||||||||||||
|
|
|
|
m2 |
|
|
|
|
|
|
m2 |
|
|
|
|
|
||||||||||||||||
или через длину волны: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2 |
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
2 |
|
1 |
|
|
|
|
1 |
|
|
|
|
||||||
m,n Z |
|
hcR |
|
|
|
|
|
|
|
|
|
Z |
|
Еi |
|
|
|
|
|
|
|
|
|
, |
(3б) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
m2 |
|
|
|
|
n2 |
|
|
|
m2 |
|
|
|
|
n2 |
|
|
||||||||||||
88

где Еi – энергия ионизации водорода. Получили одинаковую формулу. Произведем вычисления во внесистемных единицах:
|
2 |
|
1 |
|
1 |
|
|
9 4 |
|
|
|
3,2 |
1 |
13,6эВ |
|
|
|
|
|
13,6 |
|
1,89 (эВ). |
|
22 |
32 |
36 |
|
||||||||
|
|
|
|
|
|
|
|
||||
2 способ. Второй постулат Бора (правило частот): |
|
||||||||||
|
|
εn,m = |
|
Е = Еn – Em = Eдо – Eпосле, |
(4) |
||||||
где ε n,m – энергия испускаемого (поглощаемого) атомом фотона при переходе атома из одного стационарного состояния в другое, Еn и Em – энергии стацио-
нарных состояний, характеризуемые квантовыми числами |
n и m, определяе- |
|||||
мые по формуле: |
|
|
|
|
|
|
Еn |
mе e4 |
|
Z |
2 |
|
|
|
|
|
, |
(5) |
||
8 02 h2 |
||||||
|
n |
|
|
|||
где е – элементарный заряд, ε0 – электрическая постоянная, Z – атомный номер (зарядовое число, порядковый номер атома в таблице Д.И. Менделеева) . При Em < En происходит излучение фотона, при Em > En – его поглощение.
Тогда энергия испускаемого фотона:
|
|
|
mе e4 |
|
Z |
2 |
mе e4 |
Z |
2 |
mеe4 Z 2 1 |
|
|
1 |
|
|
|
|
|
||||||||||
n,m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|||
8 02 h2 |
|
8 02 h2 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
n |
|
8 02 h2 m |
|
m2 |
|
|
n2 |
|
|
|
|
|
|||||||||||||
Подставим числа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
3,2 |
|
|
9,11 10 31 |
1,64 10 19 |
4 12 |
|
|
1 |
|
1 |
|
|
|
59,703 10 |
107 |
|
9 4 |
, |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
8 8,852 |
10 12 |
6,6262 |
10 34 |
|
|
22 |
|
32 |
|
|
|
|
27501 10 |
92 |
|
4 |
9 |
|
||||||||
3,2 |
0,0003015 10 15 |
3,01 10 19 |
Дж 1,885эВ. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Ответ: ε3,2 = 1,89 эВ, относится к серии Бальмера.
Примечание 1. №, название и область спектра серий водородоподобного ат ома:
Номер серии, m Название серии |
Область спектра |
|
1 |
Лаймана |
ультрафиолетовая |
2 |
Бальмера |
видимая |
3 |
Пашена |
|
4 |
Брэкета |
инфракрасная |
5Пфунда
6Хэмфри
Примечание 2. Атом излучает фотон, если электрон переходит с большей орбиты на меньшую (с 3й на 1ю). Атом поглощает фотон, если электрон переходит с меньшей орбиты на большую (с 1й на 3ю).
Рекомендуемое задание № 6
Найти первую энергию возбуждения Е1 и первый потенциал возбуждения U1 иона Li++.
89
Дано: |
|
Решение: |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
Z = 3 |
|
1) Первое возбуждённое состояние атома. Элек- |
||||||||||||
m = 1 |
|
трон находится на второй орбите. Переведё н с основной |
||||||||||||
n = 2 |
|
орбиты (первой) на вышестоящую – вторую. |
|
|||||||||||
|
|
Для перехода на вторую орбиту в водородоподоб- |
||||||||||||
1) Е1 = ? |
|
|||||||||||||
2) U1 = ? |
|
ном атоме необходимо поглотить энергию фотона – |
пер- |
|||||||||||
|
|
вая энергия возбуждения: |
|
|
|
|
||||||||
|
|
|
2 |
|
1 |
|
1 |
|
3 |
|
2 |
|
|
|
|
Е1,Z 2,1 Z |
|
Еi |
|
|
|
|
|
|
Z |
|
Еi , |
(1) |
|
|
|
12 |
22 |
4 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
где Z – зарядовое число (порядковый номер в таблиц е Менделеева), Еi = 13,6 эВ
– энергия ионизации атома водорода. Произведём вычисления:
Е1 34 32 13,6эВ 91,8эВ.
2) Энергия, выраженная в электрон -вольтах, равна потенциалу выраженному в вольтах (см. задачу № 1а). Тогда первый потенциал возбуждения дважды ионизированного иона лития:
U1 = 91,8 В.
Ответ: Е1 = 91,8 эВ; U1 = 91,8 В.
Рекомендуемое задание № 7
Определить длину волны , соответствующую второй спектральной л и- нии в серии Пашена.
|
|
Дано: |
|
|
Решение: |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
Z = 1 |
|
|
Обобщённая формула Бальмера (сериальная форму- |
|||||||||||
m = 3 |
|
|
ла): |
|
|
|
|
|
|
|
|
|||
n = m + 2 = 5 |
|
1 |
Z |
2 |
R |
1 |
|
1 |
|
|||||
R |
/ |
= 1,097 10 |
7 |
-1 |
|
|
|
|
|
|
, |
|||
|
|
|
|
n2 |
||||||||||
|
|
м |
|
|
|
|
m2 |
|
|
|||||
= ? |
|
|
где R – штриховая постоянная Ридберга, Z – зарядовое чис- |
|||||||||||
ло (порядковый |
номер в таблице Менделеева), m, n – стационарные орбиты (m |
|||||||||||||
< n). |
|
|
|
|
|
|
|
|
|
|
|
|
||
Для серии Пашена:
1 |
|
1 |
|
1 |
|
|
|
|
|
|
. |
|
|
|
|||
|
R |
32 |
n2 |
||
|
|
|
Отсюда длина волны:
90
