
posobia_4semФизика / Квантовая оптика _решебник_
.pdf
ℓ |
|
0 |
|
|
1 |
|
|
|
|
|
|
|
mℓ |
|
0 |
-1 |
|
0 |
+1 |
|
|
|
|
|
|
ms |
|
-½ |
-½ |
|
-½ |
-½ |
|
|
|
|
|
|
|
+½ |
+½ |
|
+½ |
+½ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
N(ms) |
|
2 |
2 |
|
2 |
2 |
|
|
|
|
|
|
N(mℓ) |
|
2 |
|
|
6 |
|
|
|
|
|
|
|
N(n=2) |
|
|
8 |
|
|
|
|
|
|
|
|
|
|
3) Проведём рассуждения для главного квантового числа n = 3, сведём в таблицу, т.к. |
|||||||||||
кратко записать ещё труднее: |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
ℓ |
|
0 |
|
|
1 |
|
|
|
2 |
|
|
|
mℓ |
|
0 |
-1 |
|
0 |
+1 |
-2 |
-1 |
0 |
+1 |
+2 |
|
ms |
|
-½ |
-½ |
|
-½ |
-½ |
-½ |
-½ |
-½ |
-½ |
-½ |
|
|
+½ |
+½ |
|
+½ |
+½ |
+½ |
+½ |
+½ |
+½ |
+½ |
|
|
|
|
|
|
|||||||||
N(ms) |
|
2 |
2 |
|
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
N(mℓ) |
|
2 |
|
|
6 |
|
|
|
10 |
|
|
|
N(n=3) |
|
|
|
|
|
|
18 |
|
|
|
|
|
|
И так далее. |
|
|
|
|
|
|
|
|
|||
Домашнее задание № 1
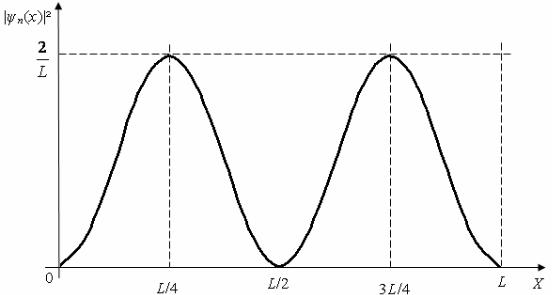
Частица в потенциальном ящике шириной L находится в возбуждённом состоянии (n = 2). Определить в каких точках интервала ( 0 < x < L) плотность вероятности |ψn(x)|² нахождения частицы максимальна и минимальна.
|
Дано: |
|
Решение: |
|
|
|
|
|||||||||
0 ≤ x≤ L, U = 0 |
|
Плотность вероятности, т.е. возведём в квадрат |
||||||||||||||
L < x < 0, U → ∞ |
|
нормированную |
собственную волновую функцию , |
|||||||||||||
n = 2 |
|
|
|
|
||||||||||||
|
|
|
|
описывающую |
состояние электрона в потенциальном |
|||||||||||
Волновая функция: |
|
|||||||||||||||
|
ящике (см. задачу № 1): |
|||||||||||||||
х |
2 |
nx |
||||||||||||||
|
|
sin |
|
|
x |
|
2 |
|
2 |
|
|
2 |
|
nx |
||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||
|
|
L |
L |
|
|
|
|
|
|
|
sin |
|
|
|
||
|
|
|
|
|
|
|
||||||||||
граничные условия: |
|
|
|
|
|
L |
|
|
|
L |
||||||
|
|
|
|
|
|
|
||||||||||
(0) = (L) = 0 1) |ψn(x)|² = max
2) |ψn(x)|² = min x - ?
лах.
|
|
|
|
2 |
|
2 |
|
2 |
|
nx |
|
2 |
|
|
|
|
nx |
|
|
nx |
|
n |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
x |
|
|
|
|
sin |
|
|
|
|
|
|
|
2 |
sin |
|
|
cos |
|
|
|
|
|
|
|
|
|||||
|
L |
|
L |
L |
|
L |
L |
L |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
4 |
|
2 |
|
|
2 x |
|
|
2 x |
|
|
4 |
|
|
|
2 x |
|
4 |
|
|
|
4 x |
|
|||||||
|
|
|
|
|
sin |
|
|
cos |
|
|
|
|
sin |
2 |
|
|
|
|
sin |
|
|
|
0 |
||||||||
L |
L |
L |
L2 |
L |
L2 |
|
L |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
161

Учли sin2x = 2sinxcosx. Найдём х:
4 x |
0 k k |
4x |
k x kL |
L |
|
L |
4 |
Значение sin = 0 наступает через 180º. Точки экстремума:
x1 L4 ; x2 24L L2 ; x1 34L .
Эти значения разбивают ось ОХ на 4 промеж утка. Теперь проанализируем знак производной функции (|ψn(x)|²)/ на этих промежутках (т.е. подставим из каждого промежутка произвольное значение и вычислим значение произво д- ной):
Первый интервал: 4
L2
Второй интервал: 4
L2
Третий интервал: 4
L2
Четвёртый интервал:
|
4 |
|
|
|
L |
|
|
|
4 |
|
|
|
|
|
4 |
|
|
|
|
|
|||||||
sin |
L |
|
|
|
|
|
|
|
|
L2 |
|
sin |
|
|
|
L2 |
" " возрастает. |
||||||||||
|
8 |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|||||||
|
4 |
|
|
3L |
|
|
4 |
|
|
|
|
3 |
|
4 |
" " убывает. |
||||||||||||
sin |
L |
|
8 |
|
|
|
L2 |
|
sin |
2 |
|
L2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
4 |
|
|
5L |
|
|
|
4 |
|
|
|
|
5 |
|
4 |
" " возрастает. |
|||||||||||
sin |
L |
|
|
8 |
|
|
|
|
L2 |
|
sin |
2 |
|
L2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
4 |
|
|
4 |
|
|
7L |
|
4 |
|
|
|
7 |
|
|
4 |
" " убыва- |
|||||||||||
L2 |
sin |
|
|
|
L |
|
8 |
|
L2 |
|
sin |
2 |
|
|
L2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ет.
2 способ. 1) Нахождение max (максимума) функции:
Анализируя функцию плотности вероятности, видно, что максимум н а- ступит при условии sin² = 1, т.е.:
ψ²max = 2/L.
А аргумент функции sin² равен 90º, с учётом периода функции sin² - :
nx |
|
|
k nx |
|
1 |
k , |
L |
|
2 |
L |
|
2 |
|
где k = 0, 1, 2, … – целые
Отсюда координаты точек максимума (с учётом n = 2):
|
1 |
L |
|
1 |
|
L |
|
|
x |
|
k |
|
|
|
k |
|
. |
2 |
|
2 |
2 |
|||||
|
n |
|
|
|
||||
Посчитаем:
162
|
1 |
|
L |
|
L |
|
1 |
|
L |
|
3L |
|
||||
xmax1 |
k 0 |
|
0 |
|
|
|
|
; xmax 2 |
k 1 |
|
1 |
|
|
|
. |
|
2 |
2 |
4 |
2 |
2 |
4 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
При больших значениях k выходим за границу х = L. 2) Нахождение min (минимума) функции:
Анализируя функцию плотности вероятности, видно, что минимум н а- ступит при условии sin² = 0, т.е.:
ψ²min = 0.
А аргумент функции sin² равен 0º, с учётом периода функции sin² - :
nx 0 k nx k ,
L L
где k = 0, 1, 2, … – целые
Отсюда координаты точек минимума:
x kL |
kL . |
|
|
|
|
|
|
|
||
n |
2 |
|
|
|
|
|
|
|
|
|
Посчитаем: |
|
|
|
|
|
|
|
|
||
xmin k 0 |
0 L |
0; xmin 2 k 1 |
1 L |
|
L |
; xmin k 2 |
2 L |
L . |
||
2 |
2 |
2 |
2 |
|||||||
|
|
|
|
|
|
|||||
При больших значениях k выходим за границу х = L.
Но из граничных условий функции : 0 и L уже учтены (см. дано).
3 способ. Просто построить функцию |ψn(x)|² по точкам (см. рис. 5).
Рис. 5
Ответ: 1) максимумы: х1 = L/4, х3 = 3L/4; 2) минимум: х2 = L/2.
163

Домашнее задание № 2
Вычислить момент импульса Lℓ орбитального движения электрона, нахо-
дящегося в атоме: 1) в s – состоянии; 2) в р – состоянии. |
||||
|
Дано: |
|
Решение: |
|
|
|
|||
1) ℓ = 0 |
(s – состояние) |
|
Орбитальный |
|
2) ℓ = 1 |
(р – состояние) |
|
момент |
импульса |
ħ = 1,05∙10-34 Дж∙с |
|
(механический орби- |
||
Lℓ - ? |
|
|
тальный |
момент) |
электрона квантуется, т.е. не может быть |
|
||
произвольным, а принимает дискретные значе- |
Рис. 6 |
||
ния, определяемые формулой: |
|
||
Lℓ.= |
|
, |
|
( 1) |
|
||
где ħ = 1,05∙10-34 Дж∙с – постоянная планка с |
|
||
чертой, ℓ – орбитальное квантовое число, ко- |
|
||
торое зависит от состояния, в котором н ахо- |
|
||
дится электрон и выбрали для каждого из с о- |
|
||
стояний по таблице приложения задачи № 5. |
Рис. 7 |
||
Произведём вычисления: |
|
||
1)Lℓ.= 
 0(0 1) 0 (s – состояние, см. рис. 6).
0(0 1) 0 (s – состояние, см. рис. 6).
2)Lℓ.= 1,05 10 34 
 1(1 1) 1,05 10 34 1,41 = 1,48∙10-34 Дж∙с (р – состояние,
1(1 1) 1,05 10 34 1,41 = 1,48∙10-34 Дж∙с (р – состояние,
см. рис. 7).
Ответ: 1) Lℓ.= 0; 2) Lℓ.= 1,48∙10-34 Дж∙с.
Домашнее задание № 3
Определить возможные значения проекции момента импульса Lℓz орбитального движения электрона в атоме на направление внешнего магнитного п о- ля. Электрон находится в d –состоянии.
Дано: Решение:
Вектор L z момента импульса электрона может Дж∙с иметь лишь такие ориента-
ции в пространстве, при которых его проекция Lℓz на направление z внешнего магнитного поля принимает квантовые знач е- ния, кратные ħ:
Lℓz = ħmℓ,
где mℓ - магнитное квантовое число, которое
при заданном орбитальном квантовом числе ℓ может принимать значения:
164

mℓ = 0, ±1, ±2, …,±ℓ,
т.е. всего 2ℓ + 1 значений. Таким образом, магнитное квантовое число mℓ определяет проекцию момента импульса электро на на заданное направление, причём вектор момента импульса электрона в атоме может иметь в пространс т- ве 2ℓ + 1 ориентаций.
Для нашей задачи 5 ориентаций: mℓ = 0, ±1, ±2, т.к. ℓ = 2 (см. приложение задачи № 5 и рис. 8).
Произведём вычисления проекции момент а импульса Lℓz орбитального движения электрона в атоме на направление внешнего магнитного поля:
1)mℓ = 0 => Lℓz = ħ∙0 = 0.
2)mℓ = ±1 => Lℓz = ħ∙(±1) = ±ħ = ± 1,05∙10-34 Дж∙с.
3)mℓ = ±2 => Lℓz = ħ∙(±2) = ±2ħ = 2∙1,05∙10-34 = ±2,1∙10-34 Дж∙с.
Ответ: 1) Lℓz.= 0; 2) Lℓz.= ± 1,05∙10-34 Дж∙с, 3) Lℓz.= ±2,1∙10-34 Дж∙с.
Домашнее задание № 4
В атоме K, L и M оболочки заполнены полностью. Определите общее число электронов в атоме.
Дано: |
Решение: |
n = 3, 2, 1 |
В задаче № 9 выведена формула для подсчёта числа элек- |
заполнены |
тронов в оболочке с главным квантовым числом n: |
K, L и M |
Zn = 2n2. |
оболочки |
Тогда общее число электронов на трёх оболочках равно их |
N - ? |
сумме: |
N = Z1 + Z2 + Z3 = 2∙12 + 2∙22 + 2∙32 = 2 + 8 + 18 = 28.
Ответ: N =28.
Домашнее задание № 5
Считая, что «нарушений» в порядке заполнения электронных оболочек нет, записать электронные конфигурации атома с атомным номером Z = 36.
Дано: |
|
|
Решение: |
|
|
|
|||
Z = 36 |
|
|
|
«Нарушений» нет, тогда электронная конфигурация, |
ē конфигурация - ? |
|
с учётом задачи № 9: |
||
1s2 |
2s2 2 p6 3s2 |
3p6 3d10 4s2 4 p6 |
||
|
|
|||
K |
||||
|
L |
|
M |
N |
2 |
8 |
|
18 |
8 36 |
|
||||
|
28 |
|
|
нехватает |
Название оболочек и максимальное (если не max, то нужное) количество электронов в оболочке: K – оболочка – 2 ē, L – оболочка – 8 ē, M – оболочка – 18 ē и частично N – оболочка – 8 из 32 ē.
165
Окончательно электронная конфигурация: 1s22s22p63s23p63d104s24p6.
Ответ: 1s22s22p63s23p63d104s24p6.
166

РАЗДЕЛ II. ЭЛЕМЕНТЫ ФИЗИКИ АТОМН ОГО ЯДРА
Практическое занятие 10 1. МАССА, РАЗМЕР, СОСТАВ И ЗАРЯД АТОМНОГО ЯДРА.
МАССОВОЕ И ЗАРЯДОВОЕ ЧИСЛО
2. РАДИОАКТИВНОЕ ИЗЛУЧЕНИЕ И ЕГО ВИДЫ (ПРЕВРАЩЕНИЕ ЯДЕР)
Рекомендуемое задание № 1
Зная постоянную Авогадро NA , определить массу ma нейтрального атома углерода 12C и массу m , соответствующую углеродной единице массы.
Дано:
NА = 6,02·1023 моль-1
12C
М = 12·10-3 кг/моль
1)ma = ?
2)m = ?
Решение:
1) Масса одного атома нейтрального углерода:
ma M . NA
Подставим численные значения:
ma |
12 10 3 |
= 1,99·10 |
-26 |
= 19,9·10 |
-27 |
кг. |
6,02 1023 |
|
|
||||
|
|
|
|
|
|
2) За 1 а.е.м. принято считать 1,66·10-27 кг. Следовательно для углерода m = 1,66·10-27 кг.
Ответ: mа = 19,9·10-27 кг, m = 1,66·10-27 кг.
Рекомендуемое задание № 2
Хлор представляет собой смесь двух изотопов с отн осительными атом-
ными массами Ar1 34,969 и Ar 2 |
36,966 . Вычислить относительную атомную |
||||||||
массу Ar хлора, если массовые доли 1 и 2 |
первого и второго изотопов соот- |
||||||||
ветственно равны 0,754 и 0,246. |
|
|
|
|
|
|
|||
Дано: |
|
Решение: |
|
|
|
|
|
||
|
|
|
|
|
|
||||
Ar1 34,969 |
|
Массовые доли |
1 |
и 2 можно выразить соотноше- |
|||||
Ar 2 36,966 |
|
ниями: |
m1 |
|
|
|
m2 |
|
|
0,754 |
|
1 |
, 2 |
|
|
. |
|||
1 |
|
|
|
|
|
||||
|
|
m1 m2 |
|
|
m1 |
m2 |
|
||
2 0,246 |
|
|
|
|
|
||||
|
|
Выразим массы m1 и m2 : |
|
||||||
Ar (хлора) – ? |
|
|
|||||||
|
m1 1(m1 m2 ), m2 2 (m1 m2 ) . |
||||||||
|
|
||||||||
Подставим их в формулу, определяющую молярную ма ссу M смеси:
167
M |
|
m1 |
m2 |
|
, |
|
|
m |
|
|
|||
|
|
|
m |
|
|
|
|
|
1 |
2 |
|
|
|
|
|
M1 |
M2 |
|
|
|
|
|
|
|
|
||
где M1 и M2 - молярные массы компонентов смеси.
После такой подстановки и простых преобразований получим
M |
M1M 2 |
. |
(1) |
||
1M2 |
2M1 |
||||
|
|
|
|||
Так как молярные массы пропорциональны их относительным атомным массам, то равенство (1) можно переписать в виде
Ar |
Ar |
Ar |
, |
(2) |
|
|
1 |
2 |
|||
|
|
|
|
||
|
1 Ar |
2 Ar |
|
|
|
|
2 |
|
1 |
|
|
где Ar1 и Ar2 – относительные атомные массы изотопов. Подставив числовые значения величин в (2), получим:
Ar |
|
34,969 36,966 |
35,439 . |
||
0,754 |
36,966 0,246 |
34,969 |
|||
|
|
||||
Ответ: Ar |
35,439 . |
|
|
||
Рекомендуемое задание № 3
Какую часть массы нейтрального атома плутония составляет м асса его электронной оболочки?
|
|
|
Дано: |
|
|
Решение: |
||
|
|
|
|
|||||
Z = 94 |
|
|
1 способ. Исходные данные взяты из таблиц и во вн е- |
|||||
mPu = 244 а.е.м. |
|
системных единицах. Число электронов определено по та б- |
||||||
mе = 0,00055 а.е.м. |
лице Д.И. Менделеева по порядковому номеру плут ония |
|||||||
|
|
|
|
|
94Pu244 оттуда же взята относительная атомная масса. |
|||
|
Zm |
е |
= ? |
|
||||
|
|
|
|
|
|
Zmе |
||
|
mPu |
|
|
|
||||
|
|
|
|
|
|
Нам нужно найти |
|
. Всё известно, подставим чис- |
|
|
|
|
|
|
mPu |
||
|
|
|
|
|
|
|||
ла и произведём вычисления: |
||||||||
|
|
|
Zmе 94 0,00055 |
0,0517 0,000212 2,12 10 4 2,1 10 4 . |
||||
|
|
|
mPu |
244 |
244 |
|
|
|
2 способ. Новое дано.
168

Дано:
Z = 94
μPu = 244·10-4 кг/моль mе = 9,11·10-31 кг
NА = 6,02·1023 1/моль
Zmе = ?
mPu
Найдём массу одного атома плутония. (смотри задачу № 2 занятия № 2 сборник задач с решениями: «Теплота и молекулярная физика»):
m ,
0 NA
где NА – число Авогадро, μ – молярная масса вещества. Тогда отношение:
Zmе Zmе N .
mPu А
Подставим числа:
Zm |
е |
|
94 9,11 10 31 |
6,02 1023 |
21,13 10 5 |
2,11 10 4 |
2,1 10 4 . |
||||
|
|
244 |
10 3 |
||||||||
mPu |
|
|
|
|
|
|
|
||||
Ответ: |
Zmе |
|
|
-4 |
|
|
|
||||
|
|
= 2,1·10 |
. |
|
|
|
|||||
mPu |
|
|
|
||||||||
|
|
|
|
|
|
|
Рекомендуемое задание № 4 |
|
|||
Каков состав ядер атомов 3Li7 , 12Mg24 , 13Al27? |
|
||||||||||
Дано: |
|
|
|
|
Решение: |
|
|
|
|||
3Li7, 12Mg24, 13Al27 |
|
Обозначение ядра атома: |
|
||||||||
|
|
|
|
|
|
|
ZХА, |
|
|
|
|
1) А = ? |
|
|
|
|
|
|
|
|
|
||
2)Z = ? где Х – символ химического элемента; Z – зарядовое чис-
3)N = ? ло (порядковый номер в таблице Менделеева, число прот о-
нов в ядре – положительная частица); А = N + Z – массовое число - атомная масса в таблице Менделеева для стабил ьного изотопа (число нуклонов в ядре – протоны плюс нейтроны); N – число нейтронов в ядре – нейтральные частицы.
1)Литий. Из обозначения ядра находим:
Z = 3 – число протонов;
А = 7 – число нуклонов в ядре – протоны и нейтроны; число нейтронов найдём простым арифметическим действием: N = А – Z = 7 – 3 = 4.
2)Магний. Из обозначения ядра находим:
Z = 12 – число протонов;
А = 24 – число нуклонов в ядре – протоны и нейтроны; число нейтронов:
N = А – Z = 24 – 12 = 12.
3) Алюминий. Из обозначения ядра находим:
169
Z = 13 – число протонов;
А = 27 – число нуклонов в ядре – протоны и нейтроны; число нейтронов:
N = А – Z = 27 – 13 = 14.
Ответ: 1) литий: Z = 3, А = 7, N = 4; 2) магний: Z = 12, А = 24, N = 12; 3) алюминий: Z = 13, А = 27, N = 14.
Рекомендуемое задание № 5
Назвать элемент, в ядре которого содержится: 7p и 7n , 51p и 71n , 101p и 155n ?
Дано: |
|
Решение: |
|
||
7p и 7n |
|
Обозначение нуклонов ядра: |
51p и 71n |
|
1р1 – протон; 0n1 – нейтрон. |
101p и 155n |
|
1) Используя задачу № 4, находим 7X14: |
|
|
Z = 7 – зарядовое число (число протонов), порядковый но- |
ZХА = ? |
|
|
|
|
мер 7 по таблице Менделеева: 7N – азот. |
A = N + Z = 7 + 7 = 14 – массовое число,
где N – число нейтронов. Тогда элемент: 7N14 – азот.
Найдем остальные элементы, используя данные формулы:
2) 51X122 по таблице Менделеева, определяем элемент 51Sb122 – сурьма.
3) 101X256 по таблице Менделеева, определяем элемент 101Md256 – менделевий (изотоп).
Ответ: 1) 7N14 – азот, 2) 51Sb122 – сурьма, 3) 101Md256 – изотоп менделевия.
Примечание 1: Изотопы – ядра с одинаковым числом протонов Z, но разными А, т. е. с разными числами нейтронов.
Примечание 2: Изобары – ядра с одинаковым числом нуклонов А, но разным числом протонов Z.
Рекомендуемое задание № 6
Определить атомные номера, массовые числа и химические символы зеркальных ядер, которые получаются, если в ядрах 2Не3, 4Ве7, 8О15 протоны заменить нейтронами, а нейтроны протонами. Привести символическую запись получившихся ядер.
170
