
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Потенциометрия
Потенциометриейназывают группу методов количественного анализа, основанных на использовании зависимости равновесного потенциала электрода, опущенного в раствор, от активности (концентрации) ионов этого раствора.
Теоретической основой потенциометрии является уравнение Нернста. Практически потенциометрия реализуется путем создания на основе исследуемой системы гальванического элемента.
В потенциометрии используют гальванические элементы, в которых потенциал одного из электродов зависит от концентрации исследуемого вещества. Этот электрод называют рабочим (индикаторным) или электродом измерения.Второй электрод в потенциометрии являетсяэлектродом сравнения.Этот электрод выбирают с таким расчетом, чтобы его потенциал оставался постоянным и не зависел от состояния исследуемого раствора.
В таком случае измеренная э.д.с. будет зависеть только от потенциала индикаторного электрода. На основании изменения величины э.д.с. можно судить о концентрации вещества в исследуемом растворе.
Потенциометрические измерения являются надежными при изучении констант равновесия электродных реакций, коэффициентов активности ионов в растворе, констант нестойкости комплексных ионов, рН растворов.
Потенциометрические методы анализа имеют ряд преимуществ. Они особо чувствительны и не требуют для исследования больших объемов растворов. Существуют модификации потенциометрического определения, позволяющие проводить анализ в пробах, объем которых может не превышать десятых долей миллилитра, что важно для биологических исследований. Поскольку равновесное значение потенциала устанавливается быстро, то потенциометрические измерения не требуют значительных затрат времени. Их можно проводить в мутных и окрашенных растворах, вязких средах.
Различают прямую и косвенную потенциометрию или потенциометрическое титрование.
Прямая потенциометрия (ионометрия)– это потенциометрический метод, в котором индикаторным электродом является ионоселективный электрод. Ионометрия – удобный, простой, экспрессный современный метод анализа. Для его реализации достаточно подобрать соответствующий ионоселективный электрод для определяемого иона. Особенно широко ионометрия используется при определении точной концентрации ионов Н+в растворе. В качестве индикаторного электрода, как правило, применяют стеклянный электрод, селективный по отношению к ионам Н+. Измерения э.д.с. производят с помощью специальных приборов, называемых рН-метрами. Их шкала откалибрована таким образом, что вместо измеряемой э.д.с. показывает значение рН раствора.
Потенциометрическое титрованиеявляется разновидностью титриметрических методов анализа. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя точку эквивалентности на основании характера изменения э.д.с. измеряемой цепи в зависимости от объема добавляемого раствора. По полученным данным строят кривую потенциометрического титрования и на этой кривой определяют точку эквивалентности и объем израсходованного титранта в точке эквивалентности.
Потенциометрическое титрование может быть использовано для определения концентрации кислоты или основания в анализируемом растворе. В этом случае составляют гальваническую цепь, содержащую индикаторный стеклянный электрод и электрод сравнения с постоянным известным потенциалом (например, хлорсеребряный):
AgAgCl,HCl«смб»Н3О+KCl,AgClAg
aax
индикаторный хлорсеребряный
стеклянный электрод электрод сравнения
где «смб» – стеклянная мембрана; а – известная активность ионов Н+ внутреннего раствора стеклянного электрода; ах – неизвестная активность ионов Н+ измеряемого раствора.
Э.д.с. такой гальванической цепи будет зависеть от концентрации ионов Н+в исследуемом растворе. Измеряя её с помощью соответствующего прибора, можно непосредственно определить рН среды.
Титруемый раствор строго определенного объема помещают в электролитическую ячейку с электродами и при перемешивании из бюретки небольшими порциями добавляют титрант (например, раствор щелочи при определении концентрации кислоты в исследуемой системе). После каждого добавления очередной порции раствора щелочи с помощью потенциометра определяют рН раствора и затем по полученным данным строят кривую титрования в координатах рН раствора – V(титранта) (рис. 97).
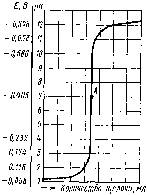
Рис. 97. Кривая потенциометрического титрования соляной кислоты гидроксидом натрия: А – точка эквивалентности
В случае титрования сильной кислоты щелочью точка эквивалентности будет лежать на середине скачка титрования (рН = 7).
В ряде случаев чувствительность потенциометрического метода превышает чувствительность обычного объемного метода, а также метода кондуктометрического титрования.
