- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Оптические методы исследования коллоидных систем Ультрамикроскоп
Коллоидные частицы по своим размерам меньше, чем длина полуволны видимого света, и поэтому их нельзя увидеть в обычный оптический микроскоп.
В 1903 г. австрийские ученые Р. Зигмонди и Г. Зидентопф предложили для исследования золей использовать ультрамикроскоп, основанный на наблюдении светорассеяния с помощью обычного микроскопа (рис. 58).
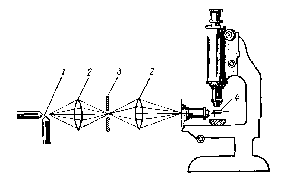
Рис. 58. Схема ультрамикроскопа: 1 – источник света; 2 – линзы; 3 – щелевая диафрагма; 4 – кювета с исследуемым раствором
При освещении золя сбоку ярким и тонким пучком света рассеянный отдельными коллоидными частицами свет виден в микроскопе как светящиеся точки на темном фоне. Для того, чтобы были отчетливо видны отдельные частицы, необходимо применять очень сильный источник света, например, вольтову дугу.
Золь должен быть достаточно разбавленным, иначе в микроскопе будет видна сплошная светящаяся полоса, а не отдельные точки.
Ультрамикроскоп дает возможность наблюдать частицы только в виде световых точек, поэтому прямыми наблюдениями определить размер и форму частиц нельзя, но можно подсчитать их число в единице объема золя, измерить смещение или сдвиг частицы (∆Х) за время t, наблюдать коагуляцию частиц в виде слияния двух точек.
Размеры коллоидных частиц и их примерную форму можно определить косвенным путем.
Зная объем раствора (V), наблюдаемого в поле ультрамикроскопа, массовую концентрацию частиц (ω) и подсчитанное их числоnв объемеV, рассчитывают объем частицы (v) по формуле:

где ρ – плотность дисперсной фазы (плотность самого коллоидного раствора принимают равной плотности дисперсионной среды в виду его сильного разбавления).
Если коллоидная частица по форме приближается к сферической, то независимо от ее положения относительно направления светового потока, интенсивность ее освещения в поле ультрамикроскопа будет постоянной.
Другая картина наблюдается, если частицы имеют значительную асимметрию, например, имеют форму палочек или листочков. В этом случае интенсивность рассеянного света будет минимальной, если направление падающего луча параллельно длинной оси палочки или листа, и максимальной, если направление луча перпендикулярно длинной оси.
Вследствие непрерывного теплового движения частицы изменяют свое положение относительно направления светового потока, соответственно, будет изменяться яркость рассеянного света, направленного в сторону объектива. Это будет проявляться в виде мерцания светящихся точек.
Точные размеры и форму коллоидных частиц можно определить методом электронной микроскопии.
Ультрамикроскоп позволяет наблюдать частицы размером до 3 нм.
Механизм образования и строение коллоидной частицы – мицеллы
Как известно, любая коллоидная система состоит из дисперсной фазы и дисперсионной среды. Дисперсную фазу составляют коллоидные частицы, называемые иначе мицеллами(от латинскогоmicelle– крошка, крупинка).
Мицелла в стабилизированном лиофобном золе имеет сложное строение. В ней различают две составные части: внутреннюю – электронейтральную, обычно называемую агрегатом или ядром, и внешнюю – ионогенную, в свою очередь, состоящую из двух ионных слоев или сфер. В связи с этим, внешнюю часть называют иначе двойным электрическим слоем (ДЭС).
Ядроилиагрегатсоставляет основную массу мицеллы, имеет, как правило, в твердых частицах кристаллическое строение, и в зависимости от типа кристаллической решетки представляет собой комплекс, состоящий из атомов, разноименно заряженных ионов либо нейтральных молекул. Число их в зависимости от собственных размеров и размеров коллоидной частицы может изменяться в интервале от нескольких сотен до нескольких десятков тысяч.
Двойной электрический слоймицеллы состоит изадсорбционногоидиффузногослоев.
Ионы адсорбционного слояиспытывают со стороны ядра не только электростатические силы притяжения, но и физические силы другой природы, поэтому они прочно удерживаются на его поверхности и граничат со слоем жидкости, смачивающим твердую часть частицы.
Ионы диффузного слоясвязываются с ядром только за счет электростатических сил. Они располагаются в прилегающем к нему слое жидкости. Под влиянием теплового движения могут свободно перемещаться в нем, уменьшая концентрацию по мере удаления от ядра.
Существует несколько механизмов образования ДЭС на поверхности коллоидных частиц в золях. Чаще всего его формирование происходит двумя способами: адсорбционным путемипутем поверхностной диссоциации.
Какой из них реализуется в той или иной коллоидной системе, зависит от способа ее получения и стабилизации, а также от природы вещества дисперсной фазы.
Рассмотрим сперва механизм образования ДЭС коллоидной частицы адсорбционным путем.
В качестве примера возьмем золь, полученный с помощью метода химической агрегации в результате смешивания истинных растворов двух веществ: нитрата серебра и иодида калия
AgNO3+KI=KNO3+AgI↓ молекулярное уравнений реакции
Ag++I–=AgI↓ сокращенное ионное уравнение реакции
Как следует из уравнения реакции, частицы дисперсной фазы в данном золе образуются за счет связывания друг с другом ионов Ag+ иI–.
В зависимости от молярного соотношения исходных веществ возможны два конечных результата.
1. Исходные вещества взяты в стехиометрическом соотношении, т.е. n(AgNO3) = n(KI).
В этом случае ионы Ag+иI–присутствуют в равных количествах и поэтому принимают одинаковое участие в построении кристаллической решетки частиц осадка, встраиваясь в нее практически одновременно
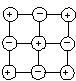
При этом частицы дисперсной фазы на протяжении всего этапа своего роста будут оставаться электронейтральными, их размеры со временем превысят размеры коллоидных частиц (> 10–7м). За счет действия силы тяжести и процесса агрегации (т.е. слипания частиц друг с другом) вещество дисперсной фазы в итоге выпадает в осадок и образования золя не произойдет.
2. Для получения золя в данном случае одно из исходных веществ необходимо взять в избытке. Оно будет играть роль стабилизатора и позволит ограничить, а затем и полностью прекратить увеличение размеров частиц дисперсной фазы, сохраняя их в пределах 10–9÷10–7 м. Рассмотрим механизм данного процесса более подробно. Для этого предположим, что в избытке взяли нитрат серебра (AgNO3).
Значит, концентрация ионов Ag+в растворе будет больше, чем концентрация иодид-ионов (I–). Это приведет к тому, что в процессе роста ядра мицеллы достраивание его кристаллической решетки будет осуществляться в первую очередь за счет ионовAg+. Они, прочно входя в структуру ионной решетки, станут накапливаться на поверхности частицы (агрегата), сообщая ей положительный электрический заряд
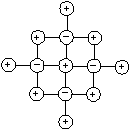
Ионы I–при этом всегда будут запаздывать, т.к. их содержание в растворе гораздо меньше, по сравнению с ионамиAg+.
Вокруг заряженной частицы возникнет электрическое поле, количественно характеризующееся так называемым электротермодинамическимилиповерхностнымпотенциалом(сокращенно –Е-потенциалом).
Величина Е-потенциала прямо пропорциональна заряду частицы, который, в свою очередь, определяется числом избыточных ионов Ag+, расположенных на поверхности агрегата или ядра. В связи с этим, ионыAg+называются иначепотенциалопределяющими ионами.
Согласно правилу Панетта-Фаянса, в роли потенциалопределяющих ионов при образовании коллоидной частицы в первую очередь выступают те ионы, которые входят в состав ее кристаллической решетки или имеют с ними общую группу атомов (например, ионы НСО3– при образовании кристалла СаСО3) и присутствуют в избыточном количестве.
Величина поверхностного потенциала у многих коллоидных частиц достигает 1 В. Частицы с таким относительно большим зарядом будут активно притягивать к себе из раствора противоположно заряженные ионы (называемые поэтому противоионами).
В нашем случае это будут преимущественно NО3–-ионы, т.к. их в растворе, наряду с ионамиAg+, содержится избыточное количество. Но эти ионы, в отличие от ионовI–, не могут встраиваться в кристаллическую решетку частиц осадка. В связи с этим, часть из них прочно и неподвижно закрепится на поверхности ядра за счет действия электростатических и адсорбционных сил, образуя с потенциалопределяющими ионами адсорбционный слой мицеллы. Другая часть, связанная с ядром только кулоновскими силами, под влиянием теплового движения десорбируется с поверхности частицы и расположится в прилегающей к ней жидкой фазе, образуя так называемый диффузный слой. Диффузный слой размыт, не имеет четких границ, и концентрация противоионов в нем уменьшается по мере удаления от поверхности частицы (рис. 59).
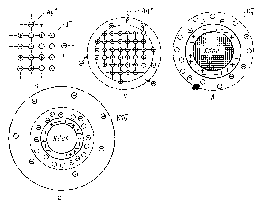
Рис. 59. Схема постепенного образования мицеллы гидрозоля АgI:а – ультрамикрокристалл АgI;б – достраивание микрокристалла ядра за счет избирательной адсорбции из раствора ионов Аg+(стадия образования адсорбционного слоя);в – образование гранулы (завершение образования адсорбционного слоя);г – образование мицеллы и диффузного слоя
Суммарный заряд всех противоионов (как адсорбированных на поверхности ядра, так и удерживаемых в диффузном слое) равен по абсолютной величине, но противоположен по знаку суммарному заряду потенциалопределяющих ионов.
Ядро вместе с адсорбционным слоем составляет твердую часть частицы – гранулу. Она имеет заряд, совпадающий по знаку с зарядом потенциалопределяющих ионов, но меньший по абсолютной величине. Соответственно, и потенциал гранулы также будет меньше Е-потенциала частицы в зависимости от количества противоионов в адсорбционном слое. Потенциал гранулы называетсяэлектрокинетическимилидзета-потенциалом (ζ-потенциал).Кинетическим его называют потому, что он может быть обнаружен и измерен при движении частиц во внешнем электрическом слое. Его можно определить так же, как потенциал, на границе между адсорбционным (неподвижным относительно частицы) и диффузным (подвижным) слоями.
Гранула вместе с диффузным слоем и составляет коллоидную частицу – мицеллу, которая всегда остается электронейтральной, т.к. заряды гранулы и диффузного слоя совпадают по абсолютной величине, но противоположны по знаку.
Чем больше противоионов находится в диффузном слое мицеллы, тем заряд гранулы и ζ-потенциал выше. Если же все противоионы переместятся под действием внешних факторов из диффузного слоя в адсорбционный, то заряд гранулы и его электрокинетический потенциал, наоборот, станут равны нулю.
Строение и состав мицелл в коллоидной химии принято выражать особыми мицеллярными формулами. В этих формулах ядро заключается в квадратные скобки, а гранулы – в фигурные. Формула мицеллы AgI с учетом вышесказанного будет выглядеть следующим образом:
|
{ |
m[AgI] |
· |
n Ag+ (n – x)NO3– |
}+x |
|
xNO3– | ||
|
|
|
|
|
|
|
| ||
|
|
агрегат или ядро |
|
адсорбционный слой |
|
|
диффузный слой | ||
|
|
|
|
|
|
|
| ||
|
гранула |
|
| ||||||
|
|
|
|
|
|
|
| ||
|
мицелла | ||||||||
где m – число молекул или формульных единиц, входящих в состав кристаллической решетки ядра; n – число избыточных потенциалопределяющих ионов, расположенных на поверхности ядра (m > n).
Если при получении золя AgIв избытке взятьKI, то потенциалопределяющими ионами будут являться ионыI–, а противоионами –K+. В этом случае формула мицеллы запишется следующим образом:
{m[AgI]nI– (n – x) K+}–x хK+
Таким образом, в зависимости от условий получения золя гранулы его мицелл могут быть заряжены как положительно, так и отрицательно.
В некоторых литературных источниках составные части мицеллы обозначаются немного иначе. Агрегатом называют электронейтральную часть коллоидной частицы, а ядром – агрегат вместе с расположенными на его поверхности потенциалопределяющими ионами. В состав адсорбционного слоя при этом включают только прочно удерживаемые на поверхности ядра противоионы:
|
{ |
m[AgI] |
n Ag+ |
(n – x)NO3– |
}+х |
|
xNO3– | ||||||
|
|
|
|
|
|
|
| ||||||
|
|
агрегат |
|
адсорбционный слой |
|
|
диффузный слой | ||||||
|
|
|
|
|
| ||||||||
|
|
ядро |
|
| |||||||||
|
|
|
|
|
|
|
| ||||||
|
гранула |
|
| ||||||||||
|
|
|
|
|
|
|
| ||||||
|
мицелла | ||||||||||||
Принципиальной разницы эти 2 способа обозначения составных частей мицеллы не имеют. Поэтому в дальнейшем мы будем придерживаться первого способа.
Рассмотрим более сложные случаи приготовления золей методом химической агрегации и запишем формулы образующихся при этом мицелл.