
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Понятие о скорости химической реакции. Закон действующих масс
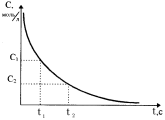
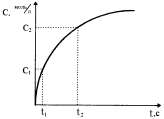
В ходе протекания необратимых химических реакций исходные вещества расходуются, их содержание (или концентрация) в системе уменьшается от начальной величины до нуля. Конечные продукты, наоборот, накапливаются, и с течением времени их концентрация возрастает от нуля до своей максимальной величины (рис.36). Чем за меньший промежуток времени осуществляется этот процесс, тем с большей скоростью протекает химическая реакция.
1 2
Рис. 36. Изменение концентрации исходного (1) и конечного (2) вещества в зависимости от времени протекания реакции
Скорости химических реакций могут лежать в самом широком диапазоне значений. Некоторые реакции заканчиваются за тысячные доли секунды (горение и разложение взрывчатых веществ, пороха), продолжительность других измеряется минутами, часами, сутками. Геохимические реакции, протекающие между веществами в земной коре, совершаются в течение многих тысячелетий.
Рассматриваемые в химической кинетике процессы целесообразно разделить на 2 группы: гомогенные и гетерогенные. Это связано с тем, что характер и способ их протекания в существенной мере зависят от данного признака. Причём, отнесение той или иной реакции к гомогенной или гетергенной определяется лишь агрегатным состоянием исходных веществ, а не её конечных продуктов.
Гомогенными называются химические реакции, у которых исходные вещества находятся в одинаковом агрегатном состоянии или в одной и той же (жидкой либо газообразной) фазе. При этом между веществами отсутствует поверхность раздела.
Например:
1) 2Н2(газ)+ О2(газ) = 2 Н2О(ж.)
гомогенная реакция, протекающая в газовой фазе;
2) KCl (p.-p.) + AgNO3 (p.-p.) = AgСl↓ (тв.)↓ + KNO3 (p.-p.)
гомогенная реакция, протекающая в жидкой фазе.
Характерной особенностью гомогенных реакций является то, что они осуществляются во всём объёме системы, т.е. столкновение молекул либо ионов исходных веществ может произойти в любой её точке.
Гетерогенными называются химические реакции, в которых исходные вещества находятся в разных фазах и, как правило, отличаются друг от друга агрегатным состоянием. Но могут быть гетерогенные реакции, в которых различные фазы находятся в одном и том же агрегатном состоянии. Например, две несмешивающиеся между собой жидкости: углеводород и вода. В таких системах между исходными веществами всегда присутствует поверхность раздела, на которой и протекает гетерогенная реакция.
Например:
1) С(тв.)+ О2(г.)= СО2
2) 2Н2О(ж.)+ Са(тв.)= Са(ОН)2(р.-р.)+ Н2 (г.)
Гетерогенные реакции, протекающие на поверхности твёрдого вещества;
3) Н2О (ж.) + 2NO2(г.)=HNO3(p.-p.)+HNO2(p.-p.)
Гетерогенная реакция, протекающая на поверхности жидкости.
При рассмотрении биохимических процессов, протекающих в живом организме, часто бывает трудно отнести их к соответствующему типу, т.к. в некоторых случаях невозможно однозначно определить агрегатное состояние всех исходных веществ. Особенно это касается реакций, протекающих внутри или на поверхности биологических мембран, а также с участием биополимеров (белков, полисахаридов). В то же время, принадлежность реакции к гомогенному или гетерогенному типу оказывает значительное влияние не только на величину скорости, но и на способ её определения.
При этом под скоростью (υ) гомогенной реакции подразумевают изменение числа молей одного из веществ (конечного или начального) за единицу времени в единице объема системы:
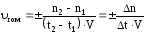 ,
,
где n1 и n2 – химическое количество вещества, соответственно, в начальный (t1) и конечный (t2) момент времени; V – объём системы, в которой протекает реакция; ∆t – время протекания реакции.
Если скорость реакции определяют по возрастанию числа молей одного из конечных веществ, то перед уравнением ставят знак «+», так как в этом случае ∆n> 0 (n2>n1).
Если же скорость реакции определяют по уменьшению числа молей одного из исходных веществ, перед уравнением ставят знак «–», так как в этом случае ∆n< 0 (n2<n1), а скорость химической реакции всегда должна быть положительной величиной.
Уравнение для расчета скорости гомогенной химической реакции можно математически преобразовать с учётом того, что

 ,
,
где С1 и С2 – молярная концентрация вещества в начальный (t1) и конечный (t2) моменты времени.
В соответствии с получившейся новой формулой под скоростью гомогенной реакции подразумевают изменение молярной концентрации одного из веществ (исходного или конечного) за единицу времени.
При этом, если скорость гомогенной реакции определяют на основании уменьшения молярной концентрации одного из исходных веществ, перед формулой ставят знак «–».
Скорость гомогенной реакции имеет размерность моль/дм3∙ с или моль/м3 ∙ с (в системе СИ).
В практике биохимических исследований наряду с молярной концентрацией (моль/л) применяют и другие концентрации растворённых веществ: по массе – мг/100 мл; массовой доле – % /100 мл и др. Единицами измерения скорости в таком случае будут, соответственно, мг/100 мл · с, %/100 мл · с. При необходимости их можно перевести в единицы СИ.
Под скоростью гетерогенной реакции подразумевают изменение числа молей одного из веществ (исходного или конечного) за единицу времени на единице площади поверхности раздела агрегатных состояний или фаз (так как гетерогенная реакция протекает не во всём объёме системы, а на границе раздела агрегатных состояний)
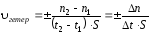 ,
,
где S – площадь поверхности раздела фаз.
Скорость гетерогенной реакции имеет размерность моль/м2 ∙ с.
Часто поверхность твёрдого вещества является особо пористой, развитой. Точное значение её площади в связи с этим определить практически невозможно. В таких случаях среднюю скорость гетерогенной реакции рассчитывают формуле
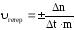 ,
,
где m – масса твёрдой фазы
При этом скорость имеет размерность моль/кг · с.
По вышеприведенным формулам мы всегда определяем, с какой скоростью расходуется или накапливается только одно из веществ, участвующих в реакции. Но так как все вещества связаны в уравнении химической реакции стехиометрическими коэффициентами, изменение количества или концентрации одного из них приводит к эквивалентному изменению количества и концентрации всех остальных. Например, пусть скорость расходования N2в химической реакции синтезаNH3
N2+ 3H2= 2NH3
равна 2 моль/дм3 ∙ с. С учётом стехиометрических коэффициентов скорость расходования Н2будет составлять 2 ∙ 3 = 6 моль/дм3∙ с, аNH3 будет накапливаться в системе со скоростью 2 ∙ 2 = 4 моль/дм3∙ с.
С помощью приведенных выше уравнений можно рассчитать так называемую среднюю скорость реакции, то есть скорость за какой-то отрезок времени ∆t. Считается, что на протяжении этого интервала скорость остаётся неизменной, но это не так. Ведь исходные вещества непрерывно расходуются, а, значит, должна постоянно уменьшаться и скорость реакции. Поэтому вводят понятие обистиннойилимгновеннойскорости, то есть скорости в данный момент времени.
Математически истинную или мгновенную скорость (ист.) реакции принято выражать отношением бесконечно малого изменения количества вещества Δ n (или его концентрации ΔС) к бесконечно малому отрезку времени Δt, в течение которого произошло это изменение, или производной по времени от химического количества вещества либо его концентрации:
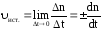
Для гомогенных химических реакций справедливо выражение
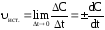
Согласно закону действующих масс, истинная скорость пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Так, для реакции вида
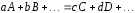
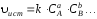 ,
,
где k – коэффициент пропорциональности, называемый константой скорости данной химической реакции.Он равен скорости реакции в тот момент, когда молярные концентрации исходных веществ равны 1 моль/дм3. Константа скорости не зависит от концентраций исходных веществ и при неизменной температуре и отсутствии катализаторов есть величина постоянная для данной реакции. Определяют значениеkдля каждой реакции опытным путем.
Закон действующих масс на основе большого экспериментального материала был сформулирован в 1867 г. норвежскими учёными К. Гульбергом и П. Ваге, и независимо от них в 1865 г. русским учёным Н.И. Бекетовым. В конце XIX века термин «концентрация» ещё не был введён и химики пользовались вместо него термином «действующие массы».
Для реакции синтеза HI
H2(г)+I2(г)= 2HI
истинную скорость реакции можно рассчитать по формуле:
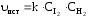
При расчете скорости гетерогенной реакции в формулу подставляют только концентрации тех веществ, которые находятся в растворённом или газообразном состоянии, так как концентрация твёрдого вещества на протяжении всей реакции считается величиной постоянной и учитывается в значении константы скорости. Например:
С(тв.) + О2(газ) = СО2
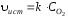
Выведенное на основе закона действующих масс математическое уравнение, с помощью которого можно рассчитать скорость данной химической реакции, называется ее главным (основным) кинетическим уравнением.
