
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Практическое применение электропроводности
Зная эквивалентную электропроводность раствора можно рассчитать степень () и константу диссоциации (K) растворенного в нем слабого электролита:
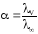
где λV – эквивалентная электропроводность при данном разведении V; λ∞ – предельная эквивалентная электропроводность.
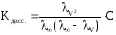
где С – молярная концентрация электролита в растворе.
На измерении удельной электропроводности основан кондуктометрический метод анализа (кондуктометрия).В аналитической химии широкое применение имееткондуктометрическое титрование.При этом точку эквивалентности фиксируют по резкому изменению удельной электропроводности исследуемого раствора в ходе его титрования.Этот метод удобен при исследовании окрашенных или мутных растворов, в которых трудно заметить изменение окраски индикатора.
Рассмотрим в качестве примера титрование сильной кислоты HClсильным основаниемNaOH:
HCl + NaOH = NaCl + H2O
H+ + OH– = H2O
При постепенном прибавлении раствора NaOHк кислоте ионыH+иOH–в растворе заменяются менее подвижными ионамиNa+и электропроводность раствора уменьшается. В точке эквивалентности она будет наименьшая. При добавлении избыточного количества щелочи из-за прекращения реакции нейтрализации ионыOH–станут накапливаться в растворе, резко увеличивая его электропроводность. По результатам измерений строят график зависимости электропроводности от объема прибавленного раствора щелочи (рис. 85).
Абсцисса точки пересечения двух прямых соответствует конечной точке титрования, т.е. точке эквивалентности.

Рис. 85. Кривая кондуктометрического титрования сильной кислоты сильным основанием, (1/Rx– электропроводность раствора)
Методы анализа, основанные на измерении электропроводности, широко применяются для технологического контроля во многих производствах, определения влажности различных объектов, содержания солей в воде, в ряде биологических жидкостей или в почве. По электропроводности растворов можно количественно определять растворимость труднорастворимых соединений, изоэлектрическую точку аминокислот, пептидов и белков.
Равновесные электродные процессы
Электродом называют электронопроводящую фазу (металл или полупроводник), контактирующую с ионным проводником (электролитом).
Электродные процессы представляют собой окислительно-восстановительные реакции, протекающие на электродах. В ходе этих реакций происходит переход электрических зарядов из одной фазы в другую, в результате чего на поверхности обоих фаз сосредотачиваются заряды противоположного знака. А на границе раздела фаз создается двойной электрический слой, которому соответствует определенный скачок потенциала.
Электрод, у которого скачок потенциала определяется только активностью участников реакции, протекающей на его поверхности, называется обратимым.
Если через такой электрод не пропускать электрический ток, то на его поверхности не происходит никаких химических превращений.
Обратимые электроды в зависимости от свойств и устройства делятся на металлические электроды первого и второго рода, редокс-электроды и мембранные (ионные) электроды.
Металлический электрод
При опускании металлической пластинки в воду на её поверхности возникает отрицательный электрический заряд. Механизм его появления состоит в следующем. В узлах кристаллической решетки металлов находятся положительно заряженные ионы или нейтральные атомы, между которыми двигаются свободные электроны.
В водной среде катионы, расположенные на поверхности кристаллической решетки, гидратируются полярными молекулами воды и переходят в жидкую фазу, заряжая её положительно. Металл, в котором появился избыток электронов, приобретает отрицательный заряд (рис. 86).
Отрицательный заряд металлической пластинки препятствует дальнейшему переходу ионов металла в раствор и вызывает обратный процесс – переход его катионов из раствора на металл. При равенстве скоростей этих противоположно направленных процессов в системе устанавливается динамическое равновесие, в ходе которого пластинка и прилегающий к ней водный слой приобретают постоянный электрический заряд, одинаковый по величине, но противоположный по знаку. Величина этого заряда в данном случае будет зависеть от природы металла и от температуры жидкости.
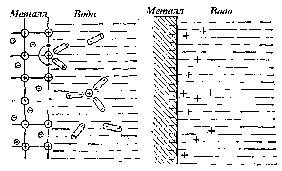
Рис. 86. Схема, объясняющая возникновение разности электрического потенциала на границе металл – вода
Схематически протекающие при этом процессы можно изобразить следующим образом:
Ме – nēМеn+
Двойной электрический слой, возникающий на границе раздела между металлом и жидкостью, имеет не плоское, а диффузионное строение. Электростатическому притяжению катионов со стороны пластинки противодействуют силы взаимного отталкивания между ионами Меn+и их тепловое движение. По мере удаления от поверхности металла концентрация его катионов в водном слое убывает.
Если металлическую пластинку опустить не в воду, а в раствор соли этого металла, то величина заряда, возникающего на пластинке при установлении равновесия, будет определяться ещё и концентрацией ионов металла в исходном растворе.
Это связано с тем, что в ионообменных процессах в данном случае смогут принимать участие и катионы добавленного электролита.
Активные металлы (магний, цинк, железо, кобальт и т.д.) и в воде, и в растворе собственной соли, как правило, заряжаются отрицательно. Пластинки малоактивных металлов (таких как медь, ртуть, серебро и т.д.) в растворе собственной соли, наоборот, заряжаются положительно, т.к. их катионы с поверхности кристаллической решетки могут переходить в раствор в незначительных количествах и поэтому до наступления равновесия преобладает обратный процесс – осаждение катионов из раствора на металл. В результате пластинка приобретает положительный заряд, а раствор, в котором остались анионы соли – отрицательный заряд.
Система, состоящая из металлической пластинки, опущенной в раствор собственной соли, называется металлическим электродом. Разность потенциалов, которая устанавливается между пластинкой и прилегающим к ней водным слоем, называетсяэлектродным потенциалом.
Его величина будет определяться не только прочностью связей в кристаллической решетке металла и температурой системы, но и активностью катионов металла соли в растворе. Эта зависимость выражается уравнением Нернста:
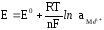
где
Е – электродный потенциал, В; Е0
– стандартный электродный потенциал,
т.е. потенциал, который возникает на
электроде при активности ионов металла
соли в растворе, равной 1 моль/дм3
и температуре 298 K
(25оС); R
– универсальная газовая постоянная,
8,314 Дж/(моль ∙ K);
Т – температура, K;
n - величина заряда
иона металла; F –
постоянная Фарадея, равная 96500 Кл/моль;
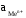 – активность ионов металла в растворе.
– активность ионов металла в растворе.
Для достаточно разбавленных растворов солей активность ионов металла можно заменить их молярной концентрацией.
В этом случае для температуры 298 Kпри переходе от натурального логарифма к десятичному и подстановке значений константRиFуравнение Нернста принимает более простой вид:
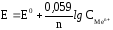
где
 – молярная концентрация ионов металла
в растворе.
– молярная концентрация ионов металла
в растворе.
Металлические электроды подразделяются на электроды первого и второго рода.
Электроды первого рода– это электроды, состоящие из металлической пластинки, опущенной в раствор собственной соли. Величина электродного потенциала для них зависит только от активности катионов соли.
Электроды второго родасостоят из малоактивного металла, покрытого слоем труднорастворимой собственной соли и погруженного в раствор какой-либо легкорастворимой соли, содержащей те же анионы, что и у нерастворимой соли. Потенциал такого электрода зависит как от активности ионов металла в растворе, так и от активности общего для двух солей аниона.
В последнем случае его рассчитывают следующим образом:

где
 – активность аниона легкорастворимой
соли;n – величина
заряда аниона.
– активность аниона легкорастворимой
соли;n – величина
заряда аниона.
Примерами электродов второго рода могут служить хлорсеребряный и каломельный.
Хлорсеребряный электродсостоит из серебряной проволоки, покрытой малорастворимой в воде сольюAgClи погруженной в раствор хлорида калия (рис. 87).
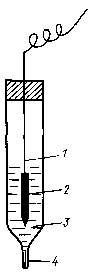
Рис. 87. Хлорсеребряный электрод: 1– серебряная проволока;2– слойAgС1;3– раствор КС1;4– микрощель для контакта с внешним раствором
Ионы Ag+образуются в растворе при частичном растворении солиAgCl
AgClAg++Cl–
Концентрация их будет определяться не только растворимостью хлорида серебра, но и содержанием хлорида калия, который при диссоциации тоже образует ионы Cl–и смещает равновесие вышеприведенной реакции в сторону осаждения из раствораAgCl. Это, в свою очередь, приведет к уменьшению концентрации ионовAg+в растворе.
Каломельный электродсостоит из металлической ртути, покрытой пастой плохо растворимого хлорида ртути(I)Hg2Cl2(иначе каломели), контактирующей с водным растворомKCl(рис. 88).
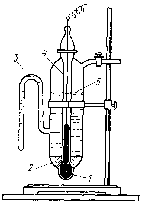
Рис. 88. Каломельный электрод: 1– ртуть;2– паста из каломели;3– отросток для соединения каломельного электрода с другими электродами;4– платиновая проволока;5– раствор хлорида калия
Каломель, растворяясь в Н2О, диссоциирует с образованием ионов Нg22+иCl–:
Нg2Cl2Нg22++ 2Cl–
В присутствии хлорида калия, содержащего одноименный с каломелью ион Cl–, растворимость Нg2Cl2и концентрация ионов Нg22+будет уменьшаться в зависимости от количества в растворе добавленной солиKClи входящих в её состав ионовCl–.
Потенциал хлорсеребряного и каломельного электродов рассчитывают по уравнению
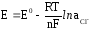
где
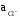 – активность ионовCl–,
образующихся при растворении KCl.
– активность ионовCl–,
образующихся при растворении KCl.
Это связано с тем, что легче измерить в растворе активность ионов Cl–, чем активность катионовAg+или Нg22+, образующихся при растворении плохо растворимой соли.
