
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Механизм гомогенного и гетерогенного катализа
Механизм гомогенного катализа обычно объясняют с помощью теории промежуточных соединений. Согласно этой теории, катализатор (K) сначала образует с одним из исходных веществ промежуточное соединение АK, которое реагирует с другим исходным веществом с восстановлением катализатора. Схематически это можно представить так:
А + Б = АБ (реакция протекает медленно в отсутствии катализатора)
В присутствии катализатора процесс разбивается на 2 стадии:
1) А + K= АK (протекает быстро)
2) АK+ Б = АБ + К (протекает быстро)
Энергия активации каждой из этих двух стадий меньше энергии активации некаталитической реакции (рис. 46).
Конкретным примером гомогенного катализа может служить реакция окисления SO2вSO3в присутствии катализатораNO.
Без катализатора реакция даже при нагревании практически не идет:
2SO2+O2 2SO3
2SO3
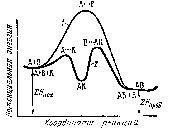
Рис. 46. Энергетическая схема хода реакции: 1 – без катализатора; 2 – в присутствии катализатора
В присутствии NOеё скорость существенно возрастает, но сама реакция протекает в 2 этапа:
1) 2NO + O2 = 2NO2
2) NO2 + SO2 = SO3 + NO
В гетерогенном катализе важнейшую роль играет адсорбция.
Поверхность твёрдого катализатора является неоднородной. На ней выделяют так называемые активные центры. Они возникают в тех местах поверхности катализатора, где атомы или ионы слабее всего связаны с кристаллической решеткой, т.е. там, где силовое поле наименее насыщено: выступы или пики на поверхности, ребра граней кристаллов. Таких активных центров как правило мало. Они составляют всего лишь 0,1% от поверхности катализатора.
При этом реагирующие вещества адсорбируются на этих центрах. В результате чего увеличивается их концентрация на поверхности катализатора. А это отчасти приводит к ускорению реакции. Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул. Под действием катализатора (механизм этого воздействия является достаточно сложным и к настоящему времени детально не изучен) у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными. Энергия активации реакции при этом существенно уменьшается.
После протекания реакции молекулы конечных продуктов десорбируются с активных центров катализатора и они могут присоединять к себе новые молекулы исходных веществ. Таким образом, в этом случае скорость реакции зависит ещё и от скоростей подвода к поверхности катализатора молекул исходных веществ и удаления молекул продуктов. В связи с этим для проведения гетерогенных процессов (как каталитических, так и некаталитических) в промышленности используют метод «кипящего слоя», при котором частички твёрдого вещества поддерживаются во взвешенном состоянии в жидкой или газовой фазе.
Активные центры обладают высокой чувствительностью к действию даже малых количеств каталитических ядов. Это объясняется тем, что их молекулы в первую очередь адсорбируются именно на активных центрах, блокируют их и выводят из участия в реакции.
Особенности каталитической активности ферментов
Ферментаминазываются природные катализаторы, ускоряющие протекание биохимических реакций в животных и растительных клетках, а также в клетках человека. Как правило, они имеют белковую природу и отличаются от обычных катализаторов рядом особенностей.
1. Ферменты обладают более высокой каталитической эффективностью.Так, например, реакцию разложения пероксида водорода
2Н2О2→ 2Н2О + О2
мелкодисперстная платина ускоряет примерно в 103раз, а каталаза, содержащаяся во всех клетках и тканях организма – в 109раз.
