
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Диффузия
Под влиянием теплового и броуновского движения происходит самопроизвольный процесс выравнивания концентраций частиц по всему объему коллоидного раствора. Этот процесс называется иначе диффузией. Диффузия частиц в золях подчиняется тем же законам, что и диффузия молекул либо ионов в истинных растворах и газах, но протекает в сотни раз медленнее из-за гораздо больших размеров частиц.
Количественно процесс диффузии характеризуется коэффициентом диффузии D,который показывает, какое количество вещества проходит через поперечное сечение раствора площадью 1 м2 в течение секунды при градиенте (разности) концентраций по разные стороны сечения, равном единице. А. Эйнштейн, изучая броуновское движение, установил связь коэффициента диффузииDсо средним сдвигом частицы:
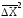 = 2Dt
= 2Dt
С учетом определения
значения
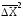 из верхнего уравнения можно выделитьD:
из верхнего уравнения можно выделитьD:
D=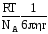
Данные уравнения имеют большое значение в коллоидной химии, т.к. позволяют на основании измерений коэффициента диффузии Dопределить радиус взвешенных коллоидных частиц сферической формы.
Седиментация в золях
Коллоидные частицы в золе постоянно находятся под влиянием двух противоположно направленных сил: силы тяжести, за счет действия которой происходит постепенное оседание вещества, и сил диффузии, под влиянием которых частицы стремятся равномерно распределиться во всем объеме золя.
В зависимости от преобладания тех или иных сил в системе наблюдается либо осаждение частиц дисперсной фазы (седиментация), либо (в случае преобладания сил диффузии) выравнивание их концентрации во всем объеме раствора.
Опытным путем было установлено, что скорость оседания частиц зависит не только от их размера (r), но и от разности плотностей дисперсной фазы (ρф) и дисперсионной среды (ρс), а также от вязкости раствора η. Математически это выражается следующим уравнением:
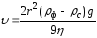
где υ – скорость седиментации;
g – ускорение свободного падения.
В грубодисперсных системах, характеризующихся большим значением r, преобладают процессы осаждения. Такие системы являются седиментационно или кинетически неустойчивыми. В течение короткого промежутка времени в них происходит полное выпадение в осадок дисперсной фазы.
Истинные растворы, наоборот, являются кинетически устойчивыми и могут существовать, не разделяясь на две фазы, неограниченно долгое время.
Коллоидные системы занимают промежуточное положение и их седиментационная устойчивость зависит от размеров частиц.
В большинстве золей, если отсутствует процесс агрегации (слипания) коллоидных частиц, устанавливается так называемое седиментационное равновесие, которое характеризуется равенством скоростей седиментации и диффузии. При этом через единицу площади поперечного сечения в единицу времени проходит вниз столько же оседающих частиц, сколько их перемещается вверх с диффузионным потоком.Седиментационное равновесие характеризуется постепенным уменьшением концентраций частиц в направлении от нижних слоев к верхним. Соответствующим образом изменяется и радиус находящихся в них частиц.
Исследование седиментационного равновесия положено в основу седиментационного анализа, с помощью которого можно определить размеры частиц и их фракционный состав. В медицине седиментационный анализ широко используется для качественной оценки состояния эритроцитов. Скорость оседания эритроцитов (СОЭ) значительно изменяется при различных заболеваниях и позволяет врачу сделать правильное заключение о состоянии организма пациента.
