
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Осмотическое давление в золях
Коллоидные растворы, как и истинные, обладают осмотическим давлением, хотя у золей оно имеет гораздо меньшую величину.
Это объясняется тем, что при одной и той же весовой концентрации коллоидного и истинного растворов в единице объема золя содержится значительно меньше частиц дисперсной фазы, чем в такой же единице объема истинного раствора. В зависимости от размера коллоидных частиц и молекул, либо ионов растворенного вещества, истинного раствора эта разница может достигать 103÷106раз. Соответственно, во столько же раз будет отличаться и величина осмотического давления в данных системах. Теоретически расчеты показывают, что в разбавленных золях значение осмотического давления может колебаться от нескольких Па до нескольких десятков или сотен Па.
Следует также учитывать, что какой-то определенный вклад в величину осмотического давления вносят примеси электролитов и других низкомолекулярных веществ, неизбежно присутствующие в золе. Полностью очистить от них коллоидный раствор, не нарушая его устойчивость, невозможно. Таким образом, реальное осмотическое давление золя, обусловленное только его коллоидными частицами, должно быть еще меньше и точно количественно оценить его не представляется возможным.
В связи с термодинамической неустойчивостью коллоидных растворов в них непрерывно протекают процессы агрегации и дезагрегации, что приводит к непостоянству величины росм.во времени.
Все эти вышеперечисленные обстоятельства препятствуют использованию на практике измерений осмотического давления для количественной характеристики золей.
Относительно малые концентрации коллоидных растворов обуславливают также ничтожно малые значения всех других величин, зависящих от числа частиц растворенного вещества: понижение давления насыщенного пара растворителя над раствором, понижение температуры замерзания раствора, повышение температуры кипения раствора по сравнению с растворителем.
Так, понижение температуры замерзания золя золота (ω(Au) = 0,1%) при размере частиц 4 нм равно всего 0,000004о. Точно экспериментально измерить такие малые изменения величин практически невозможно.
Оптические свойства золей
Коллоидные системы, благодаря соизмеримости размеров частиц дисперсной фазы с длиной световых волн, обладают специфическими оптическими свойствами. Это позволяет использовать оптические методы исследования для изучения структуры и формы частичек, скорости их перемещения, размеров и концентрации.
Рассеяние света (опалесценция)
Рассеяние света в какой-то степени свойственно любой среде. Но наиболее интенсивное светорассеяние происходит в условиях, когда луч света проходит через дисперсную систему, частицы которой имеют размеры меньше длины полуволны падающего света и удалены друг от друга на расстояния, значительно превосходящие длину волны.
Световой луч, встречая на своем пути частицу, как бы огибает ее и несколько изменяет свое направление. При этом имеет место частичное рассеяние в виде волн, расходящихся во все стороны. В результате этого каждая частица является источником новых менее интенсивных волн, т.е. происходит как бы самосвечение каждой частицы. Это, в свою очередь, приводит к самоосвещению среды рассеянными внутри нее электромагнитными волнами. Данное явление получило название опалесценции.
В коллоидных растворах она проявляется в виде матового свечения среды, чаще всего голубоватых оттенков, которое можно наблюдать при боковом освещении золя на темном фоне.
С опалесценцией связано специфичное для коллоидных систем явление – конус Тиндаля (эффект Тиндаля).При пропускании узкого пучка света через золь и наблюдении в перпендикулярном лучу направлении в растворе видна светящаяся полоса, узкая со стороны входа света и более широкая на выходе, т.е. имеющая форму расходящегося конуса. Если свет пропускать в виде сходящегося пучка, светящаяся дорожка будет иметь форму сходящегося конуса (рис. 57).
Если на пути луча света поставить сосуд с истинным раствором, световая дорожка в нем будет почти незаметна (рис. 57).
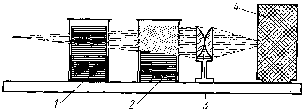
Рис. 57. Эффект Тиндаля: 1– стакан с растворомNаС1;2 – стакан с золем;3– оптическая линза;4– настольная лампа со светонепроницаемым футляром
Теория рассеяния света коллоидно-дисперсными системами была разработана Рэлеем в 1871 г., который вывел уравнение для расчета интенсивности рассеянного света:
I=I0K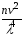
где I0 – интенсивность падающего света;
I – интенсивность света, рассеянного золем;
n – число частиц в единице объема золя;
v – объем одной частицы золя;
λ – длина волны падающего света;
K – константа, зависящая от показателей преломления дисперсной фазы и дисперсионной среды.
Из уравнения Рэлея следует, что рассеяние света (I) пропорционально концентрации частиц, квадрату их объема и обратно пропорционально четвертой степени длины волны падающего света. Таким образом, рассеяние коротких волн происходит более интенсивно. В связи с этим бесцветные золи в проходящем свете кажутся красноватыми, а в рассеянном, т.е. при наблюдении сбоку – голубыми.
На интенсивном рассеянии лучей коротковолновой части спектра основано применение ламп синего света в целях светомаскировки и ламп красного света для сигналов опасности. Синие лучи при прохождении через слой воздуха, содержащий частицы пыли, дыма или тумана, полностью рассеиваются. Красные же лучи рассеиваются в значительно меньшей степени и красный сигнал виден на большее расстояние.
Уравнение Рэлея применимо для частиц размером от 5 до 100 нм, т.е., лишь для типичных золей. С его помощью можно рассчитать концентрацию коллоидных частичек в системе.
