
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Второе начало термодинамики. Свободная энергия Гиббса
Первое начало термодинамики дает строгое количественное описание того, как изменяется энергия любой системы в результате обмена ею с окружающей средой в форме теплоты, работы или передачи вещества. Но оно не позволяет определить условия, при которых термодинамические процессы будут протекать самопроизвольно, вплоть до наступления равновесия, а также спрогнозировать их направленность. Для выяснения этих вопросов, имеющих большой теоретический и практический интерес, используется второе начало (второй закон) термодинамики.
В термодинамических системах, как было показано ранее, наряду с уменьшением энтальпии, направленность любого физического и химического процесса определяется еще и изменением энтропии. Причем действие этих факторов часто приводит к взаимнопротивоположным результатам.
Так, при протекании химических реакций энтальпийному фактору (ΔН < 0), действующему в направлении агрегации атомов, ионов либо молекул в более сложные частицы за счет реализации сил химической связи и межмолекулярного воздействия, и способствующему упорядочиванию системы, противостоит энтропийный фактор (S> 0), инициирующий процессы дезагрегации молекул, т.е. распад их на более простые и меньшего размера частицы, и увеличению вследствие этого энтропии.
Для сопоставления и сравнения действия данных факторов их необходимо выразить в одинаковых единицах измерения. Так как изменение энтальпии (ΔН) измеряется в Дж/моль, а изменение энтропии (S) – в Дж/моль ·K, необходимо умножитьSна Т. В результате этого размерность произведения Т ·Sстанет такой же, как и у изменения энтальпии, а именно:
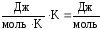
Умножение Sна Т вполне правомерно, т.к. повышение температуры усиливает различные виды движения частиц, а значит и их беспорядок, приводя тем самым к возрастанию энтропии.
При отсутствии энтропийного фактора (S= 0) самопроизвольно могут идти процессы, сопровождающиеся положительным тепловым эффектом (ΔН < 0).
Если система изолирована, обмена энергии с внешней средой нет (ΔН = 0), а значит отсутствует энтальпийный фактор, то самопроизвольно будут идти процессы, сопровождающиеся увеличением энтропии (S> 0).
В том случае, когда в системе действуют оба фактора, направление процесса определяется их суммарным влиянием, причем уменьшение энтальпии характеризует стремление системы к порядку, увеличение энтропии – к беспорядку.
Если система находится в состоянии равновесия, то, очевидно, справедливо равенство:
ΔН = ТS или ΔН – ТS = 0.
Опытным путем установлено, что для самопроизвольно идущих процессов при условии одновременного действия энтропийного (S> 0) и энтальпийного (ΔН < 0) факторов справедливо соотношение:
ΔН – ТS< 0 или (Н2– Н1) – Т(S2–S1) < 0.
Преобразовав это неравенство, получим:
(Н2– ТS2) – (Н1- ТS1) < 0.
Функцию (Н – ТS) называют изобарно-изотермическим потенциалом (сокращенно – изобарным потенциалом) или свободной энергией Гиббса и обозначают буквой G.Она названа таким образом в честь американского физика, автора классических трудов по химической термодинамике Гиббса Джозайя Уилларда.
Этот новый термодинамический параметр относится к функциям состояния, так как его изменение определяется только начальным и конечным состоянием системы, но не зависит от пути и способа ее перехода из одного состояния в другое.
Понятие
химического потенциала ввел в своей
работе «О равновесии гетерогенных
веществ» американский физик-теоретик,
один из основоположников термодинамики
и статистической механики
Дж.
Уиллард Гиббс (1839 – 1903).
В этой статье он разработал теорию
термодинамических потенциалов, доказал
правило фаз (общее условие равновесия
гетерогенных систем), создал термодинамику
поверхностных явлений и электрохимических
процессов; обобщил принцип энтропии,
применив второе начало термодинамики
к широкому кругу процессов, и вывел
фундаментальные уравнения, позволяющие
определять направление реакций и условия
равновесия для смесей любой сложности.
Многие идеи современной равновесной
термодинамики берут начало из этих
работ Дж. Гиббса. 
В условиях постоянного давления и температуры (p = const и T = const) любой физический или химический процесс самопроизвольно может протекать только в том случае, если он сопровождается уменьшением изобарно-изотермическо-го потенциала системы (G2 – G1 = G < 0). Это определение составляет сущность второго закона или второго начала термодинамики.
Для процессов, идущих при постоянной температуре и объеме, вводится соответствующая функция F = U – TS, которая называется иначе изохорно-изотермическим потенциалом или свободной энергией Гельмгольца. В системах, находящихся при данных условиях (V = const и T = const), самопроизвольно могут осуществляться процессы, сопровождающиеся уменьшением изохорно-изотермического потенциала (F < 0).
Соотношение между термодинамическими функциями U,H,GиFпредставлено на рис. 12.
Энергия Гиббса (как и энергия Гельмгольца) характеризует способность системы совершать полезную работу, т.е. определяет ту часть ее внутренней энергии (называемой иначе свободной энергией), которая в изобарно-изотермических (или изохорно-изотермических условиях), может превращаться в работу (отличную от работы расширения системы).
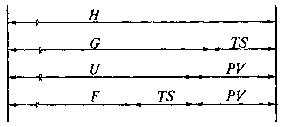
Рис. 12. Соотношение между термодинамическими функциями U,H,GиF
Величина GилиFпри термодинамически обратимом процессе равна максимально полезной работе, которую может совершить система, или меньше ее при необратимом процессе, т.к. часть свободной энергии при этом рассеивается в виде теплоты и превращается в связанную энергию.
В связи с этим можно дать другое определение второго начала термодинамики. В неизолированных системах самопроизвольно могут протекать лишь те процессы, в ходе которых совершается полезная работа против внешних сил.
Для химических реакций, протекающих в человеческом организме, а также в лабораторных или производственных условиях (при p=constиT=const) принципиальное значение имеет изменение свободной энергии Гиббса (G).
Если величина Gимеет отрицательный знак (G< 0), то реакция самопроизвольно может протекать только в прямом направлении. Причем абсолютное значение разностиH–TS=Gбудет определять движущую силу данного процесса.
Если же G> 0, то в условиях, для которых были измереныHиTS, в прямом направлении данная реакция протекать не может. Зато осуществимой окажется обратная реакция, для которойGбудет иметь отрицательное значение.
Необходимо отметить, что отрицательные значения G (или F) определяют только принципиальную возможность самопроизвольного осуществления процесса, но ничего не говорят о скорости и условиях, необходимых для его начала.
Так, для химической реакции горения различных органических и неорганических веществ уже при комнатной температуре G<< 0, но эти вещества начинают гореть только при нагревании. Во многих случаях, чтобы увеличить скорость реакции, при определенных условиях необходимо использовать катализаторы, подбирать соответствующие концентрации исходных веществ.
Величина и знак G для многих реакций зависит от температуры процесса. В этом случае, в зависимости от условий, принципиальная возможность протекания реакции в том или ином направлении может изменяться.
Реакции, для которых H< 0, аS> 0, могут самопроизвольно протекать в прямом направлении при любых температурах, т.к.Gу них всегда будет меньше нуля. Примером такой реакции может служить гидролиз пептидов или белков.
Если для химической реакции H> 0, аS< 0, то ее самопроизвольное протекание в прямом направлении всегда неосуществимо, т.к. энергия Гиббса в данном случае возрастает. Примером такой реакции может служить процесс фотосинтеза – образование глюкозы и кислорода из углекислого газа и воды, – который невозможен без участия солнечной энергии.
В случае H> 0 иS> 0 самопроизвольному протеканию реакции в прямом направлении способствует энтропийный фактор. При низких температурах отрицательное значениеH–TSможет быть невозможно, но при нагревании – оно возможно и реакция становится осуществимой в прямом направлении. Например, тепловая денатурация белковых молекул.
Если H< 0 иS< 0, то отрицательное значениеGтакой химической реакции наблюдается только при достаточно низких температурах.
При вычислении Gв химической реакции можно использовать следствие из закона Гесса, применяемое для расчета ее теплового эффекта (изменения энтальпии). В данном случае оно будет звучать следующим образом.
Изменение энергии Гиббса химической реакции равно алгебраической сумме G образования продуктов реакции за вычетом алгебраической суммы G образования исходных веществ (с учетом их стехиометрических коэффициентов).
Gхимич. реакции=Gобр. конечных веществ–G обр. исходных веществ
где G обр. – изменение энергии Гиббса химической реакции, в ходе которой образуется 1 моль сложного вещества из соответствующих простых веществ.
Значение Gобр. для вещества зависит от температуры
и давления реакции, поэтому его, как
правило, определяют для стандартных
условий (Т = 298Kи р = 101,325
кПа, концентрация вещества в растворе
= 1 моль / дм3) и обозначают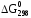 .
Значения
.
Значения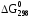 определены для многих соединений и
приводятся в соответствующих справочниках
или таблицах. Величину
определены для многих соединений и
приводятся в соответствующих справочниках
или таблицах. Величину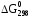 для простых веществ, устойчивых при
стандартных условиях, принять равной
0.
для простых веществ, устойчивых при
стандартных условиях, принять равной
0.
Для химических реакций:
Fe2O3(к)+ 3CO(г)= 2Fe(к)+ 3CO2(г)
изменение энергии Гиббса можно рассчитать следующим образом (с учетом таблицы 4)
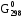 = (3
= (3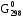 обр.(СО2(г))
– (3
обр.(СО2(г))
– (3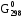 обр.(СО(г))
+
обр.(СО(г))
+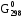 обр.(Fe2O3(к))
= 3 · (–393,5) – 3 · (–110,5) + (–822,2) = –1180,5 –
(1153,7) =
–26,8 (кДж).
обр.(Fe2O3(к))
= 3 · (–393,5) – 3 · (–110,5) + (–822,2) = –1180,5 –
(1153,7) =
–26,8 (кДж).
Если 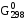 << 0, то можно считать, что осуществимо
самопроизвольное протекание реакции
в прямом направлении не только при
стандартных условиях, но и в широком
диапазоне более высоких температур.
Неравенство
<< 0, то можно считать, что осуществимо
самопроизвольное протекание реакции
в прямом направлении не только при
стандартных условиях, но и в широком
диапазоне более высоких температур.
Неравенство >> 0 отвечает принципиальной
невозможности протекания процесса в
прямом направлении как при Т = 298оK,
так и в других условиях. К сожалению, не
существует определенных минимальных
значений
>> 0 отвечает принципиальной
невозможности протекания процесса в
прямом направлении как при Т = 298оK,
так и в других условиях. К сожалению, не
существует определенных минимальных
значений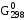 ,
за пределами которых процесс можно
считать в принципе реализуемым в прямом
(G<
0) или в обратном (G> 0) направлениях.
,
за пределами которых процесс можно
считать в принципе реализуемым в прямом
(G<
0) или в обратном (G> 0) направлениях.
Таблица 4.Стандартные величины А/С 298 некоторых веществ (кДж/моль)
|
Вещество |
∆G°298 |
Вещество |
∆G°298 |
Вещест-во |
∆G°298 |
Вещество |
∆G°298 |
|
AgCl (тв.) Ag2O(тв.) Al3+ (р.) AlCl3 (тв.) AlBr3 (тв.) Al2O3 (тв.) CO (г.) CaCO3(тв.) CO2 (г.) FeBr3 (тв.) Fe2O3 (тв.) |
-109,8 -31,1 -490,5 -628,6 -490,6 -1582 -110,5 -1128,8 -393,5 -246 -822,2 |
NaCl(тв.) NaF(тв.) LiF (тв.) Cl- (р.) HCl (г.) HCl (р.) ClO2(г.) Cl2O(г.) HF (г.) HBr(г.) HI (г.) |
-384,1 -543,3 -584,1 -131,4 -94,79 -131,2 122,3 93 -272,8 -51,2 1,78 |
NH3 (г.) N2H4 (г.) NH4Cl(тв.) NO (г.) NO2 (г.) N2O4 (г.) HNO3(г.) Pбел (тв.) Pкрас (тв.) P4O10 (тв.) PH3 (г.) |
-16,71 159,28 -203,2 86,58 51,5 98,29 -74,8 0 -11,9 -2697,8 13,39 |
H2O(г.) H2O(ж.) H+(р.) OH-(р.) O3 (г.) H2O2(ж.) H2S(г.) H2Se(г.) H2Te(г.) SO2 (г.) SO3 (г.) |
-228,61 -237,24 0 -157,42 162,7 -120,4 -33,8 -19,7 - -300,2 -370 |
