
- •Глава 26. Кинетика электрохимических процессов
- •26.1. Неравновесные электрохимические процессы. Электролиз
- •26.2. Поляризация электродов
- •26.2.1. Концентрационная поляризация
- •26.2.2. Электрохимическая поляризация
- •26.2.3. Напряжение разложения
- •26.3. Перенапряжение
- •26.3.1. Теории водородного перенапряжения
- •26.3.2. Кинетика электролитического выделения кислорода
- •26.7. Полярография
- •26.5. Электрохимическое выделение металлов
- •26.6. Электрохимическое растворение и пассивность металлов
- •26.7. Коррозия металлов
26.7. Полярография
Наиболее распространенным методом исследования электрохимических процессов является установление зависимости между силой тока и напряжением – вольтамперометрия. Первым по времени появления и одним из наиболее распространенных методов вольтамперометрии являетсяполярография. Полярографический метод разработан чешским ученым Я.Гейровским (1922). Он заключается в проведении электролиза исследуемого раствора в электролитической ячейке и снятии кривой зависимости силы тока от подаваемого на ячейку напряжения –полярограммы.
Простейшая схема полярографической установки (полярографа) представлена на рисунке 26.2. В сосуде Внаходится исследуемый раствор, в который погружен стеклянный капиллярD, через который под давлением ртутного столба медленно вытекает ртуть из сосудаС, высоту подъема которого можно регулировать. Образующиеся на конце капилляра ртутные капли через равные промежутки времени (период капания, он составляет обычно несколько секунд) отрываются от капилляра и падают на дно сосуда.
Рис. 26.2. Схема
полярографической установки

При прохождении тока в общем случае изменяются потенциалы обоих электродов, а также часть приложенного напряжения падает из-за сопротивления раствора:
Е= А– K+IR, (26.37)
где Е– внешняя разность потенциалов,AиК– потенциалы анода и катода,I– сила тока,R– омическое сопротивление раствора.
Сила тока в ячейке обычно невелика (105– 106А), поэтому практически все изменение напряжения при переходе от одного значения тока к другому обусловлено изменением потенциала капельного микроэлектрода, поверхность которого на несколько порядков меньше поверхности донной ртути. К исследуемому раствору добавляют также избыток индифферентного электролита (фоновый электролит) для обеспечения высокой электрической проводимости раствора, поэтому падение напряжения в ячейке можно не учитывать. Таким образом, можно считать, что
Е = K + const, (26.38)
т.е. кривая зависимости сила тока напряжение фактически является кривой зависимости силы тока от потенциала капельного электрода. Если в растворе находятся частицы, способные восстанавливаться на ртутном электроде, то, снимая зависимость I–E, получаютполярографическую кривую, илиполярограмму(рис. 26.3).
Рассмотрим явление концентрационной поляризации на капельном ртутном электроде при разряде ионов металла. При таком разряде на ртутном электроде происходит образование амальгамы металла, и потенциал электрода
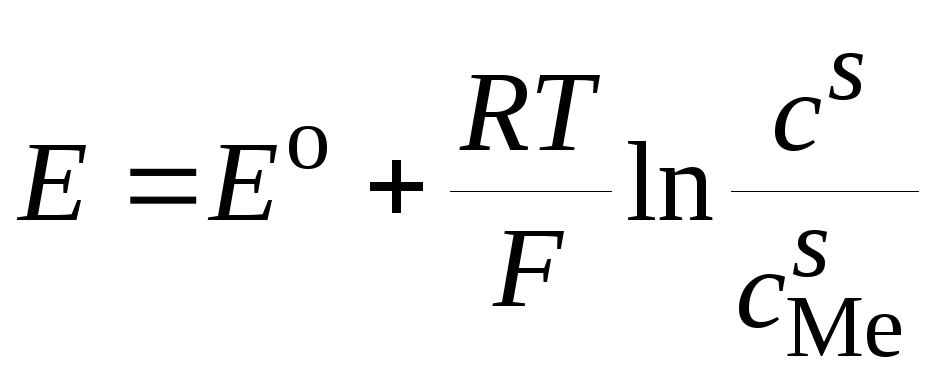 , (26.39)
, (26.39)
где cs– концентрация
амальгамы металла вблизи поверхности
электрода;![]() – концентрация ионов металла в растворе
около электрода.
– концентрация ионов металла в растворе
около электрода.
Чтобы найти уравнение концентрационной
поляризации на капельном ртутном
электроде, необходимо определить
величины csи![]() в зависимости от протекающего тока.
в зависимости от протекающего тока.
Рис. 26.3.
Полярографическая кривая

![]() , (26.40)
, (26.40)
где D– коэффициент диффузии;
m– масса ртути, вытекающий в единицу времени (мг.с1);
– период капания (с);
соисs– концентрация ионов металла в объеме раствора и вблизи поверхности электрода (моль/см3);
– коэффициент, постоянный при заданном режиме работе полярографической установки.
Когда скорость разряда ионов на электроде становится больше скорости подхода ионов к поверхности электрода за счет диффузии, концентрация сsстановится равной нулю, а диффузионный ток достигает величины предельного диффузионного токаIд,пред:
Iд,пред=со(26.26)
По уравнению Ильковича можно определить число электронов z, принимающих участие в электродной реакции, коэффициенты диффузии и концентрации веществ. Уравнения (26.40 – 26.41) могут не только являться основой количественного анализа, но и служить для прямого расчета концентрации определяемого вещества по предельному току, если известен коэффициент. Однако расчетные значенияне являются достаточно надежными, поэтому на практике при количественном анализе проводят калибровку полярографической установки по стандартным растворам.
Качественный полярографический анализ основан на уравнении Гейровского – Ильковича:
![]() , (26.42)
, (26.42)
где Е1/2–потенциал полуволны, соответствующий случаю, когдаI=Iд,пред/2. Потенциал полуволны определяется только природой восстанавливаемого вещества и не зависит от его концентрации.
Кроме капающего ртутного электрода в полярографии используется также вращающийся дисковый электрод (платиновый). Его особенность заключается в том, что в любой точке его поверхности диффузионный слой имеет постоянную толщину. Большие возможности для исследований дает комбинированный электрод из диска и кольца. Диск и кольцо закрепляются в твердом изоляционном материале и образуют вместе один вращающийся электрод с двумя независимыми токоподводами. Это дает возможность осуществлять раздельную поляризацию диска и кольца. Поэтому вещество, которое окисляется на диске, может восстанавливаться на кольце и наоборот. Благодаря этому можно устанавливать природу продуктов электродной реакции, их константы устойчивости и т.д.
Полярографический метод позволяет достаточно быстро проводить анализ сложных систем с малым содержанием веществ (до 105моль/л). Он применяется для определения многих органических соединений, растворенных газов (например, кислорода). Кроме того, полярография является одним из методов исследования кинетики и механизма электродных процессов.
