
- •Глава 21. Теоретические представления химической кинетики
- •21.1. Элементарная теория активных столкновений для бимолекулярных реакций
- •21.2. Мономолекулярные реакции
- •21.3. Теория активированного комплекса (переходного состояния)
- •21.3.1. Поверхность потенциальной энергии
- •21.3.2. Основное уравнение теории активированного комплекса
- •21.3.3. Свободная энергия активации
- •21.3.4. Сравнение теорий активных столкновений и переходного состояния
- •21.4. Реакции в растворах
Глава 21. Теоретические представления химической кинетики
21.1. Элементарная теория активных столкновений для бимолекулярных реакций
В основе теории лежит положение о том, что реакция осуществляется при столкновении молекул, поэтому скорость химической реакции должна быть пропорциональна числу сталкивающихся молекул в единице объема за единицу времени.
Согласно молекулярно-кинетической теории число соударений Zоодинаковых молекул в 1 см3газа за 1 с равно
![]() см–3·с–1, (21.1)
см–3·с–1, (21.1)
Рис. 21.1. Схема
столкновений между двумя молекулами:
а)
отсутствие взаимодействия;
б)
притяжение; в)
отталкивание
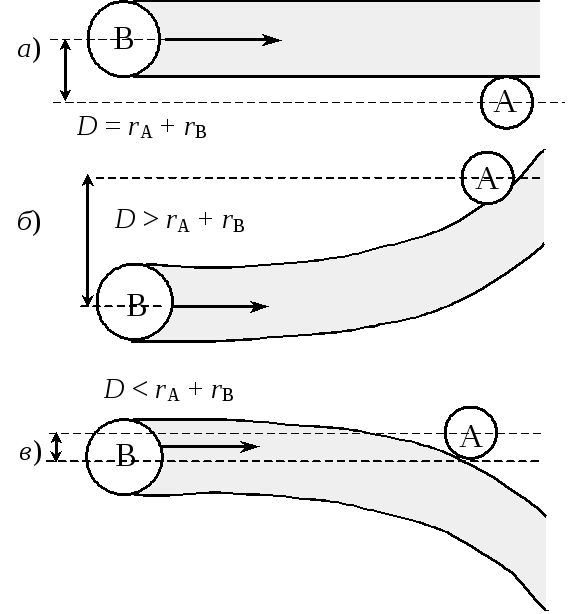
В случае идеального газа, т.е. при отсутствии взаимодействия, Dравен сумме радиусов сталкивающихся частиц –D=r1+r2или для одинаковых частицD= 2r. Фактически же в реальных системах, где пренебречь взаимодействием нельзя, для столкновения необходимо, чтобы частицы находились на некотором расстоянииD< 2r, если между ними действуют силы отталкивания, илиD> 2r, если действуют силы притяжения (рис. 21.1). В связи с этим величинаDпредставляетэффективныйдиаметр столкновений.
Число столкновений разных молекул 1 и 2
 см–3·с–1. (21.2)
см–3·с–1. (21.2)
Если при каждом соударении происходит акт химического взаимодействия, то скорость реакции должна быть равной величине ZoилиZo1,2. Однако экспериментальные данные указывают на то, что действительные скорости реакций на несколько порядков ниже, чем рассчитанные по числу столкновений. Например, в реакции разложения йодистого водорода HI + HIH2+ I2 при 556 К и концентрации 1 моль HI в 22,4 л газовой смеси число сталкивающихся молекул равно примерно 11029см–3с–1, число же молекул, которые реагируют, полученное из эксперимента, равно 41011см–3с–1. Отсюда можно сделать вывод о том, что не всякое столкновение активно, т.е. приводит к акту химического взаимодействия.
Существует несколько причин снижения эффективности соударений. Например, при столкновении простых атомов или радикалов может образоваться колебательно-возбужденная молекула, обладающая избыточной энергией, поэтому такая молекула существует очень короткое время. Наиболее вероятным путем стабилизации является передача избыточной энергии третьему телу – другой молекуле, стенкам сосуда и т.п. Если время до соударения с третьим телом превышает время жизни колебательно-возбужденной молекулы, она распадается на исходные частицы. Другой причиной снижения эффективности является необходимость определенной ориентации в пространстве при реакции между сложными молекулами. Чтобы реакция осуществилась, молекулы должны сближаться своими активными, реакционноспособными группами. В качестве характеристики снижения эффективности за счет пространственной ориентации используется стерический множительР, величина которого может изменяться в пределах примерно от 10–5до 1. В теории активных соударений нет методов вычисления стерического множителя, и его оценивают при сравнении рассчитанной и определенной из опыта скоростей.
Однако основной причиной, снижающей эффективность соударений, является энергетический фактор. Для того чтобы прошел элементарный акт взаимодействия, необходимо преодолеть силы отталкивания, возникающие при сближении молекул, ослабить или разрушить межатомные связи в молекуле так, чтобы соответствующие атомы могли сблизиться и образовать новые связи. Для этого необходима значительная энергия – энергия активации.
Таким образом, с точки зрения теории столкновений, энергия активации – это минимально необходимая энергия, которой должна обладать молекула в момент столкновения, чтобы прореагировать. Такую энергию могут иметь молекулы с повышенной кинетической энергией поступательного движения или молекулы, атомы которых находятся на более высоких энергетических уровнях – активные молекулы.
В простейшем случае теории для бимолекулярных реакций рассматривается относительная кинетическая энергия молекул вдоль линии, соединяющей их центры. Скорость реакции считается равной числу активных столкновений Z; число таких столкновений между молекулами, кинетическая энергия движения которых вдоль линии центров равна или больше энергии активацииE, будет равно в соответствии с законом распределения Больцмана
![]() . (21.3)
. (21.3)
С учетом уравнений (21.1) или (21.2) скорость реакции равна
![]() см–3·с–1. (21.4)
см–3·с–1. (21.4)
или
 см–3 ·с–1. (21.5)
см–3 ·с–1. (21.5)
Запишем кинетическое уравнение для скорости реакции через константу скорости:
v=kn2илиv=kn1n2. (21.6)
Сравнивая эти уравнения с выражениями (21.4) и (21.5), получим для константы скорости реакции:
![]() (21.7)
(21.7)
для реакции между одинаковыми молекулами или
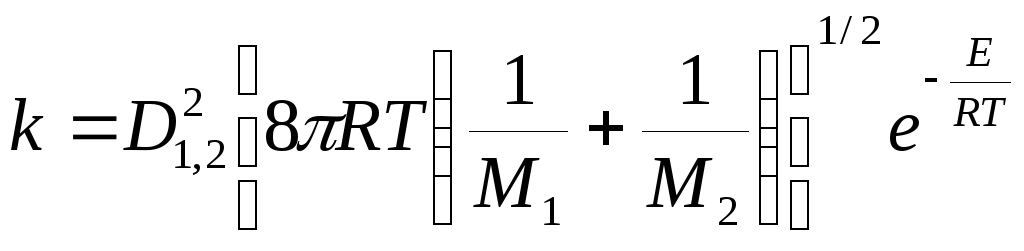 (21.8)
(21.8)
для реакции между разными молекулами.
Таким образом, общее теоретическое уравнение для константы скорости бимолекулярной реакции можно записать в виде произведения предэкспоненциального множителя и экспоненты:
![]() . (21.9)
. (21.9)
которое по форме совпадает с уравнением Аррениуса (20.98). Теория активных соударений не дает возможности вычисления истинной энергии активации E, поэтому при сопоставлении теории с экспериментом можно сравнивать или предэкспоненциальные множители или брать опытную величину энергии активацииEпри расчете констант скорости.
Установим связь между истинной Eи опытнойEAэнергиями активации. Для этого представим уравнения (21.7) или (21.8) в форме
![]() , (21.10)
, (21.10)
где Свключает все постоянные, и прологарифмируем его:
![]() . (21.11)
. (21.11)
Дифференцируя по температуре, получим
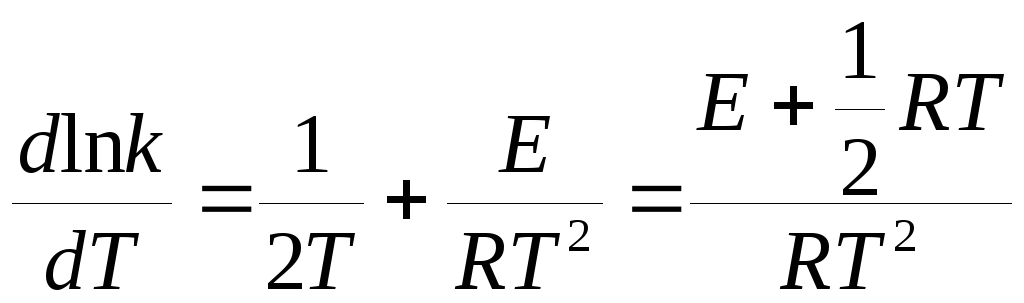 . (21.12)
. (21.12)
Сравнение последнего уравнения с уравнением Аррениуса (20.96) показывает, что опытная и истинная энергии активации связаны соотношением
![]() , (21.13)
, (21.13)
т.е. истинная энергия активации зависит от температуры, если считать Eпостоянной. Однако, поскольку величина 1/2RTзначительно меньше энергии активации, практически можно считать значенияEAиEравными и не зависящими от температуры.
Совпадение уравнения Аррениуса с
уравнением теории активных соударений
позволяет вычислить предэкспоненциальный
множитель Aв предположении, чтоA=Zo, или более точноZo
= AT1/2. Если принять для
газокинетического диаметра величины
порядка 10–8см, то для обычных
молекул при не слишком высоких температурах
значениеZо![]() 3
1014см3моль–1с–1= 3 1011л моль–1с–1
3
1014см3моль–1с–1= 3 1011л моль–1с–1
Реакции, для которых предэкспоненциальные множители близки к этой величине, называют “нормальными”. Наряду с ними существуют “быстрые” реакции со значениями Zона 1 – 3 порядка больше. Объяснить их можно участием в процессе активации не только степеней свободы поступательного движения, но также колебательных и других видов движения. Появление быстрых реакций в растворах можно объяснить также каталитическим действием растворителя. В случае "медленных" реакцийZозначительно меньше (на 2 – 4 порядка) "нормального" значения 1014. Формально в этом случае теория вводитстерический факторPв выражение для константы скорости:
![]() . (21.14)
. (21.14)
В некоторых случаях величина Pдостигает значений 10–3– 10–4.
