
- •Глава 17. Электрическая проводимость растворов электролитов
- •17.1. Удельная и молярная электрические проводимости
- •17.2. Подвижность ионов
- •17.3. Зависимость молярной электрической проводимости от концентрации
- •17.4. Эффекты Вина и Дебая – Фалькенгагена
- •17.5. Электрическая проводимость неводных растворов
- •17.6. Числа переноса
- •17.7. Измерение электрической проводимости растворов электролитов
- •17.8. Кондуктометрическое титрование
- •17.9. Определение констант диссоциации
Глава 17. Электрическая проводимость растворов электролитов
17.1. Удельная и молярная электрические проводимости
В зависимости от природы проводника носителями электрического тока, т.е. частицами, которые переносят заряд в системе, могут быть электроны или ионы. В первом случае, когда электрическая проводимость обеспечивается электронами, вещества являются проводниками первого рода, к ним относятся металлы. Кпроводникам второго родаотносятся растворы электролитов, расплавы, твердые электролиты, ионизированные газы. Перенос зарядов в таких системах связан с переносом вещества, поэтому прохождение электрического тока может вызывать изменения в проводниках с ионной проводимостью.
Способность проводника проводить электрический ток характеризуется его электрической проводимостьюL, которую можно определить как количество электричества, переносимого через сечение проводника в единицу времени при единичном напряжении. Электрическая проводимость численно обратна сопротивлению проводникаR. Сопротивление
![]() (17.1)
(17.1)
где – удельная сопротивление проводника,l– длина проводника,S– площадь поперечного сечения проводника. Следовательно, электрическая проводимость
![]() , (17.2)
, (17.2)
где =1/–удельная электрическая проводимость.
В случае растворов электролитов величина Sпредставляет собою площадь электродов, между которыми находится раствор, аl– расстояние между ними.
Удельная электрическая проводимость равна электрической проводимости проводника с единичными размерами (S= 1,l= 1), ее выражают в Ом–1м–1(основная единица), или См.м–1(1 Ом–1= 1 См – Сименс). Для растворов электролитов часто используется также выражениев Ом–1см–1, т.е.представляет электрическую проводимость 1 см3раствора, помещенного между плоскими параллельными электродами, находящимися на расстоянии 1 см друг от друга.
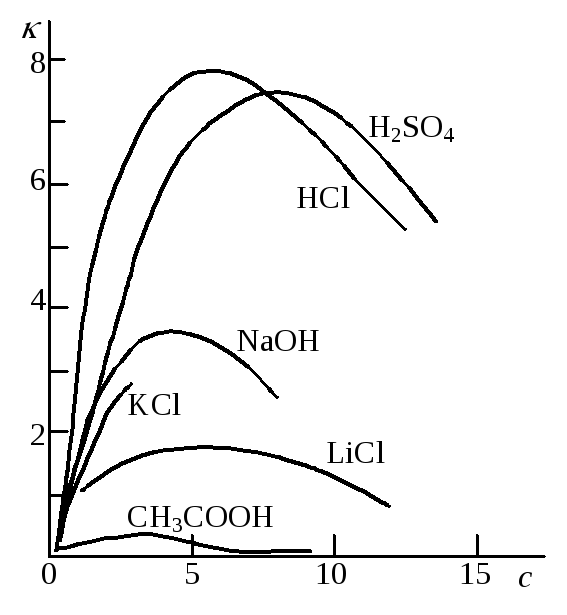
Удельная электрическая проводимость зависит от природы электролита и растворителя, температуры, концентрации электролита. На рисунке 17.1 приведен пример зависимости удельной электрической проводимости растворов некоторых электролитов от концентрации. В случае сильных электролитов характерным является наличие максимума на кривых зависимости –c.
Это связано с тем, что при постоянных температуре и напряженности электрического поля электрическая проводимость обусловлена числом носителей зарядов, т.е. ионов, а также скоростью их перемещения. В области разбавленных растворов скорость движения ионов мало зависит от концентрации, и удельная электрическая проводимость возрастает почти прямо пропорционально концентрации. По мере увеличения концентрации усиливается межионное взаимодействие, возрастает плотность ионной атмосферы, что приводит к уменьшению скорости движения ионов. Этот эффект начинает преобладать над увеличением числа ионов, поэтому при высоких концентрациях удельная электрическая проводимость уменьшается.
В растворах слабых электролитов ионная концентрация невелика и скорость движения ионов мало зависит от концентрации, но с изменением концентрации изменяется степень диссоциации электролита, а следовательно, и концентрация ионов, которой и определяется величина удельной электрической проводимости.
Наряду с удельной электрической проводимостью используются также величины молярной электрической проводимости
=/с. (17.3)
Молярная электрическая проводимость– это проводимость раствора такого объема, в котором содержится один моль электролита, и раствор помещен между плоскими параллельными электродами, находящимися на единичном расстоянии друг от друга.
Рис.
17.1. Зависимость
удельной
электрической
проводимости (Ом–1см–110–1)
водных растворов некоторых электролитов
от концентрации (моль/л)
![]() . (17.4)
. (17.4)
При определении численных значений важно знать, молярная концентрация какой частицы рассматривается. Часто указывают электрическую проводимость частицы, которая соответствует ее химическому эквиваленту, т.е. концентрация выражается в единицах нормальности. Поэтому используется также понятиеэквивалентной электрической проводимости*:
![]() , (17.5)
, (17.5)
где +и–– число катионов и анионов, образующихся при диссоциации молекулы, аz+иz–– их заряды.
Например, концентрацию серной кислоты можно выражать в моль-экв/л, т.е. через концентрацию частиц 1/2 H2SO4,в этом случае
(H2SO4) = 2*(1/2 H2SO4).
В случае 1–1-валентных электролитов и*совпадают.
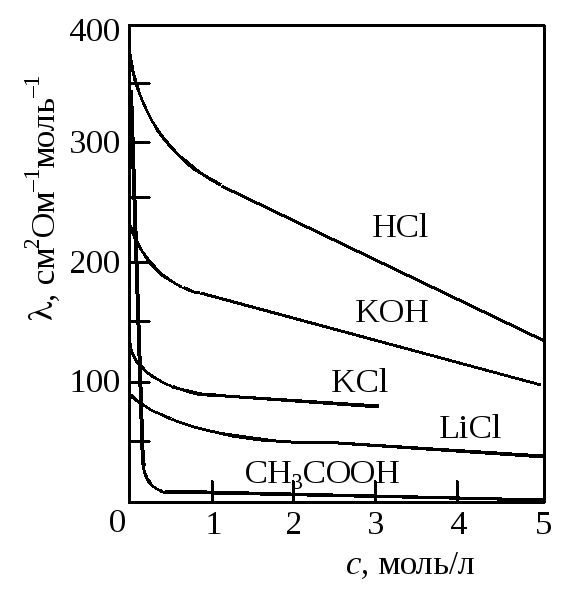
Рис. 17.2. Зависимость
молярной
электрической
проводимости
от концентрации
электролита
Рис. 17.3. Зависимость
от
![]() для водных растворов некоторых
электролитов
для водных растворов некоторых
электролитов
В случае слабых электролитов при возрастании концентрации уменьшается степень диссоциации, и число ионов в объеме раствора уменьшается.
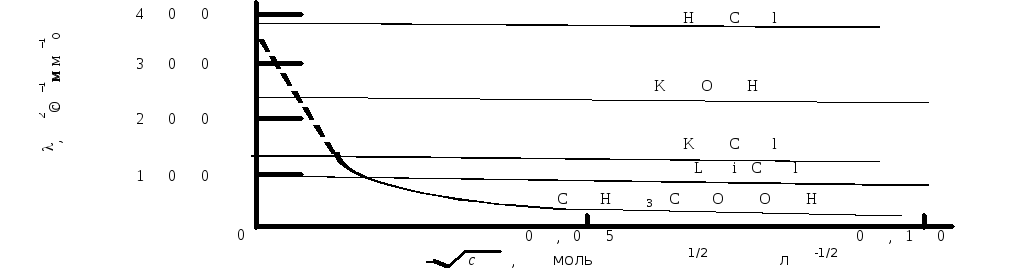
Кольрауш экспериментально установил, что в области разбавленных растворов молярная электрическая проводимость линейно уменьшается с увеличением корня квадратного из концентрации (рис. 17.3), что выражается эмпирическим уравнением Кольрауша:
![]() , (17.6)
, (17.6)
где o– предельная молярная электрическая проводимость, т.е. электрическая проводимость при бесконечном разведении ( oприc 0),A– эмпирическая константа, зависящая от природы раствора.
