
- •Глава 17. Электрическая проводимость растворов электролитов
- •17.1. Удельная и молярная электрические проводимости
- •17.2. Подвижность ионов
- •17.3. Зависимость молярной электрической проводимости от концентрации
- •17.4. Эффекты Вина и Дебая – Фалькенгагена
- •17.5. Электрическая проводимость неводных растворов
- •17.6. Числа переноса
- •17.7. Измерение электрической проводимости растворов электролитов
- •17.8. Кондуктометрическое титрование
- •17.9. Определение констант диссоциации
17.9. Определение констант диссоциации
В первом приближении степень диссоциации можно вычислить из соотношения=/o. Подставив это значение в уравнение закона разведения Оствальда, получим:
![]() . (17.43)
. (17.43)
Таким образом, для вычисления константы диссоциации экспериментально определяют молярную электрическую проводимость , а значенияoполучают из суммы предельных подвижностей ионов. В случае отсутствия таких данных можно использовать предложенный Краусом и Бреем графический метод. Уравнение (17.38) можно преобразовать к виду:
![]() . (17.44)
. (17.44)
Это уравнение прямой в координатах 1/–cс тангенсом
угла наклона, равным 1/![]() ,
а отрезок, отсекаемый прямой на оси
ординат, равен 1/o.
,
а отрезок, отсекаемый прямой на оси
ординат, равен 1/o.
Уравнение (17.43) основано на теории диссоциации Аррениуса и не учитывает межионного взаимодействия. Фактически степень диссоциации должна рассчитываться не по приближенному уравнению (17.27), а по соотношению (17.26) с учетом коэффициента электрической проводимости.
Фуосс и Краус предложили для определения констант диссоциации уравнение
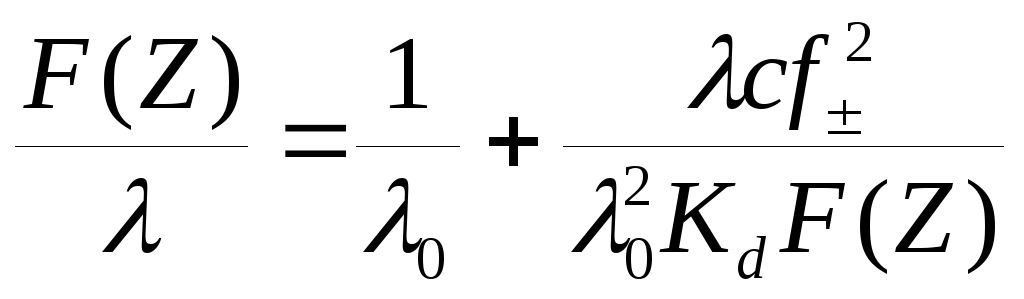 , (17.45)
, (17.45)
где
![]() , (17.46)
, (17.46)
коэффициенты В1иВ2имеют те же значения, что и в уравнении Онзагера (17.23).
Расчет ведется методом последовательных приближений. Вначале, построив график 1/–c, находят приближенное значениеoи рассчитывают функциюF(Z). Затем рассчитывают степень диссоциации=/oF(Z)и коэффициент активностиfпо уравнению Дебая–Гюккеля при ионной концентрацииc. По полученным данным строят график зависимостиF(Z)/отcf/F(Z)и находят более точное значениеo. Расчет повторяют до получения прямолинейной зависимости и по тангенсу угла наклона прямой вычисляют константу диссоциации.
В настоящее время предложено также ряд других уравнений для определения констант диссоциации по кондуктометрическим данным.
